Actualités - Dernières nouvelles - 2014 à 2017
15/09/2017 - Comment 8 firmes ont-elles triché, avec la complicité de rhumatologues et la crédulité des agences, pour faire croire à la supériorité de leurs nouvelles biothérapies sur HUMIRA® dans le traitement de fond de la polyarthrite rhumatoïde après échec du méthotrexate ?
Nous connaissions les médicaments « me-too », il faudra désormais aussi composer avec les essais cliniques « me-too »…
Dans l’ordre alphabétique, Bristol-Myers-Squibb, Janssen Biologics (Groupe Johnson & Johnson) en partenariat avec GSK, Lilly, Pfizer, Roche (en co-promotion avec Chugaï Pharma France), et Sanofi, sont les 8 firmes pharmaceutiques tricheuses.
Dans l’ordre chronologique de la tricherie répétée, organisée, voire concertée :
Année | Firme | DCI | Classe | Nom de marque | Autorisé / commercialisé | Etude terminée / publiée / durée | Biothérapie plus efficace qu’HUMIRA®? | Posologie dans le bras HUMIRA® |
2012 | Pfizer | tofacitinib | inhibiteur des Janus Kinases (JAK1, JAK2, JAK3) | XELJANZ® | 06/11/2012 FDA 22/03/2017 EMA | « ORAL Standard 1 », 08/2012 26 semaines | Non | 40 mg toutes les 2 semaines |
2013 | Bristol-Myers-Squibb | abatacept | Immunosuppresseur sélectif (CTLA-4) | ORENCIA® | 21/05/2017 EMA
23/12/2005 FDA | « AMPLE 2 », 01/2013 | Non | 40 mg toutes les 2 semaines |
2013 | Roche & Chugaï Pharma France* | tocilizumab | inhibiteur de l’interleukine 6 (IL-6) | ROACTEMRA® | 01/2009 EMA
08/01/2010 FDA
12/2009 (France) | « ADACTA 3 », 05/2013 24 semaines | Oui | 40 mg toutes les 2 semaines |
2016 | Sanofi | sarilumab | inhibiteur de l’interleukine 6 (IL-6) | KEVZARA® | 23/06/2017 EMA 22/05/2017 FDA | « MONARCH 4 », 11/2016 (online) 24 semaines | Oui | 40 mg toutes les 2 semaines |
2017 | Lilly | baricitinib | inhibiteur des Janus Kinases (JAK1, JAK2) | OLUMIANT® | 16/03/2017 EMA En cours FDA (**) | « RA-BEAM 5 », 02/2017 52 semaines | Oui | 40 mg toutes les 2 semaines |
? | Janssen & GSK | sirukumab | inhibiteur de l’interleukine 6 (IL-6) | « CNTO 136 » | En cours FDA/EMA | « SIRROUND-H 6, 7 », terminée depuis 08/2016, non publiée 52 semaines | Non, ACR50 sans différence significative | 40 mg toutes les 2 semaines (***) |
(*) : La FDA a demandé de nouvelles données cliniques à Lilly dans une lettre complète adressée le 14 avril 2017. La firme prévoit de soumettre une nouvelle demande d’enregistrement à la FDA en janvier 2018 (source : ici)
(**) : Co-promotion du ROACTEMRA® avec le laboratoire japonais Chugaï Pharma France
(***) : A partir de la semaine 16, les patients qui n’avaient pas amélioré de plus de 20 % leurs nombres d’articulations enflées et nombres d’articulations douloureuses, « échappaient » et étaient basculés sur l’adalimumab 40 mg administré toutes les semaines (Il n’est pas précisé sur ClinicalTrials s’ils étaient ou pas sortis de l’essai)
Illustration avec OLUMIANT®, bariticinib, de la firme américaine Lilly :
En effet, ce mardi 12 septembre 2017, le Journal Officiel de la République Française publiait 3 textes réglementaires concernant les 4 présentations de cette toute nouvelle spécialité pharmaceutique :
- Un arrêté du 8 septembre 2017 d’inscription sur la liste des médicaments remboursés aux assurés (ici),
- Un arrêté du 8 septembre 2017 d’inscription sur la liste des médicaments remboursés aux collectivités (ici)
- Un avis relatif au prix d’OLUMIANT®, JO du 12 septembre 2017 (ici)
Les prix étant applicables 4 jours après la publication au JO, nulle doute que des rhumatologues vont se ruer pour prescrire cette nouvelle biothérapie, à plus de 9.000 € de coût de traitement annuel.
Note : Prix public TTC : 735,38 € la boite de 28 comprimés dosés à 2 ou 4 mg ; 2.103,63 € la boite trimestrielle de 84 comprimés. Soit un coût annuel de traitement de 9.586,20 € (B28) ou 9.140,77 € (B84). Le conditionnement trimestriel peu paraître un peu moins onéreux, mais à ce prix-là, si on arrête le traitement au bout d’un mois, quel gâchis !
Hélas, à présent « les jeux sont faits ! »
Les choses n’avaient donc pas trainé pour les laboratoires Lilly. Reprenons la chronologie des événements qui ont abouti à ces publications récentes au JO :
13/02/2017 - Autorisation en Europe par l’EMA, le 13 février 2017 (information rapportée presque en temps réels par une presse spécialisée, destinée aux industriels du médicament : ici)
Mais, autorisation rejetée par la FDA le 14 avril 2017 (même informateurs toujours aussi bien renseignés : ici)
L’EMA se serait-elle faite bluffer, comme en atteste l’EPAR (téléchargeable : ici) dont voici un extrait de la version française ci-dessous :

Déjà, un petit souci, on comprend que toutes les études, et il y en a 4 (RA-BEGIN, RA-BEAM, RA-BUILD et RA-BEACON), ont démontré après 12 semaines de traitement une supériorité du baricitinib par rapport au placebo, au méthotrexate et à l’adalimumab. Or, seule l’essai « RA-BEAM » comportait un bras avec comme comparateur l’adalimumab
Afin de vérifier s’il s’agit d’une erreur de traduction, voyons l’EPAR (« rapport public de l’évaluation européenne »), en version anglaise (téléchargeable : ici)

Non, la traduction est bonne. Cette phrase est donc très mal formulée, en plus d’être fausse et trompeuse, ce que nous découvrirons un peu plus loin.
16/02/2017 - Publication dans le New England Journal of Medicine des résultats de l’étude RA-BEAM (déjà pris en compte par l’agence européenne, à qui la firme avait transmis les données alors que l’étude était « en cours de publication »)
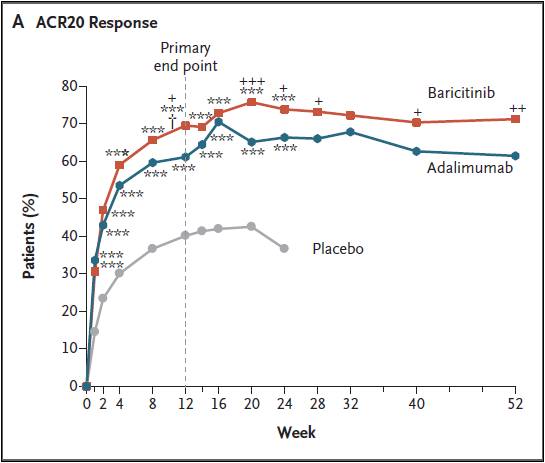
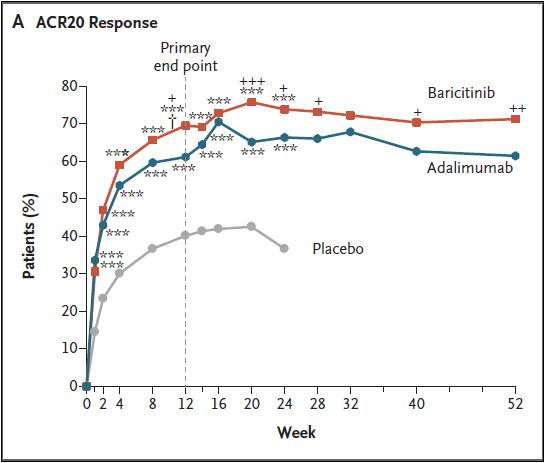
Proportions de patients qui améliorent d’au moins 20% leur score clinique ACR (défini par le collège américain des rhumatologues, en fonction notamment des nombres d’articulations enflées et/ou douloureuses)
.
*** : p<0,001 versus placebo ; +, ++, et +++ : p< 0,05, p<0,01 et p<0,001 respectivement baricitinib versus adalimumab
« A première vue », d’après-la courbe ci-dessus, le baricitinib semble bien entrainer une réponse clinique supérieure à celle observée avec HUMIRA®, adalimumab. Pour identifier la supercherie, il fallait être un peu plus perspicace que ne l’a été l’EMA et procéder à quelques indispensables vérifications…
Nous verrons ça un peu plus loin,
05/07/2017 la HAS publie sur son site l’avis de sa commission de la transparence relatif à OLUMIANT® (téléchargeable : ici) en date du 21 juin 2017.
Bien que n’accordant qu’une amélioration du service médicale rendu (ASMR) de niveau V, c’est à dire « nulle » ou « absence » de progrès thérapeutique, l’avis entérine quand même une « supériorité démontré d’OLUMIANT® associé au méthotrexate par rapport à HUMIRA® » :

La HAS serait-elle aussi « tombée dans le panneau » ?
Le compte-rendu de la réunion du 21 juin (à télécharger : ici) nous apprend que la commission y avait simplement adopté le projet d’avis rédigé à la suite de la réunion précédente du 7 juin 2017 (accessible : ici).

L’assertion lu dans l’avis du 21 juin selon laquelle OLUMIANT® serait supérieur à HUMIRA® est bien mentionnée dans la synthèse des débats figurant dans le compte-rendu de la réunion du 7 juin. Cependant, cette synthèse est bien trop succincte pour permettre d’appréhender la teneur des débats ayant eu lieu ou pas entre les membres de la commission. Seule la transcription intégrale sténotypée de la réunion du 7 juin 2017 permettrait de le savoir. Mais ce document vraiment important pour évaluer la qualité du travail de la commission, n’a pas à ce jour encore été mis en ligne sur le site de la HAS (ici). Il faut savoir que ces transcriptions intégrales des réunions de la commission de la transparence sont relues très attentivement par … les industriels qui peuvent en « caviarder » certains passages. Une des raisons probables à leur publication toujours différée par la HAS. A suivre donc… L’une des questions qui se posent encore est de savoir si l’unique représentant des rhumatologues (ici) siégeant à la commission et référent pour cette discipline, est ou non, intervenu au cours du débat ? et de quel manière ?
Revenons à présent sur la seule étude, « RA-BEAM » qui ait comparé le baritinicib à l’adalimumab sur des critères cliniques de jugement.
Tout d’abord quelques mots sur la méthodologie de l’étude :
Cet essai a randomisé des patients en échec de méthotrexate seul ou d’une bithérapie (sulfasalazine ou hydroxychloroquine)
A noter que les patients traités par trithérapie étaient exclus et pour cause... En effet, l’association méthotrexate + sulfasalazine + hydroxychloroquine, au vue des données acquises de la science, avant l’arrivée du baricitinib, se révèle aujourd’hui constituer la meilleure option dans le traitement de fond de la polyarthrite rhumatoïde après échec du méthotrexate seul. Cela, devant n’importe quelle association méthotrexate + anti-TNF-alpha, dont l’adalimumab est l’un des représentants (voir : ici). LILLY ne pouvait bien évidemment pas prendre le risque de se mesurer à la triple association conventionnelle, de crainte que son poulain, le baricitinib, ne fasse moins bien !
L’essai RA-BEAM comportait trois bras :
- placebo
- baricitinib 4mg/j per os
- adalimumab (HUMIRA®) 40 mg en injection
sous-cutanée une semaine sur deux
Tous les patients étaient maintenus sous le traitement de fond conventionnel préexistant à l’inclusion dans l’essai
Le critère principal de jugement était le score ACR20
La première question qu’il fallait se poser :
Le comparateur choisi, « HUMIRA® 40 mg en injection sous-cutanée une semaine sur deux » était-il pertinent ? Pour y répondre, il suffisait de consulter les posologies recommandées dans les autorisations de mises sur le marché :
D’après la base de données médicamenteuses indépendante THÉRIAQUE® :

L’administration toutes les deux semaines de 40 mg d’adalimumab n’est donc pas le traitement optimisé pour tous les patients. En particulier, ceux qui ne tolèrent pas bien le méthotrexate ou dont la réponse est insuffisante sous ce traitement
L’EPAR de l’agence européenne du médicament, donne la même version. Ce qui est normal puisque l’autorisation de mise sur le marché à suivi une procédure centralisée :

A noter qu’en Europe les agences insistent sur l’importance de poursuivre le traitement par méthotrexate lors de l’utilisation d’HUMIRA®…
Idem dans le « Label » américain décerné par la FDA :

La supériorité d’une administration hebdomadaire chez les patients en monothérapie d’HUMIRA® est établie depuis une étude publiée en 2004 8.
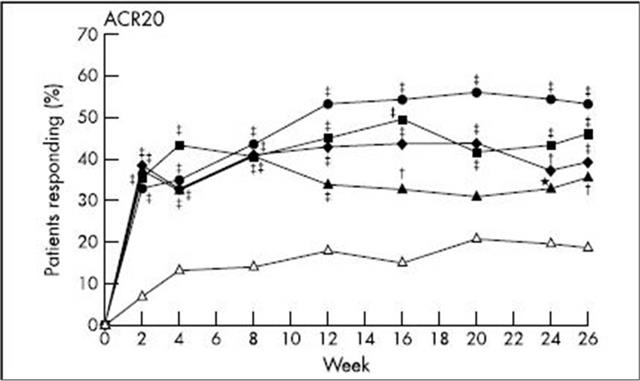

Le graphique ci-dessus montre bien en monothérapie chez des patients en échec ou intolérants au méthotrexate, la supériorité de l’adalimumab 40 mg toutes les semaines par rapport à une administration toutes les 2 semaines, elle-même supérieure à une administration hebdomadaire de 20 mg. La moindre efficacité étant obtenue à la posologie de 20 mg toutes les 2 semaines.
Par ailleurs, la recommandation forte de poursuivre l’administration du méthotrexate de façon concomitante à celle de l’adalimumab, s’appuie sur les résultats d’une autre étude, « PREMIER 9 », publiée en 2006 :
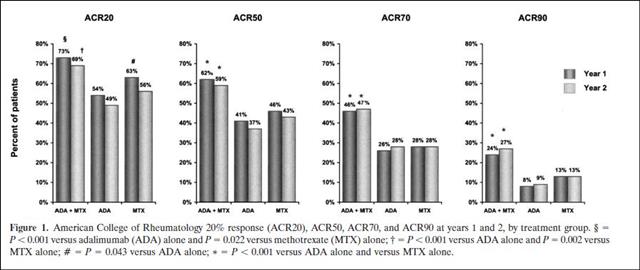
Cette étude qui comparait trois stratégies thérapeutiques, association adalimumab 40 mg toutes les deux semaines et méthotrexate 20 mg par semaine (avec aussi 5-10 mg d’acide folique par semaine), adalimumab seul, et méthotrexate seul, avait clairement démontré l’importance d’associer l’adalimumab au méthotrexate chez des patients à un stade précoce d’une polyarthrite rhumatoïde sévère non prétraités par le méthotrexate. Ce dernier en monothérapie est même supérieur à l’adalimumab après un an et même deux ans de suivi. C’est dire la faible efficacité d’HUMIRA® en monothérapie…
Une seconde question qu’il était primordiale de se poser, concernait l’optimisation ou non des doses de méthotrexate dans l’essai RA-BEAM. D’autant plus, comme nous venons de le voir, qu’HUMIRA® marche mal lorsqu’il n’est pas associé au méthotrexate. :
Pour y répondre, il fallait consulter les documents annexés à la publication
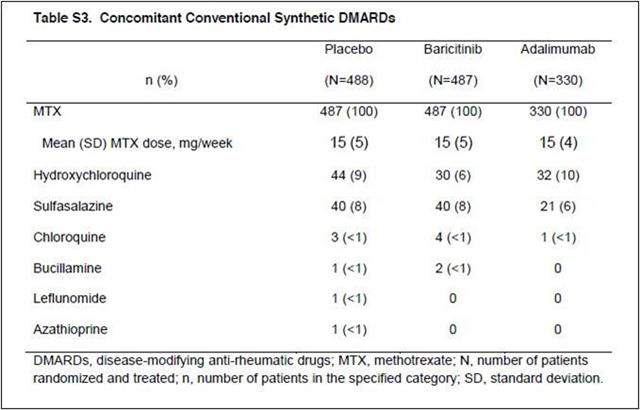
Or, précisément dans l’essai RA-BEAM 5, le méthotrexate était administré à dose sub-optimale
La répartition des patients par posologie de méthotrexate n’est pas publiée
La proportion de patients recevant le méthotrexate par voie injectable n’est pas non plus connue…
De même, l’administration conjointe d’acide folique qui améliore la tolérance du méthotrexate, n’est pas précisée !
Les patients en échec de méthotrexate inclus dans les trois bras de l’essai RA-BEAM 5, n’avaient en moyenne que 15 mg par semaine de méthotrexate. Moins de 20% bénéficiaient d’un deuxième DMARDs conventionnel. Aucun ne bénéficiait de la triple association de DMARDs conventionnels (critère de non inclusion dans l’essai)
Or l’utilisation du méthotrexate est depuis longtemps bien codifiée dans le traitement de fond de la polyarthrite rhumatoïde. Si l’on se réfère par exemple à la revue générale de James O’DELL, publiée en 2004 dans le NEJM 10 :
- La plus grande efficacité du méthotrexate est obtenue à des doses allant de 17,5 à 30 mg par semaine,
- Mais son absorption per os peut être hautement variable, si bien qu’il ne faut pas hésiter en cas de réponse insuffisante à tenter l’administration sous-cutanée ou intramusculaire,
- L’administration concomitante d’acide folique (1 à 3 mg par jour) ou d’acide folinique (2,5 à 5 mg donnés 12 à 24 heures après l’administration hebdomadaire du méthotrexate), permettent de diminuer significativement de nombreux effets de toxicité sans perte d’efficacité et a amélioré considérablement la tolérance des patients au méthotrexate.
Au total, dans l’essai RA-BEAM, ni le rythme d’administration de l’adalimumab (HUMIRA®), ni la posologie du méthotrexate, n’ont été optimisés. Il s’agit bien entendu d’une manipulation visant à exagérer la « quantité d’effet » dans le bras OLUMIANT®, baricitinib par rapport a un médiocre comparateur
Ci-dessous, nous avons superposé avec la même échelle d’ordonnée les graphiques donnant les proportions de patients ayant atteint le score clinique ACR20 dans l’essai RA-BEAM à droite et à gauche dans l’essai publié en 2004 comparant l’efficacité de l’adalimumab (HUMIRA®) en monothérapie en fonction de sa posologie et de sa fréquence d’administration toutes les deux semaines ou hebdomadaire.
Il est bien évident que le passage d’une administration toutes les deux semaines d’HUMIRA® 40 mg en monothérapie (courbe de gauche colorisée en bleu) à celui d’une administration hebdomadaire (en rouge), s’accompagne d’une amélioration au moins égale, sinon supérieure, à celle observée dans l’essai RA-BEAM (courbes de droite) entre HUMIRA® (courbe bleue) et OLUMIANT® (courbe rouge).
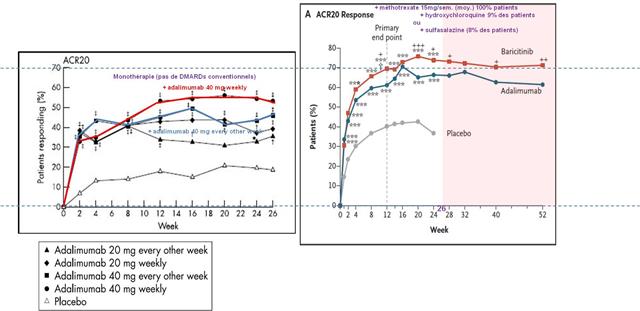
La ficelle était grosse, mais peut être pas assez, pour l’EMA ou la HAS…
Le staff Marketing des laboratoires Lilly, ses délégués hospitaliers, doivent se « frotter les mains ». Ils vont pouvoir dès lundi prochain déambuler dans les services de rhumatologie en brandissant l’avis de la commission de la transparence du 21 juin 2017, qu’ils résumeront ainsi : « Vous voyez, même la HAS a reconnu qu’OLUMIANT® est supérieur à HUMIRA® »
Mais si Lilly était encore la seule firme à avoir triché pour faire croire à la supériorité de sa biothérapie sur le médicament le plus coûteux de la planète (et plus de 470 millions d’euros remboursés en 2016 par l’assurance maladie en France, ce qui en fait aussi le numéro 1 de l’héxagone…). Loin s’en faut. Elles sont 8 à l’avoir fait (voir le tableau proposé au début de l’article).
Pfizer a été la première. Son XELJANZ®, tofacitinib, inhibiteur de Janus Kinase, comme le baricitinib, était d’ailleurs en session de rattrapage devant la commission de la transparence avant-hier (Voir sur l’ordre du jour : ici). L’étude « ORAL Standard 1 » qui a donné le « La » aux autres firmes en terme de méthodologie de la « bidouille », n’a même pas réussi malgré la « triche » à produire un meilleur résultat d’efficacité par rapport au comparateur « amoindri » :
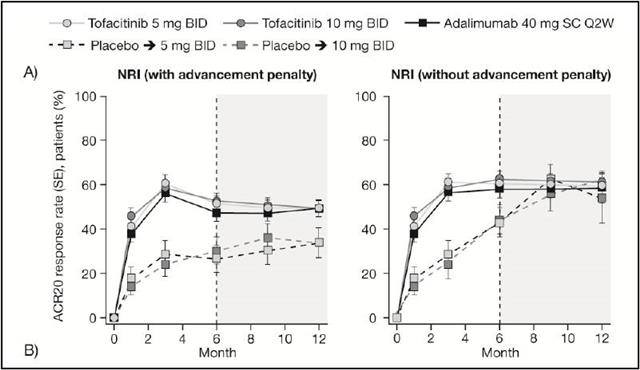
Bref, l’administration hebdomadaire d’HUMIRA® aux patients qui le nécessitaient auraient probablement conduit à conclure à l’infériorité de ce nouveau prétendant…
Tel fut le cas aussi d’ORENCIA®, abatacept, chez Bristol-Myers-Squibb (BMS), dans l’essai « AMPLE 3 »
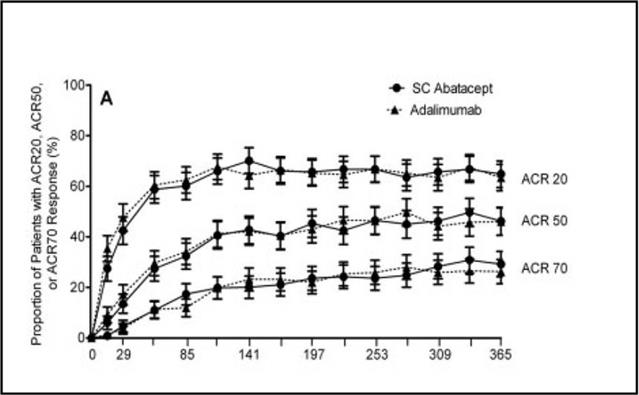
Il est intéressant de noter que dans cet essai, les patients ont reçu en association aux biothérapies plus de 17±6 mg de méthotrexate par semaine dans les deux groupes.
Néanmoins, l’embellissement des essais thérapeutiques a été fructueux pour deux autres firmes
Mention spéciale pour les 2 plus gros tricheurs, les firmes Roche et Sanofi. Elles n’ont pas hésité dans leurs études à mettre les patients en monothérapie stricte d’adalimumab (HUMIRA®) dans le groupe de contrôle, dont on connait pourtant la très faible efficacité (inférieure au méthotrexate en monothérapie) depuis l’étude PREMIER 9
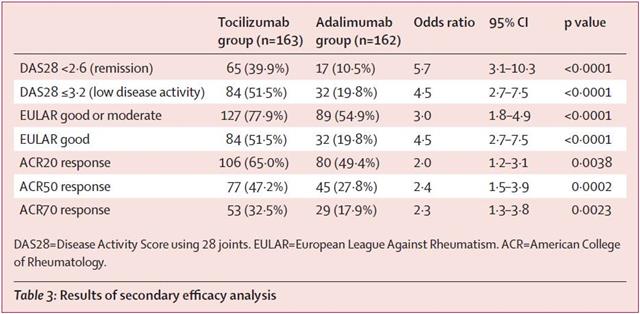
Pour les laboratoires Roche, voici donc les résultats attendus (tellement prévisible) de leur étude « truquée » dénommée « ADACTA 3» :
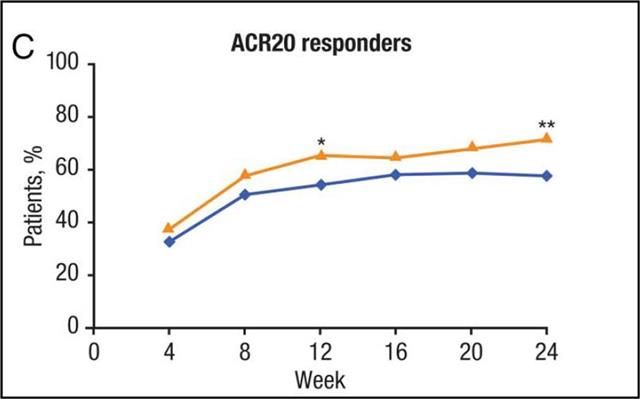
Quant à Sanofi-Aventis qui attend sans doute beaucoup de son KEVZARA®, sarilumab, un autre inhibiteur de l’interleukine 6, il n’a pas résisté à la tentation de tricher de la même manière. Son essai baptisé « MONARCH 4 », montre une augmentation certes significative de la proportion de patients atteignant le score ACR20 sous HUMIRA® 40 mg toutes les 2 semaines, du même ordre de grandeur que celle que nous avons observé avec le baricitinib, alors même que l’adalimumab est donné en monothérapie stricte dans le groupe de contrôle :
On retrouve ici les problèmes éthiques posées par la majorité des études menées par les rhumatologues dans le traitement de fond de la polyarthrite rhumatoïde, la plupart comparative au placebo, dans lesquelles des patients sont laissés pendant des mois sous traitement inefficace, au risque de destructions articulaires, et de dégradations irréversibles. Nous avons déjà souligné ce travers en rhumatologie (ici).
Enfin, Janssen (groupe J&J), en partenariat avec GlaxoSmithKline (GSK), ont présenté en novembre 2016 au congrès de l’ACR les résultats de leur essai « SIRROUND-H 7 » comparant leur sirukumab, toujours sans nom de marque, à l’adalimumab (HUMIRA®) 40 mg toutes les deux semaines. Il s’agit aussi de monothérapies dans les 3 bras de l’étude, mais contrairement à Roche et Sanofi, Janssen avait prévu une « sortie de secours » dès 16 semaines de traitement pour les patients du groupe HUMIRA® qui n’avaient réduit de plus de 20% les nombres d’articulations douloureuses ou enflées. Ces patients bénéficiaient d’une administration hebdomadaire d’HUMIRA® ou étaient basculés dans l’un des deux groupes sous sirukumab. Les résultats de cet essai ne semblent pas encore avoir été publiés
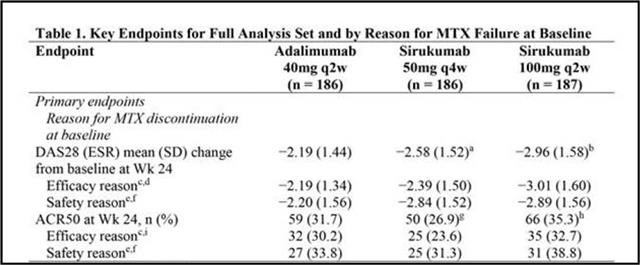
(a) : p=0,013 vs adalimumab 40mg q2w.
(b) : p<0,001 vs adalimumab 40mg q2w.
(g) : p=0,306 vs adalimumab 40mg q2w.
(h) : p=0,464 vs adalimumab 40mg q2w.
Des résultats qui n’ont rien d’extraordinaire et étaient prévisibles compte-tenu de l’inefficacité avérée 9 de l’adalimumab en monothérapie…
En conclusion :
Relevons néanmoins une petite phrase satisfaisante dans l’avis de la commission de la transparence de la HAS du 21 juin 2017 sur OLUMIANT® :

Mais, cela reste très insuffisant. On continue de tourner autour du pot. La HAS a encore perdu une occasion de revoir les stratégies recommandées dans le traitement de fond de la polyarthrite rhumatoïde ? Combien de temps les patients vont-ils devoir attendre pour qu’elles soient formalisées :
- En 1ère ligne le méthotrexate en monothérapie à doses efficaces (25 ou 30 mg par semaine + acide folique ou folinique)
- En cas d’échec (réponse insuffisante : ni rémission, ni même activité faible de la maladie) = 2ème ligne : la triple association de DMARDs conventionnels
- Seulement en 3ème ligne, envisager une biothérapie de préférence associée au méthotrexate.
En fait, nous piétinons depuis 3 ans et les avis de la commission de la transparence du 23 juillet 2014, qui (enfin) avaient presque consacré les deux meilleurs médicaments dans la polyarthrite rhumatoïde des firmes Pfizer et Sanofi-Aventis, SALAZOPYRINE® (sulfasalzine) et PLAQUENIL® (hydroxychloroquine), qui tous deux associés au méthotrexate, forment la triple association conventionnelle, meilleure option thérapeutique. En effet, la trithérapie n’est pas moins efficace que n’importe quelle association de biothérapie au méthotrexate, selon la revue méthodique Cochrane abrégée et méta-analyse canadienne en réseau publiée dans le British Medical Journal en avril 2016 (ici). Elle génère moins d’effets indésirables sévères que l’infliximab (REMICADE®, un autre anti-TNF-alpha), et est beaucoup moins onéreuse. SALAZOPYRINE® et PLAQUENIL® ne coûte que 6 euros la boite pour un mois de traitement. Alors, évidemment, les firmes font beaucoup plus de profits avec les biothérapies (plus d’un milliard d’euros en 2016), qu’elles promeuvent lourdement auprès de rhumatologues « pourris-gâtés » (ici). Les patients ont besoins d’autre chose que de biothérapies si dangereuses (ici) et si coûteuses…
[1] : Tofacitinib or Adalimumab versus Placebo in Rheumatoid Arthritis. N Engl J Med 2012;367:508-19. Accès libre : ici.
[2] : Head-to-Head Comparison of Subcutaneous Abatacept Versus Adalimumab for Rheumatoid Arthritis. Arthritis Rheum. 2011 Oct; 63(10): 2854–2864. Accès libre : ici.
[3] : Tocilizumab monotherapy versus adalimumab monotherapy for treatment of rheumatoid arthritis (ADACTA): a randomised, doubleblind, controlled phase 4 trial. Lancet, Volume 381, Issue 9877, Pages 1541 - 1550, 4 May 2013. Accès libre : ici.
[4] : Efficacy and safety of sarilumab monotherapy versus adalimumab monotherapy for the treatment of patients with active rheumatoid arthritis (MONARCH): a randomised, double-blind, parallel-group phase III trial. Ann Rheum Dis 2017;76:840–847. Accès libre : ici.
[5] : Baricitinib versus Placebo or Adalimumab in Rheumatoid Arthritis. N Engl J Med 2017;376:652-62. Accès libre : ici.
[6] : A Study Comparing Sirukumab (CNTO 136) Monotherapy With Adalimumab (HUMIRA®) Monotherapy in the Treatment of Active Rheumatoid Arthritis (SIRROUND-H). ClinicalTrials.gov Identifier: NCT02019472. Accès : ici.
[7] : Quand même, un abstract de l’essai « SIRROUND-H » a été présenté au congrès annuel de l’ACR le 16 novembre 2016 : ici. Un communiqué de presse de GSK (partenaire de JANSSEN) daté du 16 novembre 2016 (ici). Un communiqué le même jour de JANSSEN (groupe Johnson & Johnson) : ici
[8] : Efficacy and safety of adalimumab as monotherapy in patients with rheumatoid arthritis for whom previous disease modifying antirheumatic drug treatment has failedAnn Rheum Dis 2004;63:508–516. Accès libre : ici.
[9] : The PREMIER Study - A Multicenter, Randomized, Double-Blind Clinical Trial of Combination Therapy With Adalimumab Plus Methotrexate Versus Methotrexate Alone or Adalimumab Alone in Patients With Early, Aggressive Rheumatoid Arthritis Who Had Not Had Previous Methotrexate Treatment. Arthritis Rheum. 2006 Jan;54(1):26-37. Accès libre : ici.
[10] : Therapeutic Strategies for Rheumatoid Arthritis - Review Article. James O’DELL. N Engl J Med 2004;350:2591-602. Accès à l’abstract : ici.
03/08/2017 - Marisol TOURAINE, Agnès BUZYN, deux ministres en charge de la santé, aussi peu soucieuses d’efficience l’une que l’autre !
Le 17 mai 2017 avait lieu Avenue de Ségur la passation de pouvoir entre Marisol TOURAINE, ministre en charge de la santé pendant tout le quinquennat du Président François HOLLANDE et Agnès BUZYN, choisie par le nouveau Président Emmanuel MACRON.

VOISIN/PHANIE - Le Généraliste - 17/05/2017
Marisol TOURAINE, n’a pas été un bon exemple pour Agnès…
Juste une semaine auparavant, elle faisait signer en son nom par deux de ses proches collaborateurs un arrêté d’inscription du KEYTRUDA®, pembrolizumab, sur la liste des médicaments onéreux remboursés en sus des prestations d’hospitalisation (dite « liste en sus », traduire « gratis » pour les hôpitaux) dans l’indication de certains cancers bronchiques non à petites cellules (CBNPC) localement avancés ou métastatiques prétraités par chimiothérapie (Donc un traitement en 2ème ligne).
En effet, et contrairement aux médicaments « ordinaires » (le terme technique est « inclus dans les GHS », c'est-à-dire « Groupes homogènes de séjours ») qui sont financés par une partie des recettes de la tarification à l’activité, ceux de la liste en sus ne coûtent absolument rien aux hôpitaux puisque l’assurance maladie les rembourse à 100% et sans sourciller…
Ce médicament commercialisé par la firme américaine MERCK SHARP & DOHME (MSD), faisait partie de la « crème » des « innovations de rupture » dans le cancer que nous annonçait depuis quelques mois le LEEM, syndicat de l’industrie pharmaceutique.
Après une longue négociation avec le CEPS, « Comité économique des produits de santé », le JO publiait enfin le 10 janvier 2017 le prix de ce médicament : 1.616,75 € TTC le flacon de 15 ml de poudre pour solution injectable, renfermant 50 mg du précieux nectar, le pembrolizumab, soit à peine plus de 32 millions d’euros le kilo.
En deuxième ligne dans le CBNPC localement avancés ou métastatiques, ce médicament est administré à raison de 2 mg/ kg toutes les 3 semaines ; Pour un patient de 70 kilos, trois flacons sont donc nécessaires pour une perfusion et le coût annuel de traitement est donc de…
84.071 euros
La Commission de la transparence de la Haute Autorité de Santé, qui détermine le progrès thérapeutique des nouveaux médicaments, avait dans son avis du 3 mai 2017, accordé une ASMR IV, c'est-à-dire un progrès mineur, sur la base des résultats de l’étude KEYNOTE-010 publiés dans le Lancet en décembre 2015. L’encadré ci-dessous montre à quel point les experts de la commission sont loin d’avoir été subjugués par les résultats obtenus dans cette étude.
Cliquer sur l’image ci-dessous pour télécharger l’avis de la commission de la transparence

Gagner 1,9 mois de survie globale après une première chimiothérapie à base de sels de platines, en seconde ligne avec le pembrolizumab par rapport au docétaxel, sans gain de survie sans progression de la tumeur, avec un biais de suivi, sans que l’on sache si le comparateur choisi (docétaxel) est le meilleur en 2ème ligne.
Mais surtout, il faut savoir qu’une étude randomisée menée dans le service d’oncologie thoracique de l’hôpital général de Boston, Massachusets, a établi que les soins palliatifs précoces comparativement à la chimiothérapie classique dans le CBNPC localement avancé ou métastatique permettait d’augmenter la survie globale de 2,7 mois (soit davantage qu’avec le KEYTRUDA® dans l’étude KEYNOTE-010 financée par MSD), de réduire l’anxiété et la dépression (plus de deux fois moins de syndromes dépressifs), la douleur, les nausées chez les patients, avec un moindre recours au antidépresseurs et une qualité de vie améliorée (N Engl J Med 2010;363:733-42 ; Voir un résumé en français et une vidéo ici). Aucune biothérapie ciblée dans le cancer du poumon n’a fait aussi bien jusqu’à présent.
Il faudrait probablement exiger dans les essais cliniques de ces molécules toujours plus onéreuses la présence d’un bras témoin avec soins palliatifs précoces, et cela pour juger également de l’impact des traitements sur la qualité de vie…
Il est intéressant de constater dans la liste des comparateurs fournie dans l’avis (une liste d’ailleurs incomplète), qu’ils ont tous une ASMR soit absente, soit nulle, soit mineure, et que l’absence d’essai comparatif est une fois de plus déplorée par la commission et entrave considérablement ses travaux…
Compte-tenu de cet ASMR IV, Madame TOURAINE n’était nullement tenue d’inscrire KEYTRUDA® sur la liste en sus pour cette indication.
A noter, que KEYTRUDA®, anticorps monoclonal humanisé qui se lie au récepteur PD-1 (« programmed cell death-1 », donc « mort programmée des cellules », avec ça si on ne guérit pas tous les malades…), n’est pas le premier médicament de cette nouvelle classe. OPDIVO®, nivolumab, des laboratoires BRISTOL-MYERS SQUIBB (BMS) l’avait précédé de quelques semaines ou mois selon les différentes localisations de cancer (mélanome malin, poumon, et il y en aura sans doute de nombreuses autres) et types de tumeurs ou de cellules (épidermoïde ou non). Dans les indications qui nous intéressent ici, OPDIVO® avait reçu de la commission de la transparence une ASMR IV dans son avis du 11 janvier 2017 toujours en 2ème ligne dans certains CBNPC de type non épidermoïde. Marisol TOURAINE n’avait pas tardé à inscrire dans cette nouvelle indication OPVIDO® sur la fameuse liste en sus par un arrêté du 3 mars 2017. Elle n’y était pas obligée non plus…
Un point remarquable tout de même : L’avis de prix publié le 27 décembre 2016 au JO pour OPDIVO®, suite également à une longue négociation de BMS avec le CEPS, établissait à 1.319,63 € le prix hors taxe d’OPDIVO® 10 mg/ml (nivolumab) solution à diluer pour perfusion en flacon de 10 ml (verre) et à 527,852 € celui du flacon de 4 ml également dosé à 10 mg/ml. La posologie étant de 3 mg/kg de nivolumab perfusés toutes les deux semaines, pour un sujet de 70 kilos, 2 flacons de 10 ml et un flacon de 4 ml sont nécessaires par séance de chimiothérapie. Vous ne le croirez pas, nous arrivons à un coût annuel de traitement pour OPDIVO® de…
84.074 €
Non, vous ne rêvez pas. Il semble bien que MSD se soit aligné sur le prix négocié par BMS avec le CEPS…
Depuis, le prix a baissé pour OPDIVO® au 1er avril (ce n’est pas « un poisson », cela était sans doute prévue lors de la négociation). Le coût annuel de traitement est depuis lors de 72.949 €. En revanche, KEYTRUDA® est resté aux mêmes prix TTC et coûts annuels.
Comprendra qui pourra…
Il est causasse de constater que les laboratoires MSD lors de la « Paris Healthcare Week », le salon de l’hôpital, organisée au Palais des expositions de la porte de Versailles, avaient l’outre-audace d’offrir à leurs visiteurs une plaquette les présentant comme « partenaire de l’efficience hospitalière » et un fascicule consacré aux études médico-économiques et aux avis d’efficience…


Marisol TOURAINE n’a pas été très brillante non plus en matière d’efficience sur le dossier du traitement universel de l’hépatite C chronique par les antiviraux à action directe (voir ici) ou encore plus récemment sur celui des médicaments anti-Alzheimer, pour ne prendre que quelques exemples marquants. Sa seule décision à peine courageuse fut de radier l’AVASTIN®, bévacizumab des laboratoires ROCHE, de la liste en sus pour ses seuls indications de cancers du sein et du rein, par arrêté du 29 juillet 2016 (ici et là). Voir plus bas la « parenthèse » AVASTIN®…
Agnès BUZYN, notre nouvelle ministre de la santé, ne semble pas non plus très soucieuse d’efficience, et nous l’imaginons mal contrarier les industriels du médicament…
A peine avait-elle pris son « maroquin » que l’ancienne présidente de la Haute Autorité de Santé, précédemment ancienne présidente de l’Institut National du Cancer (INCa) et auparavant onco-hématologue pédiatrique de l’hôpital Necker, le 13 juin 2017 prenait un arrêté « modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale » afin d’y ajouter deux génériques d’ALIMTA®, pémetrexed, analogue de l’acide folique, commercialisé par la firme américaine LILLY depuis octobre 2004, et inscrit sur la liste en sus le 10 mai 2005. L’heureux élu était le laboratoire TEVA Santé, qui venait donc d’obtenir son « graal » (une inscription sur la liste en sus), pour trois présentations de pémetrexed (flacons de 4, 20 et 40 ml, dosés à 25 mg/ml) commercialisées sous le nom de marque d’ « ARMISARTE® ».
Quelle idée incongrue, alors que cela était (enfin) l’occasion rêvée (pour le coup ratée) de radier de la liste en sus le pémetrexed dans ses indications de cancers bronchiques, « en 1ère ligne associé au cisplatine dans le cancer bronchique non à petite cellule localement avancé ou métastasé à histologie épidermoïde non prédominante », également « en 2ème ligne en monothérapie » ainsi qu’en « traitement de maintenance (ou « d’entretien », c‘est d’ailleurs surtout la firme pharmaceutique que l’on entretient…).
Mais préalablement quelques explications s’imposent :
A l’origine de la liste des médicaments onéreux (créée par un arrêté publié le 10 mai 2005 : ici), un médicament était inscrit pour toutes ses indications autorisées (AMM). Peu importe si dans certaines indications le bénéfice clinique apporté était inexistant.
La création de cette liste en sus est sans conteste l’un des plus gros ratés médico-économiques de la réforme 2004 de l’Assurance maladie, orchestrée par Philippe DOUSTE-BLAZY, Ministre en charge de la santé à l’époque, épaulé par un certain Frédéric VAN ROEKEGHEM, qui fut son directeur de cabinet avant d’être nommé directeur général de la CNAMTS, puis de l’UNCAM. L’un des autres ratés ayant été de rétablir un cordon ombilical reliant l’Assurance maladie aux plus hauts sommets de l’Etat, justement en ayant instauré la nomination de son directeur général par le président de la république en conseil des ministres. Les lobbys des industries de la santé n’ont plus qu’à jouer de leur influence au plus haut niveau pour obtenir tout ce qu’ils désirent. Le haut fonctionnaire en charge de l’Assurance maladie n’a plus qu’à obéir. Et on vous dira quand même que l’Assurance maladie ce n’est pas l’Etat…
Grossières erreurs furent les premières radiations de cette liste, au seul motif que les médicaments éjectés avaient perdu leurs brevets et du même coup fortement baissé de prix (une variable du coût, mais loin d’être la seule), sans avoir réfléchi aux médicaments partageant les mêmes indications qu’ils laissaient sur la liste.
Première injustice, à compter du 1er mars 2010, les 2 molécules suivantes, par ordre d’apparition dans l’arrêté du 15 février 2010, comparateurs pertinents de l’ALIMTA® selon la Haute Autorité de Santé, étaient radiées : paclitaxel (TAXOL® et ses génériques), vinorelbine (NAVELBINE® et ses génériques).
Pour bien comprendre les effets collatéraux de cette funeste radiation :
Dans les mois qui la suivirent, une chimiothérapie de paclitaxel (radié) allait coûter à peine 30 € (prix marché public obtenu dans le cadre d’appels d’offres hospitaliers), financés sur une partie des recettes de la T2A. Une séance de chimiothérapie « rapporte » à l’hôpital environ 500 € quelque soit le ou les médicament(s) présent(s) dans la poche de chimio. Alors qu’une séance de chimiothérapie avec ALIMTA® coûtaient près de 2 500 €, soit plus de 80 fois plus onéreuse, sans procurer le moindre bénéfice clinique démontré par rapport au paclitaxel (Dans le cancer bronchique non à petite cellule, ALIMTA® est non inférieur à la gemcitabine, GEMZAR®. Et TAXOL®, paclitaxel n’est pas inférieur au GEMZAR®, gemcitabine…). Mais le comble, c’est que ces 2 500 € sont totalement gratuits pour l’hôpital. En revanche, ils sont bien prélevés sur nos cotisations sociales. Trouvez l’erreur !
[Calcul : posologie = 500 mg pémetrexed / m2 de surface ; pour un sujet pesant 75 kg et mesurant 1,70 m, la surface corporelle calculée est d’environ 1,9 m2. 500 mg x 1,9 = 950 mg de pémetrexed à administrer. Pour cela, on disposait de flacons dosés à 500 mg ou 100 mg. Le coût est minimal en prenant 2 flacons de 500 mg = 2 x 1 225,20 € TTC = 2 450,40 € TTC ; Le prix d’un flacon dosé à 100 mg était de 273,63 € TTC, ce qui multiplié par 5, rendait les 500 mg en flacons de 100 mg à 1 268,15 € TTC]
Nous pourrions faire à peu de choses près le même calcul avec AVASTIN®, bévacizumab, resté sur la liste, aussi coûteux et aussi peu efficace dans le CBNPC que le pémetrexed…
La Ministre était alors Roselyne BACHELOT-NARQUIN…
Seconde injustice, juste un an plus tard au 1er mars 2011, c’est au tour de la gemcitabine (GEMZAR® et ses génériques), autre comparateur pertinent pour la HAS, de se faire débarquer de la liste en sus… Bien sur ALIMTA®, et d’autres comme AVASTIN® (ASMR V en 1ère ligne dans le CBNPC, avis CT du 26 mai 2016) reste(nt) tranquillement sur la liste si convoitée par les labos
Troisième injustice, encore un an plus tard au 1er mars 2012, bis repetita, c’est au tour du docétaxel (TAXOTÈRE® et ses génériques), autre comparateur pertinent pour la HAS, de se faire débarquer de la liste en sus… Bien sur ALIMTA®, et d’autres comme AVASTIN® reste(nt) tranquillement sur la liste si convoitée par les labos
Permettez-moi de faire ici une parenthèse sur AVASTIN®. Certains médias mal informés, ou n’ayant pas pris le temps de vérifier l’information, ou encore bien trop complaisants avec les firmes pharmaceutiques qui les financent pour certains via la publicité sur le médicament, se sont mis à larmoyer pour « défendre » ici et là, un tel ou une telle, suite à la désinscription (enfin !) d’AVASTIN®, ce champion de la dépense futile, de la liste en sus, notamment dans l’indication d’un cancer du sein métastatique, et en laissant croire qu’il s’agissait d’une perte de chance pour le patient ou la patiente, qu’ils instrumentalisaient quelque part pour délivrer un message très décalé avec la réalité de la très médiocre efficacité de ce médicament comme bien d’autres anticancéreux d’ailleurs. Cela constitue une très grave action de désinformation !
Voici un exemple, sur lequel il ne faudrait pas se focaliser, mais il est vraiment intéressant de l’analyser, car hélas, très représentatif de ce que l’on voit de plus en plus souvent dans la presse y compris grand public. Il s’agit d’une femme, malheureusement atteinte d’un cancer métastatique et dont « une certaine presse » s’est fait l’écho récemment :
- La Provence le 6 & le 7 avril 2017 ;
- LCI le 8 avril & le 28 avril 2017 ;
- Ouest-France le 10 avril 2017 ;
- Le Quotidien du Médecin le 12 avril 2017 ;
- Le Parisien le 12 avril 2017 ;
Les propos et affirmations tenus par le médecin oncologue, tels que rapportés par les journalistes, laissent pantois :
« L’Avastin a permis de contrôler sa maladie », « Elle ferait même (l’injection d’AVASTIN®) des "miracles" », …Comment ? « La molécule ciblée empêche le développement des tumeurs en bloquant ses vaisseaux sanguins »
Il est regrettable, une fois de plus, que ces journalistes n’aient pas pris quelques secondes pour mesurer le niveau de confiance que l’on pouvait accorder à cet oncologue en vérifiant l’absence de liens d’intérêts sur le site Transparence Santé ouvert à tous. Peut être seraient-ils tombés de leur chaise en apprenant que le spécialiste était lié au laboratoire ROCHE par 19 conventions (contrats) dont il faudra encore attendre probablement le mois d’octobre 2017 pour en connaitre les montants, assurément beaucoup plus élevés que les 170 avantages ou rémunération perçus par ce médecin des firmes pharmaceutiques et de leurs prestataires, essentiellement des repas et des « hospitalités » pour un montant de près de 5 000 euros entre 2012 et 2016. ROCHE totalisant près d’un tiers des contrats signés comme orateur, expert, conseil, répondant d’études de marché…, par cet oncologue.
Cliquer sur l’image ci-dessous pour télécharger l’analyse structurée des conflits d’intérêts de l’oncologue cité dans la presse en avril 2017 
Il est vrai que l’oncologie médicale, surtout hospitalo-universitaire, fait partie des spécialités qui concentrent le plus de conflits d’intérêts entre médecins et firmes pharmaceutiques. Lesquelles déploient pour fidéliser la prescription de leurs médicaments vedettes des moyens financiers colossaux, mais qui restent proportionnés aux chiffres d’affaires faramineux qu’elles dégagent. Les pratiques « borderline » des laboratoires ROCHE auprès des oncologues sont bien connues (voir ici sur le site de l’association FORMINDEP qui milite pour une formation et une information médicales indépendantes de toute autre intérêt que celui de la santé des personnes).
Pourtant, il y aurait bien d’autre manière d’informer loyalement le grand public sur la réalité de ces médicaments. A titre d’exemple, voici un article remarquable écrit par Tom BLACKWELL dans le National Post, organe de presse anglophone au Canada, dont on pourrait traduire le titre par « Le Médicament et l’argent - Certains traitements peuvent coûter jusqu’à 33 000 dollars par mois, mais sont loin d’être de merveilleux remèdes ». Il démarre par une synthèse qui tient en deux phrases. « Le problème : Beaucoup d’anticancéreux sont prohibitivement coûteux mais offrent plus de publicité tapageuse que d’espoir. Les solutions possibles : Les régulateurs devraient exiger davantage de bénéfice pour le patient avant d’autoriser les médicaments du cancer et conditionner les prix au progrès thérapeutique ». Retrouver cet article ici.
Marisol TOURAINE n’aura finalement radié AVASTIN® de la liste en sus que pour seulement deux indications (cancer du sein et cancer du rein). Mais en fait, aucune de ses autres indications (cancers bronchiques, du colon, de l’ovaire), ne justifient leur maintien actuel, puisque les ASMR sont soit nulles, soit mineures. Il fallait le désinscrire en totalité, et même il n’aurait jamais du y figurer. Ce n’est pas nouveau, l’Institut PUPPEM, « Pour Une Prescription Plus Efficiente du Médicament », réclame sa radiation totale depuis des années :
- L’étude qu’il avait réalisée en août 2011 (ici), avait par la suite été reprise par les inspecteurs de l’IGAS, les Dr Gilles DUHAMEL et Aquilino MORELLE, dans leur rapport sur le financement de la liste en sus (voir les tableaux en annexes, pages 89 à 94, et son titre cité dès le second paragraphe de la synthèse du rapport, page 3). Roselyne BACHELOT était ministre et François FILLON, Premier ministre…
- Dès novembre 2011 (ici), l’Institut PUPPEM proposait la gestion de la liste en sus « indication par indication »,
- Le 27 juillet 2012 (ici), après qu’ait été rendu public le rapport précité, il interpellait la nouvelle ministre Marisol TOURAINE, afin qu’elle n’ignore pas comme l’avait fait son prédécesseur Xavier BERTRAND, la recommandation 2010-25 du Conseil de l’Hospitalisation qui pour la première fois fixait des critères et des règles de bon sens pour inscrire, ne pas inscrire, et pour radier des médicaments de la liste en sus. En vain.
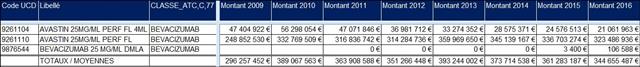
Alors, refermons cette parenthèse, non sans avoir rappelé qu’AVASTIN®, longtemps premier de la liste (en montants de dépenses) avant de se faire rattraper par HUMIRA®, adalimumab (une autre « imposture », mais c’est un autre débat à retrouver ici, là ou encore là-bas) a coûté plus de 3 milliards d’euros à l’assurance maladie entre 2005 et 2016.
Cliquer sur l’image ci-dessous pour télécharger le fichier Excel retraçant l’historique des dépenses d’AVASTIN®
Mais revenons à Agnès BUZYN, notre nouvelle ministre, et aux péripéties d’ALIMTA®, longtemps numéro 5 de la liste des médicaments onéreux. Nous verrons un peu plus loin le détail des dépenses occasionnées par les décisions (ou plutôt leur absence) ministérielles successives…
Tout d’abord, examinons le progrès thérapeutique apporté (ou pas) par le pémetrexed, selon ses trois groupes d’indications AMM, tel qu’il a été déterminé par les experts de la commission de la transparence à la Haute Autorité de Santé.
Le tableau ci-après permet d’apprécier la constance de la commission dans son jugement pour ALIMTA®. Il présente les niveaux de progrès attribués et précise les « populations cibles » par indication.
Avis de la CT
Cliquer sur les liens pour ouvrir les avis de la commission | Indication en 1ère ligne dans le mésothéliome pleural malin | Indication en 1ère ou 2ème ligne dans CBNPC | Indication en traitement de maintenance en monothérapie à la suite d’une chimiothérapie à base de sels de platine dans le CBNPC |
30/03/2005 |
Associé au cisplatine apporte une ASMR modérée (niveau III) en termes d’efficacité par rapport au cisplatine seul.
871 cas par an
|
Pas d’ASMR (niveau V) par rapport au docétaxel (TAXOTERE®).
9 800 à 10 500 cas par an
|
|
26/11/2008 |
|
Associé au cisplatine en 1ère ligne n’apporte pas d’ASMR (niveau V) par rapport à la gemcitabine (GEMZAR®)
En monothérapie en 2ème ligne n’apporte pas d’ASMR (niveau V) par rapport à docétaxel (TAXOTERE®)
10 600 et 6 400 cas/an |
|
05/05/2010 |
|
|
Apporte une ASMR mineure (niveau IV).
2 700 à 4 000 patients par an
|
20/04/2016 |
Associé au cisplatine apporte une ASMR modérée (niveau III) en termes d’efficacité par rapport au cisplatine seul.
941 à 1 073 cas par an
|
|
|
25/05/2016 |
|
Pas d’ASMR (niveau V) en 1ère ligne
Pas d’ASMR (niveau V) en 2ème ligne
10 080 à 10 750 (1ère ligne) 3 882 à 4 150 (2ème ligne) |
ASMR mineure (niveau IV)
5 745 à 6 127 cas par an |
ASMR = Amélioration du service médical rendu (progrès thérapeutique)
Au total, chaque année moins de mille patients atteints d’un mésothéliome pleural malin non résécable, n’ayant pas reçu préalablement de chimiothérapie, pourront bénéficier avec ALIMTA® d’un progrès thérapeutique jugé « modeste » par les experts de la HAS. Tandis qu’environ 20 000 patients souffrant d’un cancer bronchique avancé ou métastatique, le recevront sans amélioration notable de leur état et à un coût considérable financé par la collectivité.
En effet, ce médicament aura coûté plus d’un milliard d’euros à la sécurité sociale entre 2009 et 2016 (données ATIH, traitement François PESTY)
Cliquer sur l’image ci-dessous pour télécharger le fichier Excel

Au Royaume Uni, le NICE déconseille depuis août 2007 son utilisation dans le cancer bronchique (recommandation négative « Do not do recommendation » = Ne pas faire : ici). Nous n’avons que dix ans de retard.
En résumé, les données cliniques qui ont guidé le jugement des experts de la commission de la transparence :
ALIMTA® en mars 2005 était le seul médicament à disposer d’une indication AMM dans le mésothéliome pleural malin. Il n’y avait DONC aucun comparateur. Néanmoins, une étude comparant au cisplatine seul (sel de platine) l’association de pémetrexed + cisplatine, montre un gain de survie de 2,9 mois. D’où l’amélioration modeste du service médical rendu accordée par la commission de la transparence.
En revanche, dans le cancer bronchique non à petite cellule pour lequel il existe de nombreux comparateurs, la non infériorité du pémetrexed au docétaxel n’a pas été démontrée.
En novembre 2008, l’étude examinée par les experts de la CT, conduite chez 1 725 patients ne présentait aucune différence significative de survie globale entre pémetrexed + cisplatine versus gemcitabine + cisplatine ;
En mai 2010, une étude versus placebo menée chez 663 patients ayant reçu 4 cycles de chimiothérapie (gemcitabine ou paclitaxel ou docétaxel associés au cisplatine ou au carboplatine), permettait d’obtenir un gain de 1,7 mois de survie sans progression de la tumeur (critère principal) et de 2,8 mois de survie globale (critère secondaire). Mais, l’étude est non comparative puisque versus placebo…
En avril et mai 2016, lors des réexamens par la commission de la transparence, aucune donnée nouvelle apportée par la firme n’a justifié de modifier les ASMR établies précédemment…
Les décisions d’inscription, ou de non inscription, ou de radiation de spécialités pharmaceutiques sur et en dehors de la liste, n’obéissent finalement à aucune règle, et ne sont que « POLITIQUES »
C’est à Marisol TOURAINE que nous devons le cadre réglementaire actuel. L’exemple-même de la « couardise » politique. Courage, fuyons !
Les conditions (théoriques) à remplir pour accéder au Graal sont celles définies dans l’article R.162-45-8 du Code de la Sécurité Social réécrit par le décret du 24 mars 2016. Voir encadré ci-dessous.
Cliquer sur l’image ci-dessous pour télécharger le décret du 24 mars 2016

Le 3ème alinéa débutait pourtant si bien, en exigeant une amélioration du service médical rendu majeure, importante ou modérée.
Hélas, patatras, la dernière phrase sibylline, surlignée en jaune, réduit tout à néant ou presque :
« Il peut être mineur lorsque les comparateurs pertinents sont déjà inscrits sur la liste ».
Quelle faute politique. Quelle couardise, Madame TOURAINE.
Quel encouragement à ne rien faire !
Notons tout de même que le décideur n’est pas tenu de suivre, mais « il peut »…
Il s’agit d’un rétropédalage par rapport à la recommandation 2010-25 du Conseil de l’Hospitalisation, qui, il faut bien le dire, n’a jamais été appliquée à la lettre par les ministres en charge de la santé
Pourtant, il serait si simple, mais il faut du courage, de radier tout médicament qui se trouve sur la liste dans ses indications qui apportent un progrès nul ou mineur par rapport à des comparateurs pertinents inclus dans les GHS (financés par les recettes de la T2A)
Monsieur le Président MACRON, Monsieur le député Olivier VÉRAN, lors de l’écriture et de la discussion du projet de Loi de financement de la sécurité sociale pour 2018, s’il vous plait, réécrivez cet article du CSS en supprimant cette phrase de la honte…
Comment tolérer plus longtemps de consacrer des milliards d’euros pour financer des médicaments qui dans le cancer ne procurent pas de gains de survie supérieurs aux soins palliatifs précoces ?
Combien de prothèse auditives, de travaux de dentisterie, auraient pu, Madame la Ministre BUZYN, être pris en charge intégralement par l’assurance maladie obligatoire avec ces 4 milliards d’euros dépensés inutilement depuis 2005 sur ALIMTA® et AVASTIN® ?
De grâce, qu’on en finisse une bonne fois pour toute avec le laxisme de la gestion de la liste en sus !
François PESTY
Expert Conseil indépendant pour une prise en charge médicamenteuse plus sure, plus pertinente et efficiente
12/07/2017 - L’Institut PUPPEM révèle pour la première fois le classement 2016 des prescriptions hospitalières de médicaments délivrés en ville pour 1.203 hôpitaux et 9.574 présentations pharmaceutiques. Il analyse la prescription hospitalière dans le répertoire des génériques, et celle des biosimilaires…
Des dépenses très élevées, en forte croissance, extrêmement peu régulées par l’Etat, et qui galopent dans l’indifférence des directions d’hôpitaux et des agences régionales de santé !
Exploiter ces données se mérite : Leur difficile extraction !
Le 21 juin 2017, la CNAMTS mettait en libre téléchargement une énorme base de données « OPEN PHMEV » (ici). L’Institut PUPPEM, « Pour Une Prescription Plus Efficiente du Médicament », est fier d’être le premier à faire une analyse de ces données. Car, disons-le tout net, ce fut une véritable prouesse technique compte-tenu des conditions « bien cavalières » de l’open data de ces 3 fichiers de données (2014, 2015, 2016), aussi volumineux que parfaitement inexploitables en l’état. Ce n’est pas l’objet de cet article, mais il aurait été tout de même plus convenable de proposer au téléchargement 3 fichiers pour chaque année : un fichier « Etablissements de santé », un fichier « Présentations pharmaceutiques de médicaments » et un fichier avec les indicateurs (nombres de boites, bases de remboursement, et montants remboursés). Je passe aussi sur le format texte choisi pour la publication des bases de remboursement et des montants remboursés, impossible à convertir au format monétaire à cause du poids des fichiers. Je souhaite beaucoup de plaisir à toutes celles et tous ceux qui voudront aussi s’y coller…
Que renferme au juste cette nouvelle base de données « libérées » ?
OPEN PHMEV donne les prescriptions médicamenteuses hospitalières délivrées en officine de ville en 2014, 2015 et 2016, en nombres de boites, en bases de remboursement et en montants remboursés, par établissement hospitalier (1203 sur les 3 années) en fonction du sexe (masculin, féminin, inconnu) et de l’âge (0 à 19 ans, 20 à 59 ans, + 60 ans, inconnu) des bénéficiaires.
Il s’agit donc des patients ambulatoires et des prescriptions de sortie, réalisées par les hospitaliers, donc principalement des médecins spécialistes. Néanmoins, il y a fort à parier qu’elles reflètent les prescriptions faites aux patients hospitalisés. Il est possible de trier les établissements en fonction de la région (grandes régions suite au redécoupage) et des départements (2 premiers caractères du N° FINESS), ou encore selon leur catégories (CHR, CH, hôpitaux locaux, Psy, CRLCC et les 3 mastodontes AP-HP, AP-HM et HCL). Il serait sans-doute intéressant à cet égard de croiser avec un autre fichier FINESS, peut être celui de l’enquête annuelle SAE-DREES, ce qui permettrait probablement d’avoir de meilleurs libellés pour les noms d’établissements que ceux proposés par la CNAMTS ; Et puis, surtout de pouvoir relier avec des indicateurs d’activité et de capacités (nombre de lits et places, nombre de journées d’hospitalisation, nombres d’entrées…)
Remarquons néanmoins qu’il existe quelques divergences entre le descriptif de la base de données, et ce qui a été mis en ligne. Par exemple, selon le descriptif, l’AP-HP, comme l’AP-HM et les hospices civils de Lyon, ne devait constituer qu’un seul établissement. Ce n’est pas le cas, et tant mieux d’ailleurs, car on y retrouve tous les hôpitaux de l’AP-HP… Mais alors, quel dommage de ne pouvoir comparer leurs pratiques avec celles des établissements géographiques des deux autres mastodontes (Ex : Hôpitaux Edouard Hériot, La Croix Rousse, GH Est, GH Sud… à Lyon, et à Marseille, La Timone, La Conception, Nord, Sainte-Marguerite…).
Ce que ne contient pas cette base :
Ne figurent donc pas dans ces données, les médicaments rétrocédés (ex : antiviraux à action directe dans l’hépatite C), les médicaments réservés à l’usage hospitalier (ex : REMICADE®, AVASTIN®, et bien d’autres). Peut être serait il judicieux de demander à l’ATIH de faire comme la Cnamts et de libérer les données de la liste en sus par établissement !
Quel intérêt pour juger de l’efficience des prescriptions ?
La Cour des Comptes relevait dans son rapport de septembre 2016 sur l’exécution des Lois de financement de la sécurité sociale que « Les dépenses de médicaments représentent le premier poste de prescriptions hospitalières exécutées en ville (44%, les autres étant les dispositifs médicaux, les analyses de laboratoires, les transports sanitaires, l’imagerie médicale, les indemnités journalières) et qu’elles se distinguent par leur forte progression (+52% en euros constants entre 2007 et 2014). Le cadre juridique et réglementaire de la régulation des dépenses de médicaments prescrits à l’hôpital et délivrés en ville est rappelé en .ANNEXE II
Les données mises en open data par la CNAMTS nous donnent l’opportunité de retracer l’évolution sur les deux dernières années.
Il doit donc être possible d’y constater les mêmes dérives collectives, avec des accentuations plus ou moins prononcées, que celles déjà observées avec les données de l’ATIH (médicaments onéreux de la liste en sus), REDROCED’AM (médicaments délivrés par les pharmacies à usage intérieur des hôpitaux), MEDIC’AM et OPEN MEDIC…
L’importance croissante des prescriptions médicamenteuses hospitalières exécutées en ville
Avec presque 6 milliards d’euros (base de remboursement en 2016), les médicaments prescrits à l’hôpital et délivrés en ville représentent une dépense en définitive assez proche de celle des prescriptions destinées aux malades hospitalisés (hors rétrocession).
Cliquer sur l’image ci-dessous pour télécharger le fichier (haut du 1er onglet)
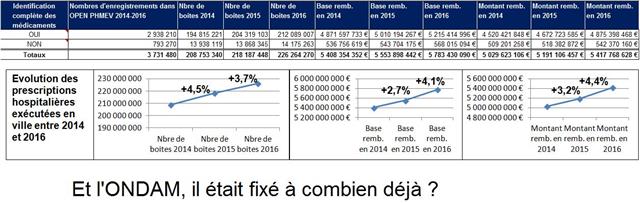
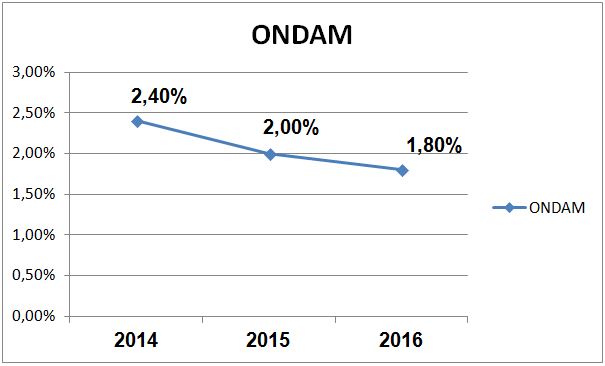
Ce poste du médicament continue donc de caracoler allègrement au-dessus de l’ONDAM (objectif national de dépenses d’assurance maladie) fixé ces dernières années.
Remarque importante : Les données mises en « Open data » contiennent de très nombreux enregistrements pour lesquels la présentation pharmaceutique n’a pas été précisément identifiée (Code CIP13 attribué par la Caisse Nationale = « 9999999999999 »). Voir en ANNEXE I pour plus d’informations…
Classement des 30 premiers hôpitaux, toutes catégories, d’après le montant remboursé en 2016 des prescriptions médicamenteuses hospitalières exécutées en officine de ville
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 2ème onglet)
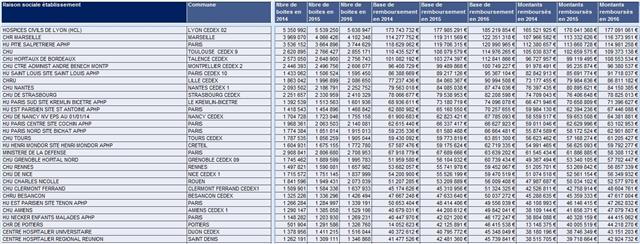
Avec 848.242.229 € de montants remboursés en 2016, l’AP-HP, entité juridique, arriverait nettement devant les hospices civils de Lyon et l’AP-HM. Il est dommage que la base de données mise en open data par la CNAMTS ait fait un traitement différentié des établissements de santé. Il aurait été plus judicieux de ne prendre que les entités géographiques. Nous aurions alors la possibilité de distinguer les différents sites des grands CHU/CHR. Dommage…
Classement des 30 premières présentations pharmaceutiques, d’après le montant remboursé en 2016 (prescriptions médicamenteuses hospitalières exécutées en ville)
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 3ème onglet)
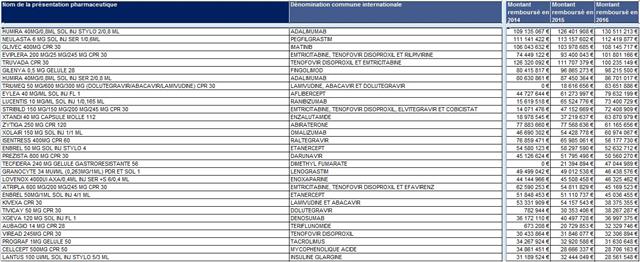
Classement des 30 premières dénominations communes internationales (DCI), d’après le montant remboursé en 2016 (prescriptions médicamenteuses hospitalières exécutées en ville)
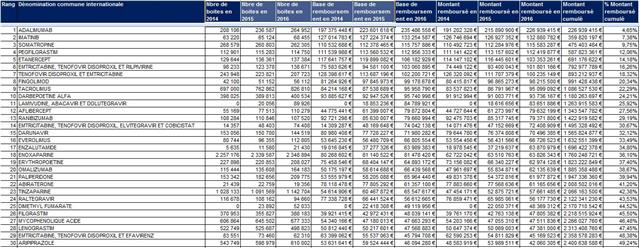
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 4ème onglet)
Classement des 25 premiers sous-groupes chimiques, 4ème niveau de la classification ATC de l’OMS, d’après le montant remboursé en 2016 (prescriptions médicamenteuses hospitalières exécutées en ville)
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 5ème onglet)
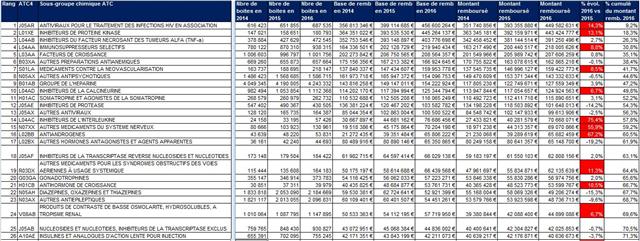
Les cellules colorées en rouge signalent les sous-groupes de médicaments qui ont dépassé le taux maximal de 4% d’évolution nationale des dépenses fixé pour l’année 2016
Classement des 30 premiers CHU/CHR selon la variation des dépenses remboursées de médicaments prescrits à l’hôpital et délivrés en ville en 2016
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 1er onglet)
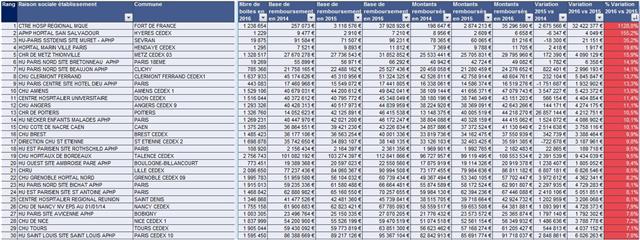
Les cellules colorées en rouge signalent les établissements qui ont dépassé le taux maximal de 4% d’évolution nationale des dépenses fixé pour l’année 2016
Classement des 30 premiers hôpitaux de l’AP-HP selon la variation des dépenses remboursées de médicaments prescrits à l’hôpital et délivrés en ville en 2016
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 1er onglet) 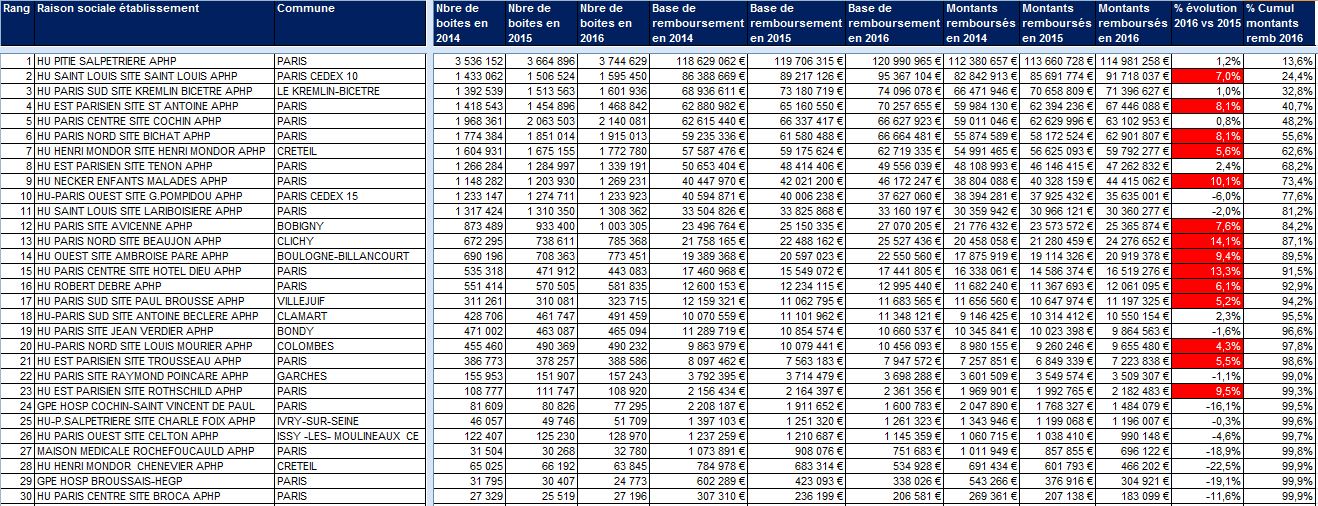
Les cellules colorées en rouge signalent les hôpitaux de l’AP-HP qui ont dépassé le taux maximal de 4% d’évolution nationale des dépenses fixé pour l’année 2016
Parmi les hôpitaux de l’AP-HP qui ont le plus augmenté en 2016 le montant des prescriptions médicamenteuses remboursé sur l’enveloppe de soin de ville : Saint-Louis, Saint-Antoine, Bichat, Henri Mondor, Necker-Enfants Malades, Avicenne et Beaujon…
Classement des 15 CRLCC selon la variation des dépenses remboursées de médicaments prescrits à l’hôpital et délivrés en ville en 2016
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 2ème onglet)
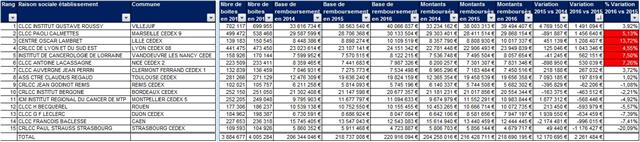
Les cellules colorées en rouge signalent les établissements qui ont dépassé le taux maximal de 4% d’évolution nationale des dépenses fixé pour l’année 2016
Classement des 30 premiers CH selon la variation des dépenses remboursées de médicaments prescrits à l’hôpital et délivrés en ville en 2016
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 3ème onglet)
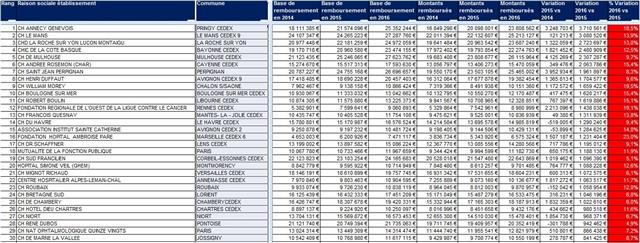
Les cellules colorées en rouge signalent les établissements qui ont dépassé le taux maximal de 4% d’évolution nationale des dépenses fixé pour l’année 2016
Classement des 30 premiers CHU/CHR en nombre de boites prescrites dans le répertoire des groupes de génériques avec le taux de prescription dans le répertoire (dernière colonne)
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 1er onglet, 1.148 établissements dans le 2ème onglet)
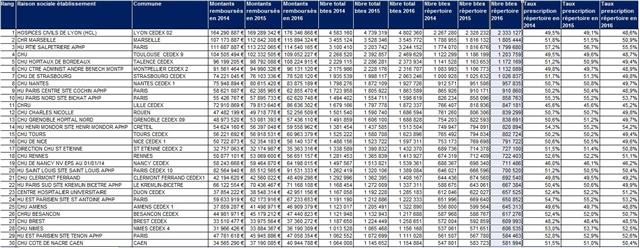
Les calculs ont été réalisés selon la méthodologie décrite dans l’arrêté du 27 avril 2017 relatif au contrat type d’amélioration de la qualité et de l’efficience des soins mentionnés à l’article L.162-30-2 du Code de la Sécurité Sociale (Cf. ANNEXE II plus loin). En l’occurrence, les boites de paracétamol ont été exclues du calcul…
Peu de commentaires, en sachant que le générique existe depuis fort longtemps à l’hôpital et qu’un taux de prescription dans le répertoire des groupes de génériques au alentour de 50% est probablement assez loin de se qu’obtiennent dans un nombre conséquent de classes de médicaments les médecins libéraux qui exercent en ville. Ce taux moyen pour les prescriptions hospitalières exécutées en ville reflète très certainement la forte propension du médecin hospitalier français à prescrire la dernière molécule arrivée sur le marché.
Prescriptions de biosimilaires des anti-TNF-alpha utilisés dans la polyarthrite rhumatoïde
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 1er onglet)
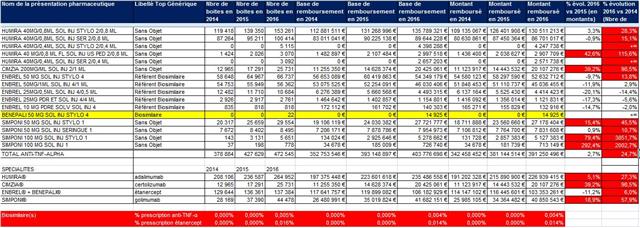
Les cellules colorées en rouge signalent les présentations pharmaceutiques d’anti-TNF-alpha qui ont dépassé le taux maximal de 4% d’évolution nationale des dépenses fixé pour l’année 2016
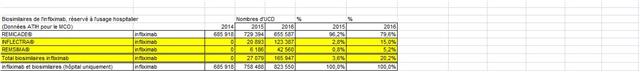
Avec seulement 22 boites de 4 stylos injectables pour injection sous-cutanée d’étanercept, BENEPALI®, le biosimilaire d’ENBREL® (PFIZER), commercialisé par la firme BIOGEN, a fait « choux blanc » en 2016. Même si la date de sa commercialisation selon la base de données médicamenteuses THERIAQUE® aurait été le 3 octobre 2016, une boite de BENEPALI® prescrite toutes les 6.244 boites d’ENBREL®, cela ne fait vraiment pas beaucoup. Il est vrai que les rhumatologues ont confisqué à leurs patients et aux assurés sociaux depuis vingt ans la meilleure option thérapeutique dans le traitement de fond de la polyarthrite rhumatoïde, une triple association de médicaments conventionnels, méthotrexate, sulfasalazine et hydroxychloroquine, au profit d’associations de méthotrexate et d’anti-TNF-alpha, pas plus efficaces, probablement à l’origine de davantage d’événements indésirables graves et surtout, de 14.000 à 24.000 euros plus coûteux par patient et par an (voir ici). Comment voulez-vous qu’ils n’aient aucun état d’âme à ne pas prescrire de biosimilaires, alors que les firmes qui commercialisent les princeps leur offrent des ponts d’or. De fortes corrélations entre les nombres et les montants d’avantages perçus de ces firmes par différents groupes de rhumatologues, ou encore les nombres de conventions (contrats) signés, sont observées avec la place occupée par chaque biothérapie dans les dépenses 2015 en ville et à l’hôpital (voir ici). Dans la même classe de médicaments, REMICADE®, infliximab, le seul anti-TNF-alpha réservé à l’usage hospitalier (donc aucune prescription hospitalière délivrée en ville !), avait plutôt bien résisté au lancement le 1er mars 2015 de deux biosimilaires, INFLECTRA®, des laboratoires HOSPIRA et REMSIMA®, du génériqueur BIOGARAN, filiale de SERVIER. Avec seulement 3,6% de part de marché en 2015, qui aurait cru qu’une prescription sur cinq ferait appel à l’un des deux biosimilaires un an plus tard ? C’est essentiellement HOSPIRA, rapidement rachetés par PFIZER, qui en a profité, tirant encore plus vers le haut les prescriptions d’infliximab (+9% en 2016 !). A noter qu’en volume, les anti-TNF-alpha sont en augmentation de 25% sur deux ans (près de 100.000 boites en plus).
Ci-dessous l’évolution entre 2014 et 2016 de la prescription des anti-TNF-alpha
Cliquer sur l’image ci-dessous pour télécharger le fichier (graphique dans le 3ème onglet)
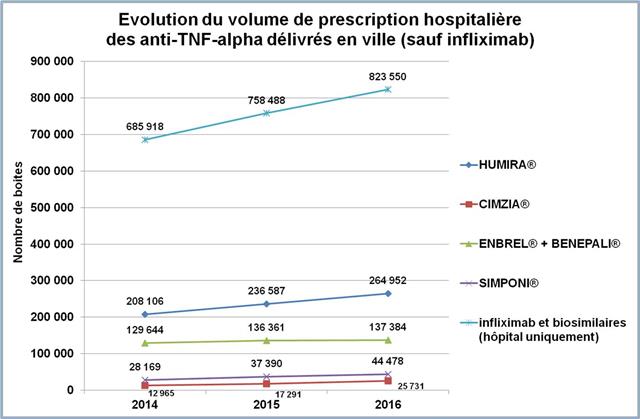
En jetant un œil sur les médicaments conventionnels du traitement de fond de la polyarthrite rhumatoïde, il est clair que le méthotrexate progresse vigoureusement (+26% pour les formes orales). Mais, il doit être chaque fois que cela est possible associé lorsqu’une biothérapie est prescrite (La HAS s’est prononcée pour un service médical rendu insuffisant en cas de prescription d’une monothérapie d’anti-TNF-alpha en première ligne dans la PR). Il n’y a donc rien d’étonnant à ce que la progression du méthotrexate soit calée sur celle des anti-TNF-alpha (+25%). En revanche, même si la totalité de la SALAZOPYRINE® prescrite à l’hôpital et délivrée en ville, l’était en association au méthotrexate et à l’hydroxychloroquine, triple association conventionnelle dans la polyarthrite rhumatoïde, ce qui est évidemment très loin d’être le cas, il n’y aurait guère plus de 2.000 patients traités ainsi (30.983 boites de 100 comprimés dosés à 500 mg de sulfasalazine, à raison de 4 comprimés par jour pour atteindre la posologie recommandée de 2.000 mg/j, donc une boite tous les 25 jours = 2.043). Or, la sulfasalazine est également utilisée en monothérapie ou en bithérapie, mais surtout elle est indiquée dans la maladie de Crohn et dans la rectocolite hémorragique. Ainsi les prescriptions de la trithérapie conventionnelle en France sont restées confidentielles et à un niveau stable (+3,8% entre 2014 et 2016). Même si l’on ne peut pas exclure un transfert de prescriptions gastro-entérologiques vers des indications rhumatologiques, la place de la trithérapie est strictement inférieure à 1% des 223.000 patients en ALD pour polyarthrite rhumatoïde (données CNAMTS : ici)
Ci-dessous l’évolution entre 2014 et 2016 de la prescription des « DMARDs » conventionnels
Cliquer sur l’image ci-dessous pour télécharger le fichier (graphique dans le 4ème onglet)
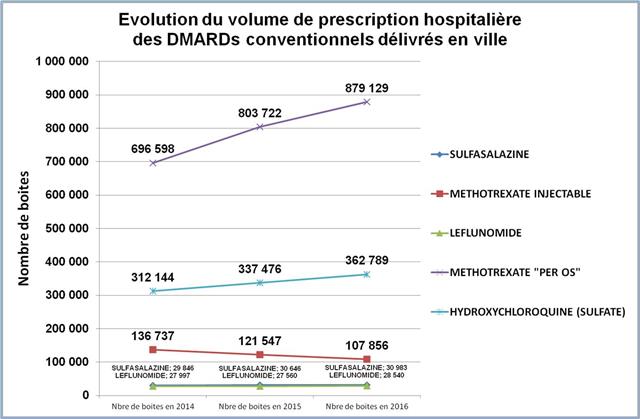
Prescriptions de biosimilaires des facteurs de croissance hématopoïétique (EPO)
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 5ème onglet)
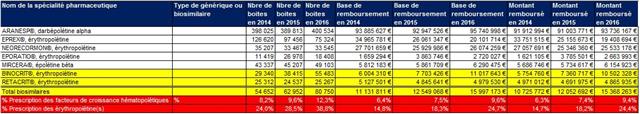
Les biosimilaires de l’érythropoïétine (EPO), dont le référent est EPREX®, de JANSSEN CILAG, BINOCRIT® de SANDOZ, et RETACRIT® des laboratoires HOSPIRA, sont plus fréquemment prescrits. Cependant, il y a lieu d’observé que BINOCRIT® est commercialisé depuis décembre 2009. Donc, un taux prescription inférieur à 40% après 7 années de commercialisation n’a rien d’époustouflant…
Les prescripteurs « boudent » aussi le biosimilaire de l’insuline glargine
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 6ème onglet)
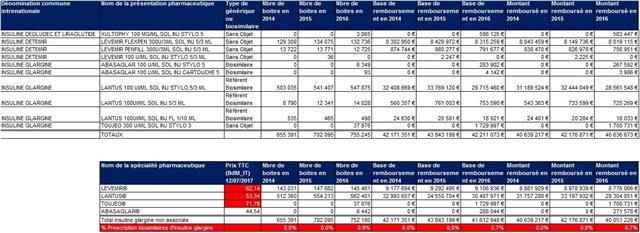
Bien que SANOFI-AVENTIS n’ait lancé sa nouvelle insuline glargine, TOUJEO® qu’en juin 2016, et malgré qu’elle soit 35% plus onéreuse que son LANTUS®, il a fait un « carton». En revanche, le biosimilaire de LILLY®, commercialisé dès janvier 2016 sous le nom d’ABASAGLAR®, 16% moins coûteux que LANTUS® et 38% moins cher que TOUJEO® n’a même pas pris 1% des boites !
Prescriptions de biosimilaires des facteurs de croissance granulocytaires (G-CSF)
Cliquer sur l’image ci-dessous pour télécharger le fichier tableau dans le 7ème onglet)
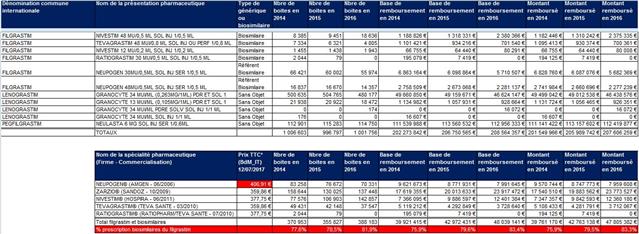
Parmi les 4 classes de biothérapies ciblées en 2016 dans les CAQOS (contrats d’amélioration de la qualité de l’offre de soins) pour améliorer le taux de prescription des biosimilaires, finalement seule celle des facteurs de croissance granulocytaires, aura atteint un taux de pénétration satisfaisant de ses biosimilaires (82% en nombre de boites). Soulignons que pas moins de 4 biosimilaires du filgrastim sont entrés sur le marché entre octobre 2009 et juin 2011. Il faut donc dans le meilleur des cas attendre 7 années et disposer d’une offre multiple de biosimilaires pour atteindre un taux de prescription analogue à celui qu’à conférer le droit de substitution des génériques…
Conclusions et recommandations
Grace à l’open data de la CNAMTS, nous disposons désormais des données qui permettent de constater les très faibles résultats des actions visant à réguler les dépenses de médicaments prescrits à l’hôpital et délivrés en ville, et probablement une certaine disparité des pratiques entre établissements sanitaires. C’est une très bonne chose.
Difficile de trouver une bonne raison pour que l’ATIH n’accepte pas de libérer de la même façon les données concernant la prescription des médicaments inscrits sur la liste en sus des prestations d’hospitalisation.
L’ATIH, parlons-en, elle a récupéré l’enquête annuelle DREES relative aux achats par les PUI, aux consommations des unités cliniques, et aux rétrocessions de médicaments (Voir ANNEXE III). Comment se fait-il que ces données collectées tous les ans auparavant par la DREES entre 2005 et 2013, puis en 2015 et 2016 par l’ATIH, ne soient pas en « Open data » ?
La Cnamts pourrait également offrir un accès public dans les mêmes conditions aux données de la rétrocession (données RETROCED’AM ventilées par PUI).
Nous attendons toujours que l’ANSM débute son « Open data ». Ses données sont restées jusqu’à aujourd’hui jalousement conservées dans ses coffres-forts. Malheureusement, elle est la seule détentrice des données de consommation médicamenteuse relatives aux malades hospitalisés et aux médicaments inclus dans les GHS pour lesquels nous sommes parfaitement aveugles. D’autant plus qu’elle ne fait plus aucune publication en la matière depuis quelques années déjà.
Mais comme le souhaitait la Cour des Comptes dans son rapport de septembre 2016, très sévère, mais très juste aussi, il faudra aller plus loin. Car la « granulométrie », la « maille » pertinente pour juger de l’efficience des prescriptions médicamenteuses n’est pas l’établissement de santé, mais bien celle de la prescription individuelle des médecins. Si l’on pouvait disposer des prescriptions individuelles des médecins à l’échelle de leur patientèle, ce serait un grand progrès.
ANNEXE I
La base de données mise en téléchargement libre par la Cnamts comporte de très nombreux enregistrements pour lesquels le médicament n’a pas été complètement identifié
Ainsi, pas moins de 800.000 enregistrements n’ont pas de code CIP13 identifié et ont été affublés du même code : « 9999999999999 ». Cela fait autant de doublons. Parfois, la dénomination commune a été identifiée
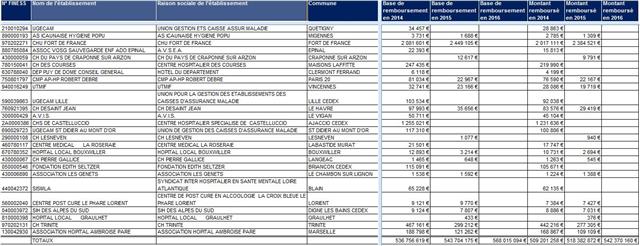
Classement des 30 premières DCI* sans code CIP13 triées par montants remboursés en 2016
(*) dont les DCI non identifiées affublées d’un code ATC5 = « 9999999 », pour un montant remboursé en 2016 de près de 212 millions d’euros !
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 6ème onglet vers la droite)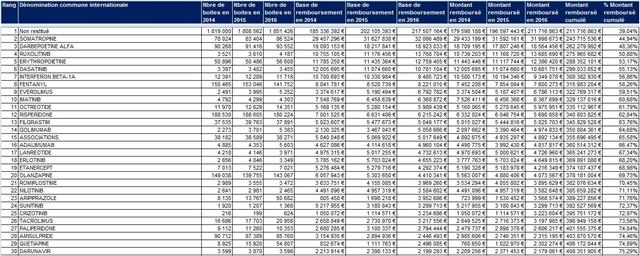
Presque tous les hôpitaux sont concernés par cette identification incomplète des médicaments prescrits
A l’origine probablement un codage incomplet ou une imprécision sur une ordonnance manuscrite ne permettant pas de définir parfaitement la présentation pharmaceutique. Cela représente tout de même plus de 500 millions d’euros et 14 millions de boites de médicaments chaque année. Ces prescriptions hospitalières exécutées en ville mal identifiées représentent quand même 21% des enregistrements (793.270 enregistrements doublons sans code CIP13 défini, contre 2.938.210 enregistrements avec code CIP13 indéfini), 10% des montants remboursés en 2016 et 6,3% des boites de médicaments. Ce n’est pas rien ! La traçabilité de la prescription médicamenteuse hospitalière au patient sortant ou ambulatoire vu en consultation, a de grandes marges de progression…
Haut du listing des prescriptions hospitalières avec identification incomplète du médicament
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 5ème onglet vers la droite)
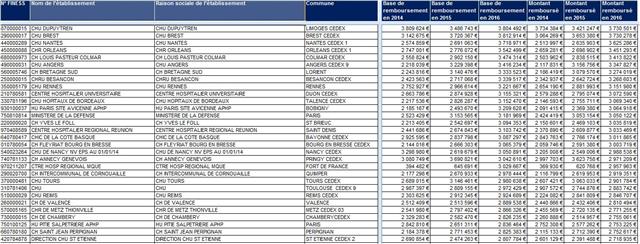
Bas du listing des prescriptions hospitalières avec identification incomplète du médicament
Cliquer sur l’image ci-dessous pour télécharger le fichier (tableau dans le 5ème onglet vers la droite)
Les données téléchargeables sous formes des 3 fichiers .csv mis en « Open data » par la Cnamts ont été séparées dans deux bases de données relationnelles Microsoft® Access 2007, l’une avec les enregistrements avec codes CIP13, et l’autres sans codes CIP13
Aperçu des requêtes, des tables et de leurs relations dans la base de données avec codes CIP13 restitués :
Aperçu des requêtes, des tables et de leurs relations dans la base de données avec codes CIP13 non restitués :
ANNEXE II
Quelques rappels historiques sur l’évolution de notre réglementation technocratique pour mieux appréhender ce qui ressemble beaucoup à une nouvelle usine à gaz sans impact notable sur les pratiques, une exception française de plus :
Une tentative de réguler la dépense qui remonte tout de même à 2009 !
- L’arrêté du 12 octobre 2010, pris en application de l’article 47 de la Loi de Financement de la Sécurité Sociale en 2010 (LFSS 2010) promulguée le 24 décembre 2009, fixait à 6% le taux d’évolution en 2010 des dépenses de médicaments prescrits à l’hôpital et remboursés sur l’enveloppe de ville
- Le Décret du 22 avril 2011 relatif à la régulation des dépenses de médicaments et de la liste des produits et prestations résultant de prescriptions médicales effectuées dans les établissements de santé et remboursées sur l’enveloppe des soins de ville
- L’arrêté du 26 avril 2011 fixe à 6% le taux d’évolution pour l’année 2011,
- L’arrêté du 12 décembre 2011 fixe à 5% le taux d’évolution nationale pour 2012,
- L’arrêté du 14 décembre 2012 fixe à 5% le taux d’évolution nationale pour 2013,
- L’arrêté du 20 décembre 2013 fixe à 5% le taux d’évolution nationale pour 2014,
- L’arrêté du 15 décembre 2014 fixe à 3,2% le taux d’évolution nationale pour 2015,
Un durcissement en 2015, probablement consécutif à l’absence de résultats tangibles :
- Un premier arrêté du 20 mars 2015 avait fixé à 39% le taux de prescription prévisionnel minimum dans le répertoire des groupes de génériques pour la période allant du 1er avril (non, ce n’était pas un « poisson ») au 31 décembre 2015 ;
- Un second arrêté daté du même jour, définissait pour la même période à 4,35 € l’écart entre le prix moyen de vente des médicaments inscrits au répertoire des génériques et celui de ceux qui n’y sont pas.
- Un contrat type d’amélioration des pratiques de prescriptions hospitalières exécutées en ville était publié au JO le 14 juillet 2015.
- L’arrêté du 18 décembre 2015 fixe à 4% le taux d’évolution nationale pour 2016 et à 44% le taux (l’objectif) prévisionnel minimum de prescription dans le répertoire des génériques des médicaments prescrits à l’hôpital et délivrés en ville,
- L’arrêté du 18 décembre 2015, fixe à 4,42 € l’écart entre le prix moyen de vente des médicaments inscrits au répertoire des génériques et celui de ceux qui n’y sont pas.
Une certaine crispation en 2016 sur des objectifs qui semblent hors d’atteinte :
- Une circulaire DSS/DGOS/CNAMTS du 22 juillet 2016, de 58 pages s’il vous plait, décrétait la priorité de gestion du risque pour les prescriptions hospitalières exécutées en ville.
- L’arrêté du 30 décembre 2016 fixait à nouveau à 4% le taux d’évolution nationale pour 2017 et à 44% le taux (l’objectif) prévisionnel de prescription dans le répertoire des génériques des médicaments prescrits à l’hôpital et délivrés en ville,
Principaux articles du Code de la Sécurité Social relatifs à la régulation de la prescription hospitalière exécuté en officine de ville :
- L’article L.162-30-2 du Code de la Sécurité Sociale
- L’article R.162.43 du Code de la Sécurité Sociale
A noter que la circulaire DSS/DGOS/CNAMTS de juillet 2016 mentionne aussi que la LFSS 2016, dans son article 81, prévoyait une « réforme en profondeur des modalités de contractualisation entre les ARS, l’assurance maladie et les établissements de santé, qui devrait substituer aux contrats antérieurs un « contrat simplifié » dit « d’amélioration de la qualité et de l’efficience des soins », porteur d’objectifs d’amélioration des soins, de réduction de la variabilité des pratiques et de régulation des dépenses de l’assurance maladie. Dans l’attente du décret encadrant ce contrat simplifié, les 3 acteurs partenaires étaient invités à poursuivre leurs contractualisations via le vecteur « CAQOS ». Les CAQOS signés en 2016 resteraient en vigueur jusqu’au 31 décembre 2017.
Cependant, et cela caractérise parfaitement le fiasco et l’absence d’intérêt pour cette régulation des dépenses de médicaments, la même circulaire nous apprend (c’est évidemment en annotation de bas de page et en petits caractères que cette information pourtant majeure est distillée) qu’en 2015, seuls 6 contrats avaient été signés avec les directeurs généraux d’ARS et les directeurs de la coordination de la gestion du risque (DCGDR) ;
Enfin, les 22 et 30 avril 2017, étaient publiés au JO pas moins de 3 textes « (re)fondateurs » :
- Décret du 20 avril 2017 fixant les modalités d’application du contrat d’amélioration de la qualité et de l’efficience des soins (5 pages),
- Arrêté du 27 avril 2017 relatif au contrat type d’amélioration de la qualité et de l’efficience des soins mentionné à l’article L. 162-30-2 du code de la sécurité sociale (20 pages),
- Arrêté du 27 avril 2017 fixant les référentiels de pertinence, de qualité, de sécurité des soins ou de seuils, exprimés en volume ou en dépenses d’assurance maladie mentionnés à l’article L. 162-30-3 du code de la sécurité sociale (2 pages) ;
Ce dernier arrêté a confirmé à 4% le taux d’évolution nationale pour 2017 des dépenses de médicaments prescrits à l’hôpital et délivrés en ville et en revanche a rehaussé à 45,5% le taux de prescription dans le répertoire des groupes de génériques
ANNEXE III
L’enquête annuelle DREES-ATIH 2005-2013 et 2015-2016, sur les achats et les consommations de médicaments dans 4.200 établissements de santé
L’ATIH, agence technique de l’information sur l’hospitalisation, a confié à la société IMS Health pour un montant de 500.000 euros la supervision de 200 établissements de santé et la réponse aux questions expertes de la totalité des établissements (environ 4.200 ETS en MCO, HAD, SSR, PSY) via l’animation d’un forum AGORA de l’agence pour l’enquête 2017 achats et consommations de médicaments (données 2015 et 2016) ; Avis d’attribution publié au BOAMP : http://www.boamp.fr/avis/detail/17-79429/11 Voir aussi le cahier des charges (ici) ainsi que le guide méthodologique à l’attention des établissements (ici)
Pour rappel, il s’agit d’une enquête annuelle obligatoire dans laquelle les ETS doivent déclarer pour chaque médicament les nombres d’unités achetés par leur pharmacie à usage intérieur, consommées par les unités cliniques, et les quantités rétrocédées aux patients ambulatoires, ainsi que les prix unitaires d’achat, prix moyens pondérés…, et cela pour tous les médicaments, inscrits ou non sur la liste en sus. L’enquête 2017 s’est enrichie également des consommations des EHPAD rattachés aux PUI…
Plusieurs commentaires :
- D’abord le montant de cette prestation peut sembler élevé
- Ensuite, n’y a-t-il pas un risque de récupération des données par IMS Health qui pourra les revendre au marketing des firmes ? (même s’il y a des clauses de confidentialités prévues au cahier des charges. Cf. page 12…),
- Que fait l’Etat de ces données ?
- Comment se fait-il que ces données (et celles collectées tous les ans auparavant par la DREES entre 2005 et 2013), ne soient pas en Open data ?
Nota : L’ATIH reprend l’enquête en 2017 pour les données 2015 et 2016. Il n’y a pas eu de recueil en 2014…
27/12/2016 - Révélation à la HAS - L’unique rhumatologue de la Commission de la Transparence (CT), et aussi probable leader du groupe de travail « Evaluation médico-économique des biothérapies dans la polyarthrite rhumatoïde » de la Commission d’évaluation économique et de santé publique (CEESP), pourrait avoir dissimulé ses liens d’intérêts avec les firmes qui commercialisent les biothérapies indiquées dans le traitement de cette maladie ou avoir jugé qu’il n’était pas important de les déclarer !
Ce texte constitue un addendum imprévu à « Alibabamumab et les 340 rhumatologues » (ici). Son auteur ayant poussé un peu plus loin sa curiosité, tellement indigné de constater que les patients ne bénéficient toujours pas chez nous de la meilleure option thérapeutique dans la polyarthrite rhumatoïde, et qu’à défaut, ils soient ainsi trop souvent exposés inutilement et dispendieusement à des biothérapies dangereuses et bien plus onéreuses (ici). Le troisième volet de la trilogie, « La caverne d’Ali Baba », attendra encore un peu pour être publié…
La Commission de la Transparence de la HAS comporte un Président, 21 membres titulaires et 7 membres suppléants. Voici sa composition en date du 25/12/2016 :

Le Dr Aymeric BINARD, rhumatologue, a rempli successivement 5 déclarations publiques d’intérêts (DPI) à la HAS, en tant qu’expert et membre permanent de la Commission de la Transparence, les 07/03/2014, 12/04/2015, 07/05/2015, 30/10/2015, et 30/08/2016. Dans sa dernière DPI, il déclare être également membre du groupe de travail « Evaluation médico-économique des biothérapies dans la polyarthrite rhumatoïde ». Ce qui veut dire qu’il travaille aussi pour la Commission d’évaluation économique et de santé publique (CEESP), un dossier dont nous avions déjà souligné le manque de transparence la semaine dernière (ici).
A partir de mai 2015, il déclare dans ses 3 dernières DPI qu’il a participé en mars 2013 à une enquête d’opinion et de pratique concernant la rhumatologie réalisée par ICOMED, entreprise de sondages et d’études de marché. Ce qu’il aurait pu déclarer dès sa première DPI de mars 2014. Mais, il ne déclare rien d’autre.
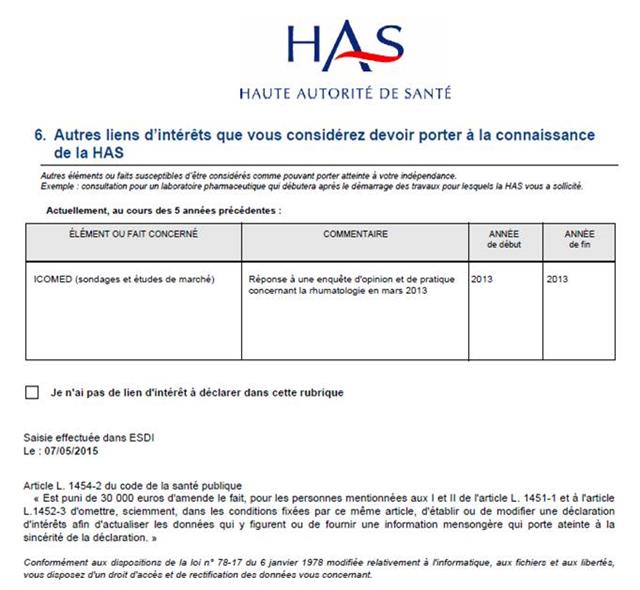
Or, une simple recherche dans la base de données ministérielle Transparence santé, permet de retrouver 8 avantages
perçus par le rhumatologue brestois entre mars 2013 et mai 2015 :
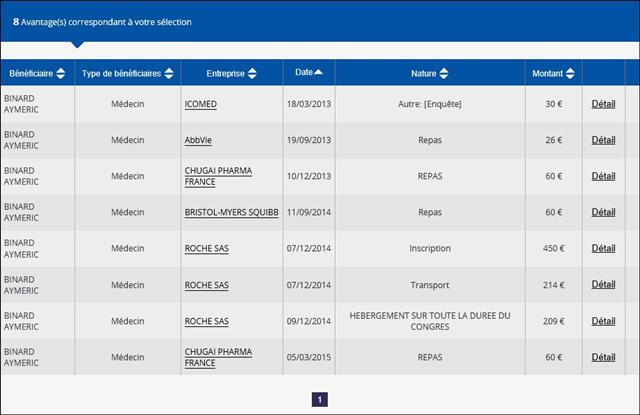
Au total, une prise en charge dans un congrès par le laboratoire ROCHE, pour un montant de 873 euros, et 4 invitations au restaurant avec les laboratoires ABBVIE, BRISTOL MYERS-SQUIBB et CHUGAÏ PHARMA FRANCE pour 206 euros, qui n’ont pas été consignées dans les DPI du Dr BINARD ;
Dans l’ordre chronologique des avantages perçus, ABBVIE commercialise HUMIRA®, adalimumab, leader des anti-TNF-alpha indiqués dans la polyarthrite rhumatoïde (450 millions d’euros de dépenses en ville et à l’hôpital en 2015). Le laboratoire ROCHE, commercialise MABTHERA®, rituximab, et ROACTEMRA®, tocilizumab. Deux biothérapies non anti-TNF-alpha. CHUGAÏ PHARMA FRANCE a un partenariat de co-promotion avec ROCHE pour le tocilizumab. Enfin, BMS commercialise ORENCIA®, abatacept, 3ème biothérapie non-anti-TNF-alpha indiquée dans la PR.
Une convention a également été signée par le rhumatologue avec le laboratoire ROCHE :
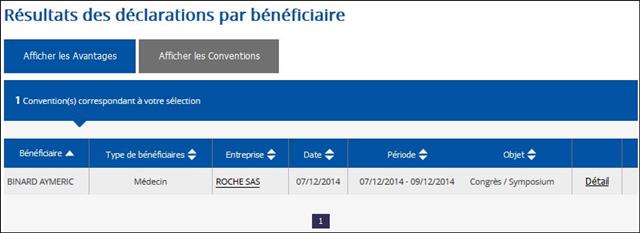
Le formulaire de DPI de la HAS ne spécifie pas explicitement que les invitations au restaurant (« repas ») ou les invitations à un congrès médical soient à déclarer obligatoirement. Seule la dernière rubrique « 6. Autres liens d’intérêts que vous considérez devoir porter à la connaissance de la HAS » permet au déclarant s’il le juge nécessaire de reporter ce type d’avantage ou de convention.
La HAS s’est dotée depuis 2006 d’un Comité déontologie et indépendance de l’expertise qui a notamment édité un « Guide des déclarations d’intérêts et de gestion des conflits d’intérêts » actualisé en juillet 2013. Ce guide semble considérer que l’invitation à un congrès ne constitue un lien d’intérêts majeur que lorsque l’invité y est intervenu.
Cependant, ce même comité constitué de personnalités extérieures à la HAS a rendu le 5 novembre 2014 un avis sur sollicitation du Président de la HAS, à l’époque le Pr Jean-Luc HAROUSSEAU, portant précisément sur l’appréciation d’un lien d’intérêts consistant en la participation à un congrès médical (ici). Le comité a considéré que :
« Toute invitation par un industriel à un congrès révèle l’intérêt que porte cet industriel à la personne invitée et est, de ce fait, susceptible d’être perçue comme ayant des contreparties. En conséquence, une invitation à un congrès par un industriel doit, par principe, être considérée comme créant un lien d’intérêt majeur, qu’il y ait ou non intervention de la part de la personne invitée et, a fortiori, en cas d’intervention, quel que soit le sujet de l’intervention. Il serait approprié que les experts déclarent les invitations aux congrès dont ils ont bénéficié, parmi les autres intérêts, quand bien même ils n’y auraient fait aucun exposé, et alors même que le formulaire des déclarations d’intérêts ne l’impose pas. Une modification de l’arrêté fixant le formulaire de déclaration d’intérêts serait souhaitable sur ce point ».
La HAS n’a manifestement pas suivi pour le moment cet avis de son comité !
S’agissant des « repas », « déjeuner », « dîner », « invitation au restaurant », tous ces mots sont absents du guide et la HAS ne semble pas se soucier de ce qui pourtant est démontré avec un bon niveau de preuve. Se référer par exemple à l’étude publiée le 20 juin 2016 dans le JAMA Internal Medicine (ici).
« Qui vole un œuf, vole un bœuf ». La « taille » du lien d’intérêts ne préjuge en rien de sa capacité à influencer le jugement de celui qui en bénéficie…
Le 22 juillet 2016, la HAS publiait le communiqué de presse suivant « Daniel LUDET, magistrat, nommé déontologue de la HAS » (ici). Il s’agit d’une décision de la nouvelle Présidente, Madame le Pr Agnès BUZYN, par laquelle elle annonçait sa prise de fonction le 17 octobre 2016
Il était mentionné que « Daniel LUDET sera chargé de veiller au respect des obligations de déclarations d’intérêts et de prévention des conflits d’intérêts qui s’imposent à la HAS. Il vérifiera que les décisions issues de l’analyse des liens d’intérêts déclarés sont prises en compte et que les mesures pour prévenir ou faire cesser toute situation de conflits d’intérêts sont appliquées ».
Malgré tout cela et quoi qu’il en soit, le Dr Aymeric BINARD a bien participé aux débats et aux votes des réunions de la Commission de la transparence (CT) portant sur les stratégies thérapeutiques du traitement de fond de la polyarthrite rhumatoïde :
Selon le compte-rendu de la réunion de la CT du 23 juillet 2014 (accessible en suivant le lien ici) daté en bas de pages du 21 janvier 2015 (donc 6 mois plus tard !), le Dr BINARD était présent à la réunion et a participé au vote pour le ROACTEMRA® de ROCHE. Ayant été invité en décembre 2013 par CHUGAÏ PHARMA FRANCE qui co-promotionne ce médicament avec ROCHE, il n’aurait probablement pas du assister au débat, ni voter. Au cours de cette même réunion du 23 juillet 2014, des débats et un vote ont également concerné l’évaluation des traitements de fond classiques non biologiques de la polyarthrite rhumatoïde. En particulier, SALAZOPYRINE®, sulfasalazine, et PLAQUENIL®, hydroxychloroquine, dont les avis de la CT ont pourtant souligné l’efficacité de leur triple association avec le méthotrexate par rapport à l’association méthotrexate anti-TNF-alpha, n’ont fait l’objet que d’un vote sur le SMR et pas sur l’ASMR. Ce compte-rendu confirme bien l’incapacité de la CT à décider d’une réévaluation des ASMR trop généreusement accordées aux biothérapies alors que la triple association conventionnelle ne leur est pas inférieure (ici). Rien n’indique dans le compte-rendu de cette réunion que cette perspective ait pu être débattue et encore moins qu’elle puisse avoir été soutenue par le Dr BINARD.
Selon le CR du 1er avril 2015 (ici), daté du 20 juillet 2015 (soit 3 mois et demi de délai) il est présent et vote pour HUMIRA®, alors qu’il a été invité en mars 2013 par ABBVIE qui le commercialise. Ce vote entérinait en fait un projet d’avis de la commission voté lors de la réunion précédente du 18 mars 2015 (CR ici, daté du 27 juillet 2015, soient 4 mois et demi après la réunion), à laquelle il avait participé et voté.
Selon le CR du 17 juin 2015 (ici), daté du 6 juillet 2016 (soit plus d’un an de délai de publication !), il était aussi présent en réunion et a voté pour ORENCIA®, alors qu’il avait été invité par BMS en septembre 2014… Lors de cette même réunion, il prendra part aussi au vote pour ENBREL®, étanercept, un concurrent des autres biothérapies, comme il avait été présent lors de la réunion précédente du 3 juin 2016 (Compte rendu ici, daté du 6 juillet 2016, soit un an de délai) au cours de laquelle les nouvelles inscriptions de l’étanercept sur la liste des médicaments remboursés dans les indications d’arthrite juvénile et de spondylarthrite axiale avaient été examinées. Alors que Pfizer espérait respectivement des ASMR II et IV, il obtint deux ASMR V (absence de progrès).
Selon le CR du 20 juillet 2016 (ici), daté du 13 septembre 2016 (quel bonheur d’avoir un CR aussi rapidement !), nous faisons le même constat de la participation du rhumatologue aux débats et au vote pour une extension d’indication de CIMZIA®, certolizumab, en traitement en 1ère ligne chez des patients naïfs de méthotrexate. Lors de la même séance, la CT réévalue le SMR de 3 autres biothérapies indiquées dans le traitement de la polyarthrite rhumatoïde sévère, active et évolutive de l’adulte non précédemment traité par le méthotrexate, ENBREL®, REMICADE® et HUMIRA®. Même constatations. Une fois de plus, seul le SMR a été réévalué, alors qu’il aurait été pertinent de revoir l’ASMR et la place dans la stratégie thérapeutique des biothérapies et de la triple association conventionnelle dans le traitement de la PR. Le fait que le CR pour CIMZIA® cite sans la référencée, « la méta-analyse en réseau fournie » (On peut supposer qu’il s’agisse de celle du BMJ 04/2016 ici), laisse entrevoir une nouvelle opportunité manquée par la Commission pour faire cette réévaluation qui aurait du sens tant pour les patients que pour les comptes de l’assurance maladie (ici).
Même schéma pour la réunion CT du 11 mai 2016 (CR ici, daté du 17 novembre 2016, soient six mois de délai, ce qui est bien long) qui portait sur une nouvelle indication de SIMPONI®, golimumab, dans la spondylarthrite axiale non radiographique, décision entérinée par un vote lors de la réunion suivante du 25 mai 2016 (CR ici, daté du 22 novembre 2016, encore six mois de délai de publication).
Lors de la réunion du 22 juin 2016, la CT a décidé d’harmoniser ses avis concernant la « primo injection des médicaments biologiques », dont 7 indiqués dans la PR. selon le CR (ici, daté du 8 décembre 2016, presque 6 mois de délais). Le représentant des rhumatologues était présent et a voté.
Soulignons que lors de la réévaluation des traitements de fond classiques de la polyarthrite rhumatoïde, ainsi que celle des médicaments biologiques chez des patients naïfs de méthotrexate, cela est clairement indiqué dans les comptes-rendus des réunions du 23/07/2014 et du 20/07/2016, la Commission de la transparence s’est appuyée sur les avis et recommandations de la Société Française de Rhumatologie, dont les biais sont pourtant avérés (ici).
Autre remarque, il est vrai et nous l’avons d’ailleurs constaté (ici) qu’il est bien difficile de trouver un rhumatologue sans lien d’intérêts, tant cette spécialité est courtisée par les firmes qui commercialisent ces médicaments biologiques, un marché en ville et à l’hôpital que nous avons valorisé à 1,5 milliard d’euros en 2015 (ici). Et indéniablement, beaucoup d’argent est mis sur la table pour fidéliser les prescripteurs de biothérapies, rien pour les médicaments conventionnels de la triple association…
Conclusions :
Que l’on ne s'y méprenne pas : A la question de savoir si les liens d’intérêts non déclarés à la HAS mais présents pour le Dr Aymeric BINARD dans la base de données Transparence santé (déclarations faites par les firmes), ont ou pas influencé les votes et donc les avis de la commission de la transparence ?
La réponse est non. D’autant, que les ASMR, et l’harmonisation des avis dans la polyarthrite rhumatoïde ont été votés à l’unanimité des suffrages exprimés à chacune des 8 réunions tenues aux dates mentionnées plus haut.
Je n’aurais personnellement pas voté différemment !
Plus que ce qui a été décidé et voté au cours de ces réunions, ce qui est fort regrettable, c’est ce qui ne l’a pas été :
La réévaluation de la place des biothérapies dans la stratégie thérapeutique de traitement de fond de la polyarthrite rhumatoïde par rapport à celle de la triple association de médicaments conventionnels
Ce qui me parait poser problème aussi, ce sont :
- L’absence dans les comptes-rendus de ces 8 réunions de tout élément indiquant que le rhumatologue, membre et expert permanent de la commission le plus qualifié et probablement le plus légitime à le faire, serait intervenu pour demander et recommander cette réévaluation complète de la stratégie thérapeutique,
- L’absence de publication des enregistrements intégraux qui ne permet pas d’écarter formellement l’hypothèse précédente.
La transparence n’est donc pas encore tout à fait au rendez-vous à la HAS. Et l’indépendance, encore moins.
Le Président Loïc GUILLEVIN, quant à lui, n’a participé à aucun de ces débats et votes, respectant ainsi la déontologie en vigueur à la HAS qui considère comme un lien d’intérêts majeur le fait d’être investigateur principal d’un essai clinique randomisé (Etude du MABTHERA®, rituximab, des laboratoires ROCHE, dans les vascularites dont les résultats ont été publiés au NEJM en novembre 2014 (ici)
In fine, cette rapide analyse montre que :
- Les procès verbaux sont trop souvent publiés dans un délai inacceptable (Plus d’un an pour plusieurs PV que nous avons recherchés),
- Ils ne sont pas suffisamment détaillés,
- Les enregistrements intégraux des réunions qui seuls permettraient de juger de la qualité du travail de la commission, ne sont hélas pas publiés. Alors même que le décret du 9 mai 2012 semblait l’exiger (Cf. annexe 2 ci-après).
Ces derniers renfermeraient-ils des « secrets protégés par la Loi » ?
François PESTY
Annexe 1 - Extraits du règlement intérieur de la CT (dernière actualisation du 6 avril 2016, accessible ici) :
« Pour chacun des dossiers prévus à l’ordre du jour, les membres de la Commission sont invités à faire connaître les intérêts qu’ils n’auraient pas préalablement déclarés. Au regard de l’ensemble des liens d’intérêt déclarés dans la déclaration publique d’intérêts (DPI) ou en séance, il peut être demandé à un ou plusieurs membres de quitter la salle avant l’examen du dossier concerné »
« Pour chaque séance de la Commission, un procès-verbal est établi. Ce procès-verbal est composé de l’ordre du jour et du compte-rendu. Ce dernier comporte :
- la date de la séance,
- la liste des présents et excusés,
- les spécialités et sujets examinés,
- les revendications des entreprises pharmaceutiques,
- les participations et non participations des membres de la Commission eu égard aux liens d'intérêt éventuels,
- la teneur des débats,
- les résultats des votes et, le cas échéant, les opinions minoritaires,
- le cas échéant, les identifications et explications de vote.
Le procès-verbal est diffusé aux membres de la Commission. Il est conservé et archivé par le Service évaluation des médicaments. Le procès-verbal est publié sur le site internet de la HAS ».
« Expertise par les membres de la Commission :
Au regard de leurs compétences, un ou plusieurs membre(s) de la Commission peuvent être désigné(s) rapporteur(s) d’un dossier. Le rapporteur présente aux autres membres sa connaissance de la maladie, de la stratégie et des alternatives thérapeutiques ainsi que son analyse des données disponibles et donne son avis sur la spécialité en cours d’évaluation sur la base du dossier soumis par l’entreprise »
« Déontologie : Les membres de la Commission et toute personne lui apportant son concours sont tenus de se conformer aux règles de déontologie en vigueur à la HAS.
S’ils présentent des liens d’intérêts susceptibles de compromettre leur indépendance et leur impartialité avec l’affaire examinée alors ils doivent s’abstenir de toute participation la concernant et ne peuvent être présents lors des débats et du vote ».
Annexe 2 - Décret du 9 mai 2012
La publication sur le site de la HAS des procès-verbaux des réunions de la commission de la transparence, prévue dans son règlement intérieur, a été rendue obligatoire par le décret du 9 mai 2012 relatif à la déclaration publique d’intérêts et à la transparence en matière de santé publique et de sécurité sanitaire (accessible ici).
« Les procès verbaux sont mis en ligne dans les meilleurs délais, dans le respect des secrets protégés par la Loi… »
22/12/2016 - « Alibabamumab et les trois cent-quarante rhumatologues »
Pourquoi aurez-vous bien du mal à trouver un rhumatologue pour vous prescrire le meilleur traitement de fond dans la polyarthrite rhumatoïde

Illustration empruntée à Sébastien PELON, Ali Baba et les 40 voleurs Éditions Lito - octobre 2011
Synthèse
Les conflits d’intérêts des rhumatologues et de certains médecins internistes avec les firmes qui commercialisent les biothérapies indiquées dans la polyarthrite rhumatoïde sont massifs et systématiques
La place occupée par chaque biothérapie dans les dépenses 2015 remboursées par l’assurance maladie ne dépend pas du bénéfice clinique apporté aux patients, mais est fortement corrélée aux montants et aux nombres d’avantages versés, ainsi qu’aux nombres de contrats signées par les firmes avec les rhumatologues
Ces conflits d’intérêts avérés ont de graves conséquences pour les patients qui n’ont que très rarement accès à la meilleure option thérapeutique, et qui à la place sont exposés inutilement à des événements indésirables graves liés aux effets immunosuppresseurs puissants de ces médicaments biologiques, et pour notre système de santé solidaire, lourdement et illégitimement sollicité sur le plan financier
Les leaders d’opinion en rhumatologie sont dans le déni des preuves cliniques les plus évidentes, sinon dans le mensonge. Leurs recommandations sont biaisées. Au mieux, ils ont créés de toutes pièces une doctrine opportuniste. Au pire, ils se sont livrés à une fraude scientifique organisée qui s’est substituée à ce qu’auraient dû être leurs recommandations
Les rhumatologues de terrains ne sont pas formés comme ils le devraient à la meilleure prise en charge médicamenteuse de la polyarthrite rhumatoïde. Et c’est à une dérive collective des prescriptions de l’ensemble des rhumatologues à laquelle nous avons assistée en France, contrairement à d’autres pays en Europe et en Amérique du Nord
Les autorités de santé françaises, ANSM, HAS, l’EMA en Europe, dans une grande errance, ont été ou sont encore complices des firmes et de leurs leaders d’opinion dans cette confiscation qui est faite aux patients de ce qui aurait dû logiquement constituer le meilleur traitement au meilleur prix dans la polyarthrite rhumatoïde
Cet article fait partie d’une trilogie dont les deux autres volets sont :
- « Après la méta-analyse canadienne en réseau, la messe est dite dans la polyarthrite rhumatoïde : La trithérapie conventionnelle est supérieure aux biothérapies ! » (ici, si vous ne l'avez pas encore lu, peut être devriez-vous commencer par là),
- « La caverne d’Ali baba ou l’indescriptible chaos qui a présidé à la naissance de la bien mal nommée « Transparence.santé » » (ici prochainement)
Cliquer sur les liens hypertextes pour vous déplacer aisément dans cet article et revenir au plan
Plan de l’article :
- Réussir le lancement d’alibabamumab, nouvelle biothérapie dans la polyarthrite rhumatoïde
- Les liens d’intérêts massifs et constants des rhumatologues en France
- L’exemple du département des Yvelines
- Tableau des liens d’intérêts de divers groupes de rhumatologues
- La place de chaque biothérapie est fortement corrélée aux avantages perçus et conventions signées
- Tableau des corrélations observées
- Focus sur les auteurs et co-investigateurs de l’étude JAMA septembre 2016
- Focus sur les 5 derniers congrès nationaux annuels de la Société Française de Rhumatologie (SFR)
- Une démonstration de l’impact défavorable des liens d’intérêts qui n’est plus à faire
- Les lourdes conséquences de ces liens massifs et constants pour les patients et notre système solidaire
- Comment nos experts français ont-ils biaisé les recommandations dans la polyarthrite rhumatoïde ?
- Les recommandations HAS 2007 suspendues en 2011
- Les biosimilaires sont également « boudés » par nos rhumatologues
- Les vidéos de nos pseudo-experts en occultation
- Des associations de patients largement financées par les firmes
- Des autorités sanitaires en France, au mieux complaisantes, au pire complices
- L’immobilisme total de l’ANSM, qui subit le dictat de l’EMA, et reste campée sur des positions anachroniques
- La HAS n’aurait pas dû « labelliser » en 2013 les « conseils d’utilisation des anti-TNF »
- Qu’a fait la Commission de la transparence HAS de ses belles trouvailles de 2014 ?
- En septembre 2016, la Commission de la transparence HAS loupe encore le coche
- Les « travaux secrets » de la Commission d’évaluation économique et de santé publique
- Pour finir, une Présidente de la HAS qui pourrait bien se tromper d’expertise
Préambule : Réussir le lancement d’Alibabamumab
Retour
Imaginez que vous dirigiez la « start-up » qui a découvert et breveté l’Alibabamumab. Cette biothérapie promise à un avenir lucratif dans la polyarthrite rhumatoïde n’est au demeurant que l’antépénultième anti-TNF-alpha, « me-too » (« moi aussi je veux ma part de marché », comme dit, Bruno TOUSSAINT, Rédacteur en Chef de la revue indépendante Prescrire), copie conforme aux :
- REMICADE® (infliximab, MSD, anciennement Schering Plough), mais aussi ces déjà 2 biosimilaires REMSIMA® de Biogaran filiiale génériques de Servier et INFLECTRA® d’Hospira, rachetée par Pfizer,
- ENBREL® (étanercept, Pfizer et avant Wyeth), et son biosimilaire BENEPALI® chez Biogen Idec France,
- HUMIRA® (adalimumab, attention à ne pas confondre avec l’alibabamumab ! Abbvie, antérieurement Laboratoires Abbott),
et
- autres CIMZIA® (certolizumab, UCB Pharma) ou SIMPONI® (golimumab, MSD),
Un anti-TNF-alpha désormais en compétition avec d’autres biothérapies « non anti-TNF-alpha » :
- MABTHERA® (rituximab, Roche),
- ROACTEMRA® (tocilizumab, Roche et Chugaï Pharma en « co-promotion »)
- ORANCIA® (abatacept, BMS).
Ces 8 molécules, prescrites à tour de bras par les rhumatologues, représentaient toutes indications confondues plus de 1,5 milliards d’euros de dépenses en 2015 pour l’assurance maladie, et en dépense cumulée depuis 2005, 9,8 milliards d’euros, soit près de dix fois plus que l’ensemble des traitements de fond conventionnels (source : données MEDIC’AM et ATIH).
Il faut aussi prendre en compte les molécules en fin de développement, très prochainement commercialisées, actuellement déjà prescrites sous ATU, avec d’ailleurs un prix librement fixé par les firmes, donc astronomique et secrètement gardé : le baricitinib, inhibiteur des JAK1 et JAK2, de la firme américaine Eli Lilly ; le sarilumab, anticorps monoclonal dirigé contre les rcepteurs de l’interleukine 6 (IL6) de notre fleuron national Sanofi-Aventis allié à Regeneron, une Biotech américaine.
Que feriez-vous pour réussir le lancement de ce nouveau médicament ?
Cher(e) ami(e), la première des choses serait d’analyser les raisons du succès de ces biothérapies auprès des rhumatologues et de leurs patients. Quels sont donc les « partenariats » qui ont été mis en place par les firmes pharmaceutiques avec les rhumatologues, notamment les KOL (Key Opinion Leaders, ou leaders d’opinion clés), en particulier hospitalo-universitaires, et avec les associations de patients polyarthritiques ?
Retour
Une pléthore de liens d’intérêts des rhumatologues, experts ou non, avec les firmes pharmaceutiques qui pourrait nuire à la santé de leurs patients
Nous avons réalisé des analyses structurées et standardisées des liens d’intérêts sur différents groupes de rhumatologues français
Méthodologie utilisée : Les données se rapportant à la période de 4 années allant du 1er semestre 2012 au 2ème semestre 2015, ont été recherchées et extraites méthodiquement du site Transparence.sante.gouv.fr à l’aide du moteur de recherche par bénéficiaire (ici). Afin d’industrialiser l’extraction et l’analyse très chronophage des données, un outil a été développé sous Excel 2007, équipé de macro commandes écrites en VBA (Visual Basic for Application, le langage informatique de Microsoft®). Cet outil est mis à la disposition des internautes en accès libre (ici), ainsi que le didacticiel pour l’utiliser (ici).
L’analyse a porté sur :
- Les 10 auteur(e)s des recommandations SFR 2014 pour la prise en charge de la polyarthrite rhumatoïde,
- Les 31 membres du groupe de lecture des recommandations SFR 2014 pour la prise en charge de la polyarthrite rhumatoïde,
- Les 33 experts des recommandations HAS 2007, suspendue en septembre 2011 pour mauvaise gestion des liens d’intérêts,
- Les 12 membres du bureau de la SFR,
- Les 41 rhumatologues du conseil d’administration de la SFR,
- Les 9 rhumatologues du Conseil Scientifique de la SFR,
- Les 4 membres de la Commission permanente des recommandations SFR,
- Les 2 membres de la commission évaluation et démarche qualité de la SFR,
- Les 5 membres du comité d’éthique de la SFR,
- Les 42 chefs de services « Rhumatologie » des CHU/CHR de France métropolitaine,
- Les 12 rhumatologues intervenant au 16ème salon de la polyarthrite organisé à Paris les 7 et 8 octobre 2016 par l’association de patients AFP-ric, Sous le Haut Patronage de Monsieur François HOLLANDE, Président de la République, avec les parrainages du Ministère de la Santé, de la Mairie de Paris, de la Société Française de Rhumatologie, le soutien institutionnel de la Haute Autorité de Santé, des laboratoires Bristol-Myers Squibb, Hospira / Pfizer, Lilly, UCB, et le soutien fondateur des laboratoires Abbvie,
- L’ensemble des rhumatologues présents sur les annuaires des CHU pour un échantillon de services de rhumatologie :
- Pr. René-Marc FLIPO, CHRU Lille,
- Pr. André KAHAN, Hôpital Cochin AP-HP (rhumatologie A),
- Pr. Maxime DOUGADOS, Hôpital Cochin AP-HP (rhumatologie B),
- Pr. Jean-Francis MAILLEFERT, CHU Dijon,
- Pr. Robert JUVIN, CHU Grenoble,
- Pr. Isabelle CHARY-VALCKENAERE, CHU Nancy
- Les 4 rhumatologues auteurs de la newsletter N°2 « Les traitements (de fond de la PR) » accessible sur le site de l’association de patients AFP ric,
- Les 4 rhumatologues auteurs d’une méta-analyse portant sur la mortalité toutes causes publiée dans l’American Journal of Medicine en décembre 2015,
- Les 38 rhumatologues et les 2 médecins internistes auteurs de l’étude « ROC » du JAMA publiée en septembre 2016,
- Les 96 rhumatologues « co-investigateurs » dans l’essai « ROC » précité dont la liste a été publiée avec le protocole de l’étude en annexe de la publication des résultats par le JAMA en septembre 2016,
- Les 59 rhumatologues du département des Yvelines (78),
- Le président, les deux vice-présidents, le comité d’organisation, le comité scientifique et le comité de formation médicale continue et pédagogique du 29ème congrès français de rhumatologie organisé à Paris les 11, 12 et 13 décembre 2016,
- Les 3 rhumatologues leaders d’opinion intervenus lors du seul atelier consacré à la « trithérapie conventionnelle » lors des congrès SFR en 2012, 2013, 2014, 2015 et 2016,
- La compilation des 340 médecins rhumatologues et internistes appartenant à ces différents groupes
Retour
Classement des 20 premiers rhumatologues en montants totaux « d’avantages perçus »
Cliquer sur l’image ci-dessous pour télécharger le fichier Excel des 340 rhumatologues et internistes
Retour
Classement des 20 premiers rhumatologues en nombres « d’avantages perçus »
Cliquer sur l’image ci-dessous pour télécharger le fichier Excel des 340 rhumatologues et internistes
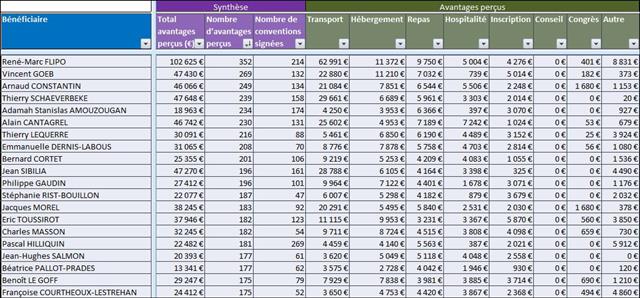
Retour
Classement des 20 premiers rhumatologues en nombre de « conventions signées »
Cliquer sur l’image ci-dessous pour télécharger le fichier Excel des 340 rhumatologues et internistes
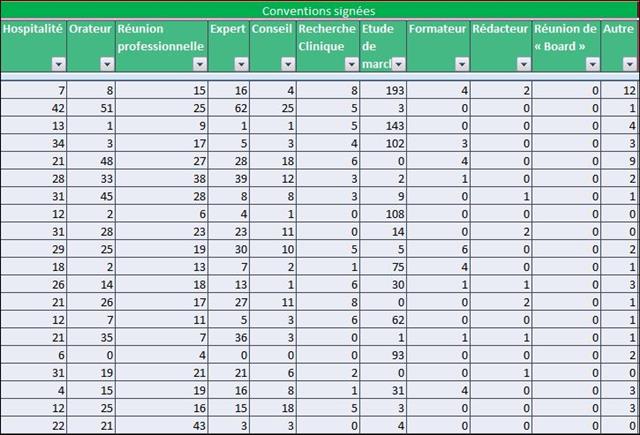
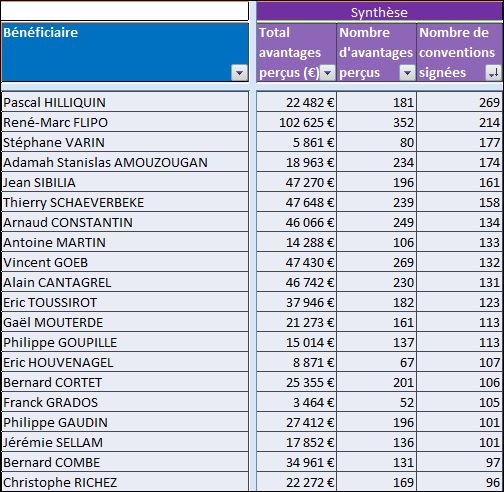
Retour
Classement des 20 premiers rhumatologues en nombre de conventions de « Recherche Clinique »
Cliquer sur l’image ci-dessous pour télécharger le fichier Excel des 340 rhumatologues et internistes
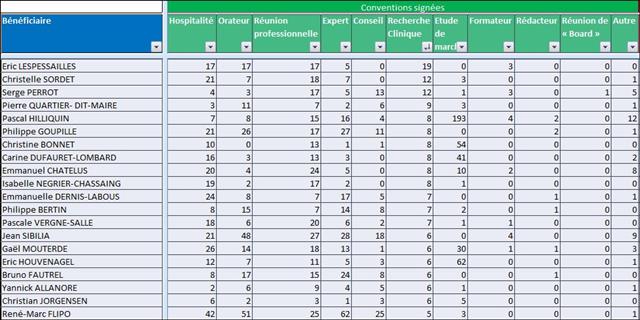
Retour
Classement des 20 premiers rhumatologues en nombre de conventions d’ « Etude de marché »
Cliquer sur l’image ci-dessous pour télécharger le fichier Excel des 340 rhumatologues et internistes
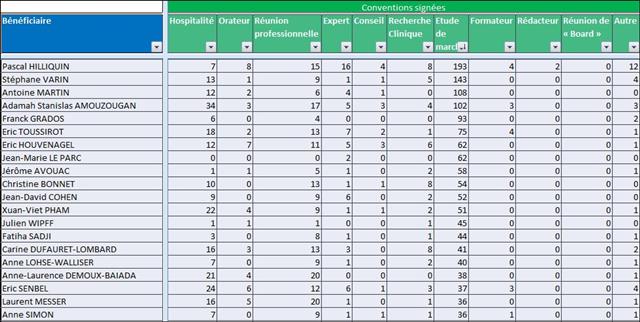
Retour
Classement des 20 premiers rhumatologues en nombre de conventions d’ « Orateur »
Cliquer sur l’image ci-dessous pour télécharger le fichier Excel des 340 rhumatologues et internistes
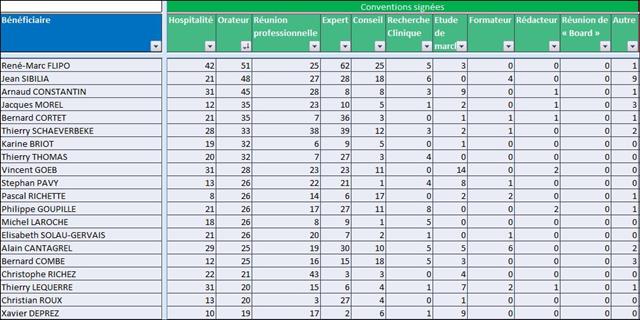
Retour
Faites vous-même votre classement :
Vérifier que vous êtes bien sur l’onglet « Données » :
Sinon, le sélectionner :
Puis cliquer sur l’icône « Trier » :
Sélectionner alors la colonne de votre choix pour classer différemment les rhumatologues :
Voici le résultat pour « Expert » :
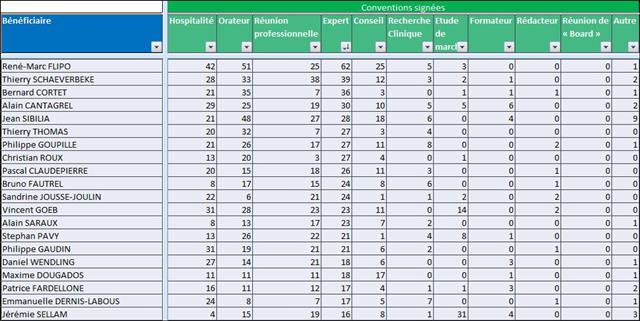
C’est à vous de jouer…
René-Marc FLIPO, PU-PH au CHU de Lille, domine ce classement. Premier en montants et nombres d’avantages perçus (plus de 25.000 € par an !), second en nombre de conventions signées. Il est aussi le numéro 1 en montants de titres de transport, d’hébergement, de repas, et en tant qu’orateur ou qu’expert… L’un expliquant l’autre probablement. Nous vérifierons que ces indicateurs sont corrélés entre eux.
Retour
Focus sur les résultats de notre analyse portant sur un département entier, celui des Yvelines :
L’analyse a consisté en l’identification préalable des rhumatologues en exercice sur le département à partir des annuaires des médecins du CNOM (Conseil National de l’Ordre des Médecins : ici) de l’Assurance maladie (ici), des sites Internet des principaux établissements hospitalier MCO du département (CH Versailles - Le Chesnay, CHI Poissy-Saint-Germain, CH Mantes-la-Jolie, CH Rambouillet).
Résultats : Seuls 4 rhumatologues répertoriés dans le département n’ont aucun liens d’intérêts déclarés dans la base de données ministérielle : Il s’agit d’une femme médecin salariée d’un laboratoire pharmaceutique (Léo pharma), d’un médecin responsable d’une unité de soins de longue durée (USLD) à l’hôpital du Vésinet, d’une femme médecin coordonnateur dans un établissement de soins de suite et de réadaptation dépendant de l’UGECAM, situé à Rambouillet (CERRSY), enfin, d’une femme médecin répertoriée comme remplaçante et non installée. Il est très peu probable que ces 4 médecins soient des prescripteurs réguliers, initiateurs de biothérapies dans la polyarthrite rhumatoïde. Mais, tel n’est pas le cas des 55 autres rhumatologues que nous avons identifiés dans les Yvelines et dont l’analyse structurée des multiples liens d’intérêts déclarés sur le site Transparence est présentée dans le tableau ci-dessous :
Cliquer ici pour ouvrir le tableau complet des 55 rhumatologues des Yvelines liés aux firmes 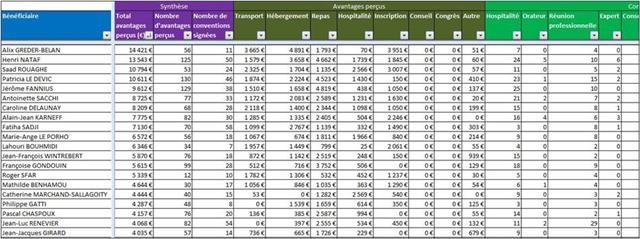
Au total, 2.135 avantages perçus des firmes pharmaceutiques pour un montant total proche de 200.000 euros (Repas : 67.035 €, inscriptions : 36.329 €, hébergement : 34.624 €, transport : 26.495 €, hospitalité : 24.205 €). Et ce n’est que la partie immergée de l’iceberg, puisque les montants des 800 conventions signées avec les firmes ne sont toujours rendus publics. En effet, malgré une décision du Conseil d’Etat qui sommait en février 2015 la ministre de les divulguer, en dépit des dispositions de l’article 178 de la Loi de modernisation de notre système de santé promulguée le 26 janvier 2016 (ici), qui les prévoyaient et que le Conseil Constitutionnel avait approuvé (ici), nous sommes toujours dans l’attente du décret d’application qui les rendra obligatoires. Les sages du Conseil Constitutionnel avaient considéré qu’elles étaient « justifiée par l’exigence constitutionnelle de protection de la santé et par l’objectif d’intérêt général de prévention des conflits d’intérêts ».
Retour
Tableau des liens d’intérêts de différents groupes de rhumatologues français
Cliquer sur les liens pour télécharger les fichiers d’analyses structurées
(*) 38 rhumatologues et 2 médecins internistes
Arrêtons-nous quelques instants sur les différences entre ces groupes de rhumatologues. Nous voyons bien qu’une évidente hiérarchisation s’est instaurée en fonction de l’importance stratégique pour les firmes des différents groupes de rhumatologues :
Tout en haut de l’échelle, les trois intervenants à l’atelier « Controverse : Y-a-t-il une place pour la trithérapie dans la polyarthrite rhumatoïde en 2014 ? ». Ils ne sont manifestement pas là par hasard (cf. infra). Si l’on s’en tient aux instances officielles de la Société Française de Rhumatologie, le bureau de la SFR, instance dirigeante de la plus haute importance, est sans surprise la plus concentrée en « experts » lourdement liés aux industriels des biothérapies antirhumatismales. Pas très éloigné, tout ce qui touche aux recommandations pour la pratique clinique, à l’organisation du congrès annuel, mais aussi le Conseil d’administration, le Conseil scientifique, les chefs de services des CHU et de CHR, les auteurs d’essais cliniques dont les résultats sont publiés dans des grandes revues médicales. Tous ont perçus sur 4 ans plus de 100 avantages en moyenne pour un montant qui tourne autour des 20.000 euros, et ont signé plus de 60 contrats. Les experts qui sont intervenus pour les recommandations HAS suspendues en 2011 (déjà pour mauvaise gestion des conflits d’intérêts, faut-il le rappeler), sont un peu en retrait. Mais, cinq à dix ans se sont écoulés et certains sont partis à la retraite, d’autres ont peut être laissé leur chefferie de service…
Retour
La place occupée par chaque biothérapie dans les dépenses 2015 remboursées par l’assurance maladie ne dépend pas du bénéfice clinique apporté aux patients, mais est fortement corrélée aux montants et aux nombres d’avantages versés, ainsi qu’aux nombres de contrats signées par les firmes avec les rhumatologues
Quelques précisions méthodologiques :
Nous avons d’abord identifié quels étaient les médicaments faisant l’objet d’une promotion active de la part des firmes dans le traitement de fond de la PR. A savoir, ceux bénéficiant du soutien d’un réseau de visiteurs médicaux en ville et à l’hôpital et à l’origine d’avantages versés aux rhumatologues et de « contrats » objectivés par des conventions déclarés dans Transparence santé. Un seul DMARDs conventionnel rempli ces pré-requis, le méthotrexate, mais uniquement sous sa forme injectable, très largement promu par NORDIC PHARMA. Parmi les biothérapies, l’anakinra, KINERET®, un inhibiteur de l’interleukine, relativement peu prescrit, est commercialisé par la firme SWEDISH ORPHAN BIOVITRUM. Suivent nos 5 anti-TNF-alpha et 3 biothérapies « non anti-TNF-alpha », avec 9 firmes en présence qui sont : MSD, avec 2 anti-TNF-alpha, l’infliximab, REMICADE®, réservé à l’usage hospitalier et le golimumab, SIMPONI® ; BIOGARAN et HOSPIRA qui commercialisent chacun un biosimilaire d’infliximab, respectivement REMSIMA® et INFLECTRA® ; PFIZER avec l’étanercept, ENBREL® ; ABBVIE avec l’adalimumab, HUMIRA® ; UCB PHARMA avec le certolizumab, CIMZIA® ; BMS avec l’abatacept, ORENCIA®. Enfin, ROCHE avec le rituximab, MABTHERA® et le tocilizumab, ROACTEMRA®. Mais, il faut savoir que CHUGAÏ PHARMA et ROCHE ont un accord de co-promotion du ROACTEMRA® chez les rhumatologues. Voir ci-dessous les copies d’écran sur le site du japonais et sur le réseau social professionnel Viadeo :

A noter également l’acquisition récente (3 septembre 2015) par Pfizer des laboratoires Hospira. L’analyse des liens d’intérêts ayant été conduite sur la période 2012-2015, nous avons bien évidemment traités Pfizer et Hospira comme deux entités différentes (Source : Communiqué Pfizer accessible gratuitement : ici)
Nous avons donc recherché quels ont été les montants de dépenses en 2015 pour ces différents médicaments en ville (fichier MEDIC’AM 2015 de l’assurance maladie (ici)) et à l’hôpital (fichiers de l’ATIH pour les hôpitaux publics (ici) et privés (là))
Puis nous avons agrégé ces dépenses 2015 sur les entités suivantes, par ordre décroissant de montants arrondis : ABBVIE (450 M€), MSD (410 M€), ROCHE + CHUGAÏ (321 M€), PFIZER (269 M€), BMS (49 M€), NORDIC PHARMA (43 M€), UCB PHARMA (33 M€) SWEDISH ORPHAM BIOVITRUM (8 M€), HOSPIRA (6 M€), BIOGARAN (2 M€).
Nous nous sommes intéressés de savoir si les montants de dépenses 2015 étaient corrélés aux efforts consentis par les firmes en montants d’avantages, nombres d’avantages, et nombres de conventions signées avec les rhumatologues, pour plusieurs des groupes que nous avions identifiés.
Voici nos résultats édifiants
La très forte corrélation observée pour les traitements de fonds promus par les firmes entre les nombres de conventions signées avec les 340 rhumatologues et les dépenses 2015
Cliquer sur l’image ci-dessous pour ouvrir la présentation diapositives des corrélations
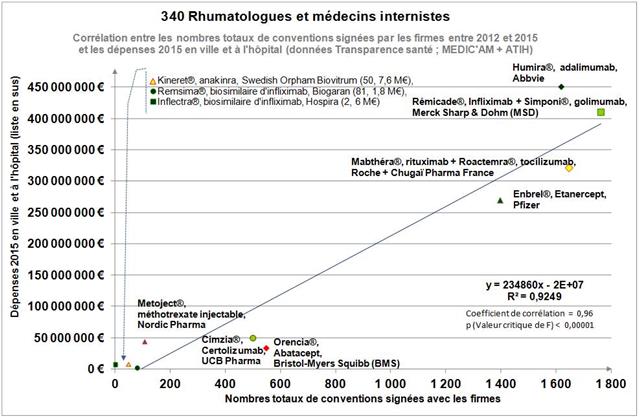
La forte corrélation observée entre les nombres d’avantages versés aux 340 rhumatologues et les dépenses 2015
Cliquer sur l’image ci-dessous pour ouvrir la présentation diapositives des corrélations
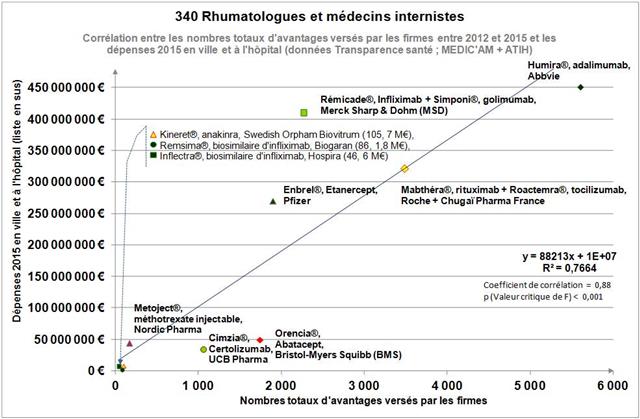
La forte corrélation observée entre les montants d’avantages versés aux 340 rhumatologues et les dépenses 2015
Cliquer sur l’image ci-dessous pour ouvrir la présentation diapositives des corrélations
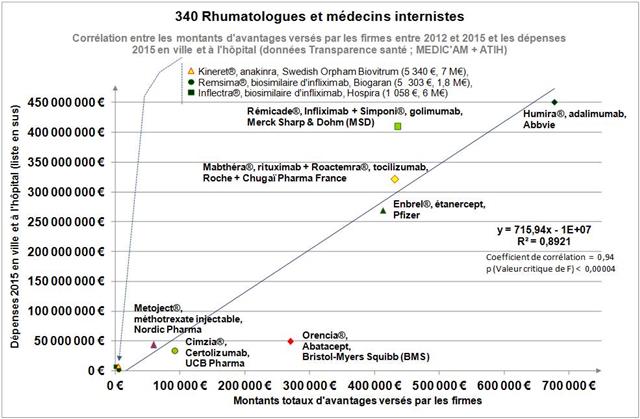
Nous avons également retrouvé des corrélations extrêmement fortes entre d’une part les nombres et les montants totaux d’avantages perçus, et d’autre part entre ces mêmes nombres d’avantages et les nombres de conventions signées. Mais, nous nous en doutions un peu…
Cliquer sur l’image ci-dessous pour ouvrir la présentation diapositives des corrélations
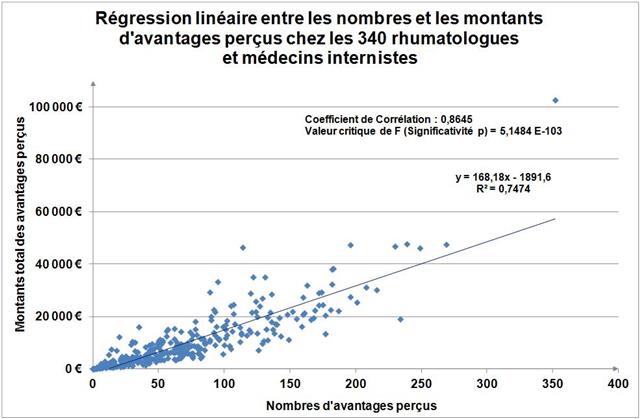
Cliquer sur l’image ci-dessous pour ouvrir la présentation diapositives des corrélations
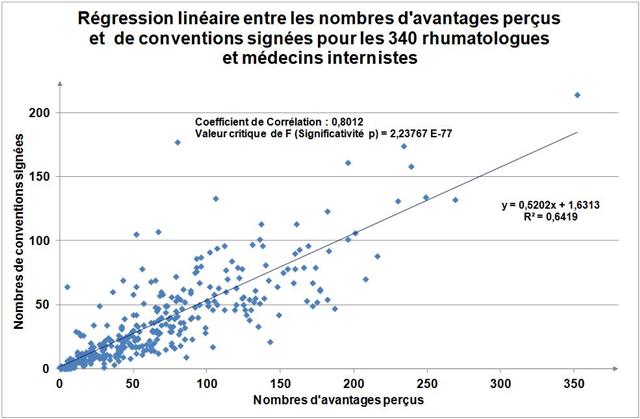
Nous retrouvons aussi une corrélation significative entre les nombres de lits des CHU / CHR et les montants et nombres d’avantages perçus, ainsi que les nombres de conventions signées avec les firmes par les 42 chefs de services en rhumatologie des CHU / CHR.
Cliquer sur l’image ci-dessous pour ouvrir la présentation diapositives des corrélations
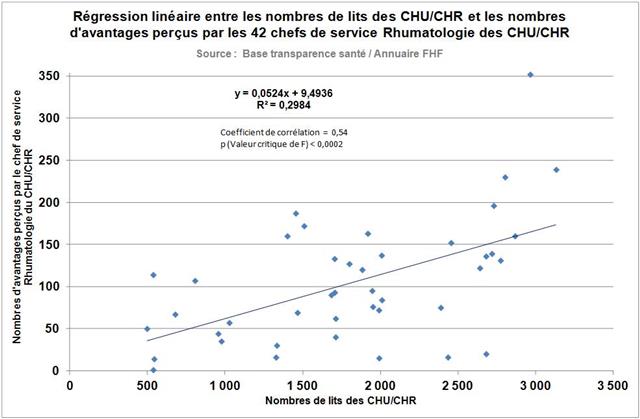
Retour
Tableau récapitulatif des corrélations observées
Cliquer sur les liens pour ouvrir les fichiers. Les graphiques et le calcul des paramètres de corrélation sont situés dans les feuilles à droite de « Tableaux de synthèse »
Groupes de rhumatologues | Nbre | Variable explicative | Coefficient de a
corrélation | Coefficient de b détermination | significativité c | Poids (%) d |
340 rhumatologues et internistes | 340 | Montants d’avantages | 0,94 | 0,89 | p<0,00004 | 71% |
Nbres d’avantages | 0,88 | 0,77 | p<0,001 | 69% |
Nbres de conventions | 0,96 | 0,92 | p<0,00001 | 59% |
55 rhumatologues départements Yvelines | 55 | Montants d’avantages | 0,83 | 0,69 | p<0,003 | 52% |
Nbres d’avantages | 0,81 | 0,65 | p<0,005 | 49% |
Nbres de conventions | 0,95 | 0,90 | p<0,00004 | 52% |
42 rhumatologues chefs de service CHU | 42 | Montants d’avantages | 0,80 | 0,64 | p<0,005 | 71% |
Nbres d’avantages | 0,89 | 0,78 | p<0,001 | 75% |
Nbres de conventions | 0,87 | 0,75 | p<0,002 | 75% |
41 rhumatologues CA SFR | 41 | Montants d’avantages | 0,85 | 0,73 | p<0,002 | 69% |
Nbres d’avantages | 0,88 | 0,78 | p<0,001 | 71% |
Nbres de conventions | 0,88 | 0,78 | p<0,001 | 71% |
12 rhumatologues bureau du CA SFR | 12 | Montants d’avantages | 0,80 | 0,64 | p<0,005 | 73% |
Nbres d’avantages | 0,88 | 0,78 | p<0,001 | 75% |
Nbres de conventions | 0,88 | 0,78 | p<0,001 | 75% |
3 rhumatologues « controverse trithérapie » | 3 | Montants d’avantages | 0,80 | 0,63 | p<0,01 | 82% |
Nbres d’avantages | 0,84 | 0,70 | p=0,002 | 81% |
Nbres de conventions | 0,70 | 0,49 | p<0,03 | 79% |
a : Coefficient de corrélation ; b : Coefficient de détermination ; c : Significativité ; d : Poids (%) des 9 firmes commercialisant les 8 biothérapies et les 2 biosimilaires indiqués dans la polyarthrite rhumatoïde, dans le total des montants d’avantages et nombres d’avantages versés et des nombres de conventions signés par toutes les firmes avec lesquelles les rhumatologues ont des liens d’intérêts
Il s'agit des corrélations par régression linéaire entre d'une part les montants, les nombres d’avantages versés aux rhumatologues, et les nombres de conventions signées avec eux par les firmes qui commercialisent des biothérapies ou biosimilaires ou du méthotrexate injectable (seul DMARD conventionnel promu) et d'autre part la place occupée par ces médicaments en terme de montants de dépenses 2015 en ville et à l’hôpital
Retour
Focus sur les auteurs et co-investigateurs d’une étude clinique dont les résultats ont été récemment publiés dans le JAMA (20 septembre 2016)

Cet essai clinique randomisé multicentrique français, bien que terminé depuis 2013, n’est sorti comme par enchantement qu’après la commercialisation des premiers biosimilaires d’anti-TNF-alpha (publication complète en accès libre sur le site de la SFR : ici). En effet, ces biosimilaires représentaient potentiellement une menace pour les anti-TNF-alpha encore protégés par des brevets, et il devenait donc nécessaire de trouver d’autres « poules aux œufs d’or ». D’ailleurs, nos rhumatologues rechignent aussi à prescrire ces biosimilaires. En atteste le taux ridiculement bas de leur prescription en 2015, 3,6% des boites et 2,5% des montants d’infliximab :
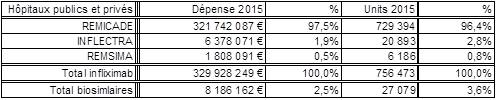
Sans avoir prévu de groupe de contrôle traité par trithérapie conventionnelle, des patients en échec d’un premier anti-TNF-alpha ont été tirés au sort pour recevoir à partir de l’année 2009 soit un autre anti-TNF-alpha (sauf golimumab), soit l’une des 3 biothérapies « non anti-TNF-alpha » commercialisées en France, rituximab (MABTHERA®), tocilizumab (ROACTEMRA®) ou abatacept (ORENCIA®).
Nous avons d’abord conduit l’analyse structurée des liens d’intérêts déclarés pour les « auteurs » de l’article du JAMA (tels qu’ils apparaissent sous le titre en première page, voir un peu plus haut), puis poursuivi nos recherches sur les « co-investigateurs » de cette étude dénommée « ROC », tels qu’ils figuraient sur une liste établie probablement en 2009 avec le protocole de l’essai, juste avant l’inclusion des premiers patients. A ce propos, seuls 3 rhumatologues co-investigateurs n’ont aucun lien d’intérêts déclarés dans la base transparence santé (période 2012-2015). Il s’agit de deux rhumatologues ayant opté pour une autre spécialité, « Santé publique et médecine sociale » pour l’une, médecine du travail pour l’autre, et d’une troisième rhumatologue non référencée dans la base transparence santé et absente de l’annuaire du CNOM. Quatre rhumatologues co-investigateurs en 2009, Jean-Michel RISTORI, Florence CHOPIN, Anca GAULARD-CORONDAN et Marie COURET, possèdent peu de liens d’intérêts. Les deux premiers n’ont perçu aucun avantage et n’ont chacun signé qu’une seule convention, respectivement en mars et en novembre 2012. Le Pr RISTORI ne fait plus partie de l’équipe du service de rhumatologie du CHU de Clermont-Ferrand et n’est plus dans l’annuaire du CNOM. Toujours en exercice et inscrite dans la discipline rhumatologie sur l’annuaire du CNOM, Florence CHOPIN n’exerce plus comme cela était le cas en 2009 dans le service de rhumatologie de l’hôpital Nord du CHU de Saint-Etienne, mais dans un centre de soins de suite et de réadaptation (et ne doit probablement plus prescrire en routine de traitement de fond de la PR). La troisième est remplaçante et non installée dans le département du Bas-Rhin selon l’annuaire du CNOM, la quatrième qui n’a plus de lien d’intérêt depuis juin 2013, est également absente de l’annuaire du CNOM.
Ainsi, comme pour les rhumatologues du département des Yvelines, celles et ceux de la liste des co-investigateurs de l’essai clinique « ROC » en 2009, qui n’ont pas ou très peu de liens d’intérêts déclarés dans la base transparence santé, ne sont plus en activité ou ne consultent plus…
Retour
Focus sur les 5 derniers congrès nationaux annuels de la SFR
Le tableau ci-dessous dénombre les occurrences des dénominations internationales communes (DCI) des médicaments et des stratégies thérapeutiques du traitement de fond de la polyarthrite rhumatoïde (et autres pathologies rhumatologiques pour les biothérapies) dans les programmes détaillés (et expurgés de leur contenus publicitaires) des congrès français de rhumatologie organisés par la SFR de 2012 à 2016 inclus.
Faire un clic droit sur les liens ci-dessous pour ouvrir dans une autre fenêtre les programmes détaillés des 5 derniers congrès SFR
Médicaments et stratégies thérapeutiques | Congrès national de la Société Française de Rhumatologie | |
Edition 2012 | Edition 2013 | Edition 2014 | Edition 2015 | Edition 2016 | Total
5 éditions |
trithérapie | 0 | 0 | 5 | 0 | 0 | 5 |
conventionnel (DMARDs) | 2 | 2 | 1 | 0 | 1 | 6 |
méthotrexate | 13 | 17 | 15 | 22 | 17* | 84 |
méthotrexate injectable ou inj | 0 | 0 | 0 | 0 | 0 | 0 |
sulfasalazine | 0 | 0 | 0 | 0 | 0 | 0 |
hydroxychloroquine | 0 | 0 | 0 | 0 | 1** | 1 |
léflunomide | 1 | 1 | 1 | 1 | 0 | 4 |
biothérapie | 51 | 45 | 45 | 55 | 46 | 242 |
biosimilaire | 0 | 0 | 6 | 10 | 6 | 22 |
anti-TNFα (ou anti-TNF) | 41 | 31 | 50 | 78 | 32 | 232 |
étanercept | 6 | 8 | 5 | 4 | 3 | 26 |
Benepali (biosimilaire d’étanercept) | 0 | 0 | 0 | 0 | 0 | 0 |
Infliximab | 9 | 5 | 6 | 4 | 8*** | 32 |
Remsima (biosimilaire d’infliximab) | 0 | 0 | 0 | 0 | 0 | 0 |
Inflectra (biosimilaire d’infliximab) | 0 | 0 | 0 | 0 | 1 | 1 |
adalimumab | 7 | 6 | 0 | 2 | 6 | 21 |
certolizumab | 10 | 16 | 9 | 16 | 8 | 59 |
golimumab | 2 | 2 | 3 | 5 | 3 | 15 |
rituximab | 23 | 14 | 19 | 8 | 9 | 73 |
tocilizumab | 16 | 16 | 13 | 27 | 10 | 82 |
abatacept | 9 | 8 | 13 | 31 | 13 | 74 |
tofacitinib 1 | 0 | 0 | 0 | 0 | 1 | 1 |
baricitinib 2 | 0 | 1 | 0 | 6 | 4**** | 11 |
sécukinumab 3 | 0 | 0 | 0 | 3 | 3 | 6 |
ustékinumab 4 | 1 | 7 | 0 | 0 | 1 | 9 |
anakinra 5 | 3 | 0 | 3 | 0 | 0 | 6 |
sarilumab 6 | 0 | 0 | 0 | 0 | 0 | 0 |
Total DMARDs biologiques | 178 | 159 | 172 | 249 | 143 | 901 |
Total DMARDs conventionnels | 16 | 20 | 22 | 23 | 18*, ** | 99 |
Notes concernant le programme du congrès français de rhumatologie du 11 au 13 décembre 2016 :
(1) Inhibiteur des « janus kinases » JAK1 et JAK, commercialisé aux USA sous le nom de XELJANZ® par Pfizer, qui n’a pas été autorisé en France et en Europe, à cause d’un rapport bénéfice risque défavorable
(2) Inhibiteur des JAK1 et JAK2, développé par Lilly
(3) Inhibiteur de l’interleukine 17A, commercialisé par NOVARTIS sous le nom de COSENTYX®, indiqué dans le psoriasis, le rhumatisme psoriasique, la spondylarthrite ankylosante, mais pas encore dans la polyarthrite rhumatoïde
(4) Inhibiteur des interleukines 12 et 23, commercialisé sous le nom de STELARA®, par JANSSEN CILAG, indiqué dans le psoriasis, le rhumatisme psoriasique, la maladie de Crohn
(5) Inhibiteur de l’interleukine peu prescrit dans la polyarthrite rhumatoïde, commercialisé sous le nom de KINERET® par Swedish Orpham Biovitrum
(6) Anticorps monoclonal dirigé contre les récepteur de l’interleukine 6 (IL-6) développé en partenariat par la biotech américaine Regeneron et Sanofi, qui pourrait recevoir une AMM européenne début 2017
(*) Dont 4 occurrences pour un symposium de NORDIC PHARMA (qui promeut le coûteux méthotrexate injectable), 1 occurrence pour le méthotrexate en monothérapie, 1 fois comme critère d’inclusion dans un essai clinique de biothérapies (« réponse inadéquate au méthotrexate »), 5 fois associé à une (aux) biothérapie(s) dans un (des) essais cliniques. Un doublon dans un même titre de communication n’a pas été pris en compte « Baricitinib, méthotrexate, ou baricitinib associé au méthotrexate chez les patients ayant une polyarthrite rhumatoïde (PR) récente qui ont reçu peu ou pas de traitements de fond (DMARDs) : résultats de l'essai de phase 3 RA-BEGIN ». Parmi les 17 occurrences, aucune ne concerne l’association au méthotrexate d’un second DMARD conventionnel, à fortiori de deux (trithérapie) !
(**) « Efficacité cardio-vasculaire et métabolique de l’hydroxychloroquine dans la polyarthrite rhumatoïde : revue systématique et méta-analyse ». Il n’échappe à personne que les sujet ici n’est pas celui de l’efficacité de l’hydroxychloroquine seule ou associée à d’autres DAMARDs conventionnels dans la polyarthrite rhumatoïde…
(***) N’ont pas été comptabilisés deux doublons apparaissant dans les mêmes titres de communication : (« Intérêt du monitoring biologique de la concentration d'infliximab lors de la désescalade thérapeutique de l’infliximab dans la spondylarthrite axiale » et « Impact en pratique clinique courante du dosage de l’infliximab et des anticorps anti-infliximab dans la prise en charge des rhumatismes inflammatoires chroniques »)
(****) Un doublon dans un même titre de communication n’a pas été comptabilisé « Baricitinib, méthotrexate, ou baricitinib associé au méthotrexate chez les patients ayant une polyarthrite rhumatoïde (PR) récente qui ont reçu peu ou pas de traitements de fond (DMARDs) : résultats de l'essai de phase 3 RA-BEGIN »
Les 5 occurrences de « trithérapie » dans le programme du congrès 2014 :
Nous pourrions croire qu’en 2014 la trithérapie conventionnelle avait été largement discutée. En fait, il ne s’est s’agit que d’une seule et même séance de formation médical continue (FMC), au titre qui en dit long sur les objectifs pédagogiques réels des deux intervenants, Bernard COMBE et Xavier MARIETTE et du modérateur René-Marc FLIPO…


Quel dommage que nous n’ayons pas accès aux vidéos, réservées à l’usage exclusif des membres de la SFR, comme nous aurons l’occasion de le répéter un peu plus loin…
Les organisateurs du 29ème congrès de la SFR :
Retour
La démonstration n’est pourtant plus à faire de l’impact très défavorable de ce type de liens d’intérêts sur la qualité et la sécurité des soins, ainsi que sur leur coût
Une étude récente, dont la publication dans le JAMA Internal Medicine a été avancée en ligne le 20 juin 2016, réalisée chez près de 280.000 médecins américains ayant perçus plus de 63.000 avantages liés à 4 médicaments de marque ciblés dans l’étude et lourdement promus par l’industrie, montre qu’il suffit que les praticiens aient bénéficié d’un seul repas, même d’une valeur modique (moyenne inférieure à 20 $), pour que leur prescription des médicaments de marque soit augmentée. La prescription augmente davantage avec le nombre de repas offerts et lorsque la valeur du repas est plus importante. L’étude est téléchargeable en « full-text » : ici (accès vérifié le 07/09/2016) et a fait l’objet d’un correctif mineur (ici), sans conséquences sur les conclusions de l’étude.
Au total, pour les 340 médecins, essentiellement des rhumatologues, mais aussi quelques médecins internistes, plus de trois millions et trois cent milles euros auront été versés en avantages, soient près de 10.000 euros par médecin en moyenne sur 4 ans.
Retour
Ces conflits d’intérêts massifs et quasiment systématiques des rhumatologues ont de lourdes conséquences pour les patients et notre système de santé solidaire :
- Les nombreux patients atteint de polyarthrite rhumatoïde en échec de traitement par le méthotrexate en monothérapie (70% des patients) ne bénéficient pas de la meilleure option thérapeutique : une trithérapie conventionnelle par voie orale, donc gérable au domicile, et peu onéreuse, associant méthotrexate, sulfasalazine (SALAZOPYRINE®), et hydroxychloroquine (PLAQUENIL®) ;
- Au lieu de cette trithérapie dont la nette supériorité au méthotrexate seul est établie depuis 1996 (ici), et qui a été adoptée comme traitement de référence par exemple en Finlande ou par des médecins du Veterans Affairs aux USA, en France nos rhumatologue, poursuivant d’autres intérêts que celui de la santé de leurs patients, ont préféré les exposer inutilement à des biothérapies excessivement plus coûteuses et aux effets indésirables rares plus graves (ici),
- Certaines de ces biothérapies, réservées à l’usage hospitalier, nécessite à minima une hospitalisation de jour : C’est le cas obligatoirement pour l’infliximab (REMICADE® et ses biosimilaires) ainsi que pour le rituximab (MABTHERA®). Ce peut être aussi le cas pour les 2 autres biothérapies non anti-TNF-alpha, tocilizumab (ROACTEMRA®) et abatacept (ORENCIA®) pour lesquelles des formes galéniques stylos ou seringues pré-remplies pour injection sous-cutanée autorisent aussi depuis quelques années une prise en charge ambulatoire au domicile du patient.
Cela permet d’organiser une activité bénéficiaire pour l’hôpital, lui permettant de réduire ses déficits, mais financée par l’assurance maladie. Sans compter que celle-ci doit aussi prendre en charge les transports sanitaires pour un certain nombre de ces patients, alors qu’ils pourraient être traités à leur domicile et gérer eux-mêmes leurs traitements (stylos injectables, et surtout médicaments « per os » dans le cas d’une trithérapie conventionnelle)
Même Eric BASEIHLAC, Directeur des Affaires Économiques et Internationales au LEEM, invité à une table ronde CHAM 2016 sur « Quel prix un médicament vaut-il vraiment ? », s’offusque de ce que la France, contrairement à l’Allemagne, n’ait pas su prendre son virage ambulatoire dans la polyarthrite rhumatoïde à l’arrivée des anti-TNF-alpha. Selon l’étude menée pour les Entreprises du Médicament par le cabinet JALMA Consulting, alors que les allemands auraient réussi à traiter 90% des patients à leur domicile en 2007, en France 60% des polyarthritiques seraient encore traités à l’hôpital.
Cliquer sur l’image pour ouvrir l’extrait vidéo (40 secondes)

En 2016, la recette perçue par l’hôpital s’élève à 366,13 € pour une « chimiothérapie pour affection non tumorale, en séances » dans les établissements hospitaliers publics et à 216,99 € dans le privé.
La prescription de ces médicaments permet ainsi d’augmenter aisément les recettes de la T2A (tarification à l’activité) comme la montré le récent rapport 2016 de la Cour des Comptes qui pointe du doigt la prescription hospitalière tout particulièrement des médicaments « Chapitre VII - La maîtrise des prescriptions à l’hôpital : mieux responsabiliser le corps médical » (Téléchargeable : ici)

Tableau extrait du site « Aide au codage » : ici.
Retour
Comment nos experts français ont-ils biaisé les recommandations portant sur le traitement de fond de la polyarthrite rhumatoïde ?
L’élaboration de recommandations pour la pratique clinique portant sur le traitement médicamenteux (qui ?, quand traiter ? Avec quel(s) médicament(s) ?), par des experts perclus de liens d’intérêts fait courir un risque considérable de décalage des pratiques recommandées avec les données acquises de la science.
Les biais de celles réalisées en 2014 (ici) par la Société Française de Rhumatologie sont avérés (ici). La meilleure association médicamenteuse dans le traitement de fond de la polyarthrite rhumatoïde selon les essais cliniques randomisés en double aveugle publiés depuis 2012, d’après la longue expérience finlandaise (ici), et selon la méta-analyse canadienne en réseau dont les résultats ont été publiés dans le British Medical Journal le 20 avril 2016 (ici), n’est ni proposée en 1ère ni en 2ème intention dans la polyarthrite rhumatoïde après échec du méthotrexate en monothérapie pendant 12 semaines, alors qu’elle devrait l’être.
Pour l’écarter les experts de la SFR n’ont pas hésité à occulter la quasi-totalité des nombreuses études qui ont démontré depuis 20 ans l’intérêt de cette stratégie thérapeutique et ils ont pour mieux la discréditer, déformé les conclusions d’autres essais cités à l’appui de leur argumentaire en faveur des biothérapies beaucoup plus coûteuses, pas plus efficaces, et aux effets indésirables sévères probablement plus fréquents. Il est patent que les avantages importants qu’ils ont perçus des firmes et continuent de percevoir, que les moyens financiers au travers des conventions signées avec les entreprises du médicament, n’auraient pas, ne seraient pas les mêmes s’ils avaient recommandé la triple association de préférence à l’association méthotrexate + biothérapie.
Retour
Déjà les recommandations HAS 2007 avaient été « suspendues » pour cause de mauvaise gestion des conflits d’intérêts des experts
- La synthèse des recommandations 2007 : (3 pages ; ici) ;
- La synthèse de l’ensemble des recommandations 2007 (22 pages ; ici) ;
- L’argumentaire des recommandations 2007 - Diagnostic et prise en charge initiale (131 pages ; ici)
- L’argumentaire des recommandations 2007 aspect hors médicaments (264 pages ; ici)
Il est nécessaire de rappeler qu’après un recours devant le Conseil d’Etat, exercé par l’association FORMINDEP, « pour une formation et une information médicales indépendantes de tout autre intérêt que celui de la santé des personnes », la HAS avait été contrainte le 27 avril 2011 d’abroger sa recommandation portant sur le traitement médicamenteux du diabète de type 2 (ici). Anticipant une seconde décision de la plus haute juridiction administrative défavorable à la HAS, son Président, le Professeur Jean-Luc HAROUSSEAU annonçait sur France Inter le 18 mai 2011, le retrait également de la recommandation portant sur la maladie d’Alzheimer (ici), ainsi que le réexamen de toutes les recommandations HAS publiées entre 2005 et 2010, et leur retrait en cas de doute confirmé par notre groupe de déontologie.
Après délibération du Collège de la Haute Autorité de Santé le 15 septembre 2011, la décision n°2011.09.082/MJ portant suspension de 6 recommandations de bonne pratique est publiée sur son site le 19 septembre 2011 (ici). Six recommandations, dont deux relative à la polyarthrite rhumatoïde (« Diagnostic et prise en charge initiale - septembre 2007 » et « Prise en charge en phase d’état - septembre 2007 ») sont suspendues dans l’attente de leur réactualisation. A ce jour, elles n’ont toujours pas été réactualisées par la HAS…
Ces recommandations avaient été suspendues car elles présentaient des « faiblesses de forme ». Les rhumatologues encore en activité aujourd’hui, membres du comité d’organisation ou du groupe de travail (voir les 2 dernières pages, 130 et 131, de l’argumentaire des recommandations HAS 2007, ici), figurent tous en bonne position dans le tableau des avantages perçus et des conventions signées, déclarés dans la base Transparence santé. A savoir : les Professeurs Philippe BERTIN (Limoges), Pascal CLAUDEPIERRE (Créteil), Maxime DOUGADOS (Hôpital COCHIN, Paris), Alain SARAUX (Brest), Daniel WENDLING (Besançon), le Dr Richard DAMADE, Médecin Interniste (Chartres) pour le comité d’organisation. Idem dans le groupe de travail pour le Pr. Bernard COMBE (Montpellier), et le Dr Milka MARAVIC (Chargée de projet, Paris), Dr Gaël MOUTERDE (Montpellier), Serge PERROT (Paris), Pr. Jacques POUCHOT, médecin interniste (Paris), Xavier PUECHAL (Paris, au Mans en 2007)…. . La première chef de projet du groupe de travail HAS pourrait avoir été recyclée chez les laboratoires UCB Pharma qui commercialisent CIMZIA®, selon le site « KesKeCes ».
Sans parler du groupe de lecture qui méritait à lui seul un petit travail spécifique, histoire de bien comprendre comment à l’époque la HAS prenait au sérieux les risques de conflits d’intérêts. Notre recherche a porté exclusivement sur les rhumatologues membres du groupe de lecture et encore en activité sur la période 2012-2015 ; Par ordre alphabétique : Yannick ALLANORE (Paris), Jean-Marie BERTHELOT (Nantes), Christine BONNET (Limoges), Philippe BREUILLARD (Gonesse), Daniel CHENEBIT (Montluçon), Arnaud CONSTANTIN (Toulouse), Sylvie FABRE (Montpellier), Bruno FAUTREL (Paris), Laure GOSSEC (Paris), Pascal HILLIQUIN (Corbeil-Evry), Pr. Xavier LE LOET (Bois-Guillaume), Mireille LESTRADE (Paris), Philippe LO-RE (Tulle), Antoine MARTIN (St-Brieuc), Jacques MOREL (Montpellier), Dr Bertrand MOURA (Paris), Denis MULLEMAN (Tours), Isabelle NEGRIER-CHASSAING (Limoges), Richard TRÈVES (Limoges).
Les recommandations 2007 de la HAS avaient néanmoins l’avantage de proposer en cas de PR active sévère d’emblée la triple association renforcée par la prise de corticoïdes en 4ème option (citées par ordre alphabétique) :

Présentation des nouvelles recommandations de septembre 2007 portant sur le « diagnostic et la prise en charge de la polyarthrite
rhumatoïde initiale »par le Dr. Milka MARAVIC et le Pr. Gaël MOUTERDE, rhumatologues à Paris et Montpellier, et le Dr. Joëlle
FAVRE-BONTÉ, Chargé de Mission à la HAS, faite au MEDEC le 18 mars 2008 (Accès vérifié le 27/07/2016 : ici)
Et en stratégie de seconde intention :
Nous retrouvons à gauche la « triple association » noyée entre différentes options
Les recommandations européennes et américaines souffrent des mêmes biais.
Comment ces experts ont-ils pu accepter depuis 20 ans d’être investigateur principal ou co-investigateur d’essais cliniques randomisés comparant de nouveaux médicaments au placebo ou au méthotrexate en monothérapie à doses suboptimales, alors que des comparateurs plus efficaces existaient ? Ce type d’essais n’apporte rien d’autre qu’un moyen d’exagérer l’efficacité des nouveaux médicaments et fait courir un risque non éthique de perte de chance aux patients inclus dans les groupes de contrôle. De tels experts sont donc surtout au service du marketing des laboratoires pharmaceutiques et ne favorise pas l’optimisation de la prise en charge des patients atteints de polyarthrite rhumatoïde
Au-delà de l’expertise « académique », c’est l’ensemble des rhumatologues qui semble courtisé par les industriels commercialisant des biothérapies (mais aussi le méthotrexate forme injectable) et bénéficie des largesses des bienfaiteurs.)
Retour
Les biosimilaires :
Au hasard de mes recherches, je tombe (ici), sur « Biosimilars: What do patients need to consider? » sur le site de l’EULAR (« European League Against Rheumatism ».
Incroyable texte par lequel les rhumatologues européens, sans jamais prendre clairement position, mais préférant se faire le porte parole des patients, tout en semant le doute dans leur esprit, semblent peu confiants dans l’efficacité et la tolérance des biosimilaires (en France, il y a déjà 2 biosimilaires de REMICADE® (infliximab), un biosimilaire d’ENBREL® (étanercept) et il y aura sous peu des biosimilaires pour le ROACTEMRA® (tocilizumab) en 2017 et pour HUMIRA® en 2018, selon un article publié le 4 octobre dans les Echos…).
BENEPALI®, le biosimilaire d’étanercept commercialisé depuis mai 2016 par Biogen Idec France, qui ne permet de réaliser qu’une modique économie de 14,3% sur le princeps ENBREL®, n’avait toujours pas fait à fin août 2016 l’objet d’un seul remboursement en ville par l’assurance maladie (données MEDIC’AM mensuelles). Nous voyons bien-là la réticence des rhumatologues à le prescrire. Mais rien d’étonnant car ils n’ont ni avantages à percevoir, ni de conventions à signer !
Un récent éditorial du BMJ, s’étonnait de ce que les rhumatologues de sa majesté ne pensaient à prescrire un biosimilaire d’infliximab qu’une fois sur cinq. Alors que dire de nos rhumatologues. En France en 2015, les biosimilaires de l’infliximab n’ont représentés que 2,5% des remboursements !
Retour
Quelques vidéos de nos pseudo experts hexagonaux, d’ailleurs plutôt experts en occultation qu’en auscultation…
Atelier sur la Polyarthrite rhumatoïde de la 1ère édition des Assises Hospitalières en Rhumatologie réalisé par Xavier MARIETTE et Jean SIBILIA.
Cliquer ici ou sur l’image ci-dessous pour ouvrir la vidéo
Xavier MARIETTE y parle de la triple association en limitant son intérêt aux patients (24 septembre 2011 selon : ) Voir à 14s de l’enregistrement « Si les biothérapies sont si utilisées, c’est effectivement qu’elles sont efficaces. Mais, douze ans après leur introduction, c’est vrai qu’on peut se poser la question sur les essais qui ont démontré l’efficacité. Beaucoup de ces essais ont comparé les biothérapies à un traitement qui était, que prenait les patients et qui est devenu inefficace, qu’est le méthotrexate. Et finalement, il y a eu très peu d’essai qui ont comparé une biothérapie à un autre traitement de fond classique qui pourrait être une combinaison de médicaments, comme par exemple la combinaison méthotrexate, SALAZOPYRINE®, PLAQUÉNIL®. Et actuellement, il y a deux essais en cours qui comparent chez des patients en échec du méthotrexate, ont évalué ou sont en train d’évaluer cette combinaison. Un premier essai suédois qui a été publié et un essai américain qui est en cours, et on est un peu surpris des résultats qui montrent finalement que cette association de traitements de fond classiques pourrait dans certains cas faire quasiment aussi bien que la biothérapie »
En réalité, ce leader d’opinion aurait du dire « cette association ne fait pas moins bien que la biothérapie associée au méthotrexate ». Ce qui est très différent !
Il poursuit (à 1:10 de l’enregistrement) : « Alors « dans certains cas » c’est lesquels ? C’est les patients qui n’ont pas ou ont très peu d’atteinte structurale. C'est-à-dire peu d’érosion sur les radiographies ».
Eh bien, « banco » !
Cher Pr MARIETTE, commencez-donc par prescrire la trithérapie conventionnelle en 2ème ligne, après 12 semaines de traitement par le méthotrexate en monothérapie à doses efficaces sans réponse satisfaisante !
Nota : Selon les critères des sociétés savantes de rhumatologie (ACR aux USA, EULAR en Europe et SFR en France, une réponse satisfaisante correspond à la rémission ou à l’atteinte d’un faible niveau d’activité de la maladie.
Retour
Un vidéo intitulée « L’ère des biothérapies » - Emission N°3 sur la chaîne Polyarthrite TV propriété de l’association de patients AFP-Ric (« Association Française des Polyarthritiques et des Rhumatismes Inflammatoires Chroniques »)
Cliquer ici ou sur l’image ci-dessous pour ouvrir dans une autre fenêtre l’extrait vidéo ou ici pour la vidéo complète (11 min. 25 s)
Le Pr SIBILIA, CHU Strasbourg, à propos des biothérapies : « On est mieux que tous ce qu’il y avait avant »
Retour
Une vidéo plus récente, en 3 parties : « Polyarthrite : traitements d’aujourd’hui et de demain »
Cliquer ici ou sur l’image ci-dessous pour l’ouvrir
Le Dr RAJZBAUM, Groupe Hospitalier Paris Saint Joseph « Si on vous avait fait cet exposé il n’y a ne serait-ce que 15-20 ans, on vous aurait dit on a des traitements dans le polyarthrite mais malheureusement il y a quinze ans on vous aurait dit, il est très difficile d’essayer d’empêcher l’évolution de la maladie, d’empêcher les érosions, d’empêcher les destructions. Et on avait il y a quelques années des traitements qui calmaient les symptômes, mais qui n’avaient pas d’action sur la maladie elle-même. En 2015, le discours est très différent ? C’est qu’on peut maintenant vous dire qu’on a des traitements, certes qu’il faut savoir utiliser, qu’il faut savoir prescrire et prendre, mais des traitements qui sont capables de stopper l’évolution de la maladie et d’empêcher l’évolution, d’empêcher les érosions, les déformations et les destructions articulaires. Le message qu’il faut retenir c’est qu’il y a vraiment des progrès considérables qui ont été faits ces quinze dernières années » ; À 5:27 de l’enregistrement « Le point le plus important je pense, c’est de pouvoir avoir un accès rapide à ces traitements, à ces médicaments. Et on sait maintenant qu’une façon de limiter au maximum les érosions, les destructions articulaires, c’est de vous permettre, de permettre aux patients d’avoir un accès rapide au traitement, au traitement de fond, on va en reparler. Et pour avoir un accès rapide au traitement de fond, il faut avoir un diagnostic rapide »
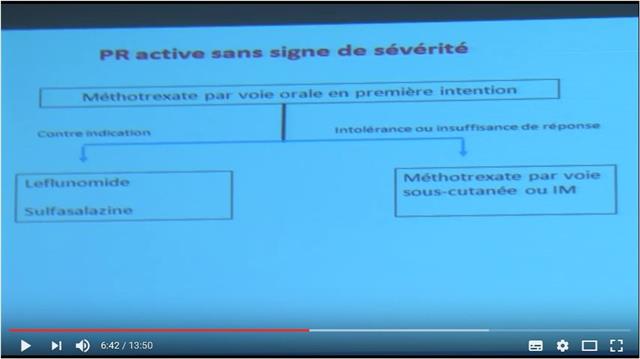

À 7:14 de l’enregistrement 2/3 (ici) : « Dans les recommandations, dans les intensifications de traitement, il y a deux écoles, je dirais il y a deux façons de faire. Soit on reste sur les traitements conventionnels qu’on peut associer entre eux. Je dois dire que moi à titre personnel, je n’aime pas trop cette façon de faire. Je ne suis pas trop prescripteur de ces associations. Mais ça fait partie des recommandations. Certaines écoles le font. On peut associer méthotrexate, SALAZOPYRINE® et le PLAQUÉNIL®. Et des études ont montré que l’association des trois faisait mieux que le méthotrexate seul, mais évidemment, on va cumuler les effets secondaires de tous ces médicaments. Ça c’est clair. Et puis l’autre façon de traiter ces formes graves d’emblée, c’est de prescrire une biothérapie en première intention, en association au méthotrexate, éventuellement en monothérapie s’il y a une contre-indication à l’utilisation du méthotrexate. Mais à ce moment-là, on peut associer une biothérapie avec un autre traitement, comme le léflunomide (ARAVA®) ».
Mais quand même M. RAJZBAUM, nous sommes en 2015, et une demi-douzaine de résultats d’études cliniques randomisées en double aveugle ont été publiées dans les plus grandes revues médicales comparant la triple association à un anti-TNF-alpha, infliximab ou étanercept, associé au méthotrexate. Les résultats sont pourtant clairs : la triple association ne leur est pas inférieure, tant en termes d’efficacité que de tolérance !
Á 4:32 de l’enregistrement 3/3 (ici). « Après, la question qui va se poser, si ça ne marche pas. Qu’est ce qu’on fait en cas d’échec d’un traitement de 1 ère ligne ? Méthotrexate, on a donné une biothérapie. Ça ne marche pas très bien. Et là on rentre dans les discussions très complexes… Echec ou échappement…Affaire d’équipe (staff médical) et de spécialistes… »
Et puis dans la dernière partie de l’exposé, de quoi faire rêver : les anti JAK !...
Retour
Pr GOUPILLE, CHU Tours (Vidéo accessible ici) :

Nota : Les laboratoires Abbott ont changé de nom. Ils s’appellent désormais ABBVIE, leader de la polyarthrite rhumatoïde avec HUMIRA®, adalimumab (ne pas confondre avec alibabamumab) et ses 450 millions d’euros en ville et à l’hôpital en 2015 !
« Tout d’abord il faut peut être rappeler ce qui s’est passé depuis dix ans. On a quand même assisté à un bouleversement de la prise en charge de la polyarthrite rhumatoïde dans notre arsenal thérapeutique. Pour faire très simple on va dire il y a dix ans, le méthotrexate était quasiment le traitement de dernière ligne, dernier espoir. Et en fait, quand les gens étaient au méthotrexate, on disait que on ne pouvait pas faire beaucoup mieux *. Et donc, on n’avait pas la nécessité d’un diagnostic précoce, puisqu’on disait qu’on avait des moyens thérapeutiques relativement limités. Donc on a vu arrivé au début des années 2000 ces fameuses biothérapies… très efficaces… Et par exemple, à titre anecdotique, je fais un cours aux étudiants (en médecine) à Tours sur la polyarthrite rhumatoïde depuis des années, eh bien je ne leur parle plus de certains traitements que moi j’ai utilisé pendant 20 ans, dont ils n’entendront jamais parler, puisqu’on ne les utilise plus du tout… On en prescrit tous les jours, on n’a malheureusement pas pour nous d’actions ou de pourcentage sur la prescription d’anti-TNF… ».
(*) Voilà une affirmation totalement fausse, pour ne pas dire mensongère. Ce rhumatologue est pourtant Professeur des Universités. Or, la démonstration dans un essai clinique randomisé de la très nette supériorité de la trithérapie conventionnelle au méthotrexate en monothérapie est établie depuis 1996 dans une publication au New England Journal of Medicine (ici).
Retour
Pr. René-Marc FLIPO, CHU LILLE (Vidéo accessible ici) « Les rhumatismes inflammatoires à titre indicatif représentent 20 à 30% des patients hospitalisés. Par contre en secteur de consultations, l’activité des rhumatismes inflammatoires représente avec l’ostéoporose la spécificité des médecins de l’équipe, l’une des composantes les plus importantes. Et bien sur, il y a l’hôpital de jour avec le développement des biothérapies qui est à 80% dépendant des biothérapies hospitalières. Donc c’est une activité importante qui mobilise l’ensemble de l’équipe hospitalière. On a la chance à Lille d’avoir trois professeurs de Rhumatologie, les professeurs DUQUESNOY et CORTET, et on a chacun, sans sexisme particulier, une collaboratrice qui nous aide dans nos domaines de prédilection. Donc, sur la polyarthrite notamment, j’ai la chance de travailler avec le Dr Peggy PHILIPPE, qui chapeaute l’hôpital de jour. Et puis bien sur après, deux chefs de clinique, nous avons 5 internes, qui représentent en moyenne 2 rhumatologues en formation par année ».
Mais FLIPO, n’a aucun lien financier à déclarer :
Le PU-PH (Professeur des Universités - Praticien Hospitalier) lillois, champion toutes catégories de la section « rhumatologie » d’après nos décomptes sur le site transparence santé, avait déjà été épinglé par le Formindep dans l‘article « Franck Lebœuf, nouveau visiteur médical de chez Pfizer : la « douloureuse » reconversion des sportifs » (ici).
Retour

La vidéo ci-dessus a été réalisée par la SFR et est accessibles à partir du site de l’AFP-Ric (ici, patientez quelques secondes le temps de son téléchargement). Le Dr Catherine BEAUVAIS, rhumatologue à l’hôpital Saint-Antoine, Paris, évoque les risques d’infections liés à l’emploi des biothérapies : « Les traitements de la polyarthrite, particulièrement les biothérapies, exposent à un risque accru d’infections… Les infections les plus à craindre chez les patients traités pour la polyarthrite, particulièrement par biothérapies, sont les infections ORL, les rhinopharyngites, les sinusites, mais également les infections pulmonaires, les infections urinaires ou cutanées ».
Les patients sont certes sensibilisés, mais ils pourraient être insuffisamment informés des risques d’infections sévères, de nouveaux cancers et d’événements indésirables graves, dont des décès, avec ces traitements biologiques très (trop) fortement immunosuppresseurs (voir ici, notamment le rapport trimestriel de l’ISMP consacré aux événements indésirables graves associés aux anti-TNF-alpha, et l’analyse des décès déclarés dans la base européenne Eudravigilance).
Retour
La chaine Polyarthrite.TV de l’association AFP-Ric (ici)

Newsletter AFP ric N°2 (ici). Cette Newsletter réalisée grâce au soutien institutionnel des laboratoires Roche, postérieure à septembre 2012 (Elle cite « Polyarthrite infos N°88 de septembre 2012 ») ne parle pas de l’association triple dans les traitements de fond conventionnels, et marginalise la SALAZOPYRINE® et le PLAQUENIL® dans la PR : A propos de PLAQUENIL® : « Il est actuellement essentiellement utilisé dans le lupus ; sa place est limitée dans la PR, réservé aux formes bénignes de polyarthrites indifférenciées dans les premiers mois d’évolution. Il peut surtout être associé aux autres traitements conventionnels » et pour SALAZOPYRINE® : « Il est utilisé comme traitement de fond de la maladie de Crohn et de la rectocolite hémorragique » L’article se termine par : « Nous remercions chaleureusement les médecins qui nous ont apporté leur concours pour la rédaction de cette newsletter : les Drs GIRAUDET-LEQUINTREC, VERROT, FAUTREL et ALLANORE...
Retour
Le site de la Société Française de Rhumatologie regorge de vidéos archivées dans une médiathèque (ici). Hélas, ces vidéos ne sont accessibles qu'aux seuls membres de la SFR. Nous aurions aimé pouvoir visionner par exemple :

Ou encore :

Notez que les rhumatologues ne se sont pas bousculés pour visionner cette dernière vidéo…
La SFR aurait-elle des choses à cacher ?
Retour
Vidéo postée par la CPAM de la Somme - Pr Vincent GOEB, CHU Amiens « Prescrire les anti-TNF-alpha » (accessible ici) :

« Le message à retenir, c’est que grâce à ces traitements, grâce à ces biomédicaments on a considérablement changé le pronostic des patients. Moi, j’ai commencé mon internat dans les années 2000. En 2000 on avait, j’exagère un peu, on avait des corticoïdes et c’est tout pour soigner la polyarthrite rhumatoïde *, avec des patients qui détruisaient rapidement leurs articulations et qui schématiquement, ne pouvaient pas ouvrir une bouteille d’eau, tellement ils avaient des mains déformées en quelques mois. Maintenant, on ne voit plus ça. Heureusement. Les patients on les sauve de beaucoup de choses. Alors ce qu’on applique en rhumatologie, on le voit aussi en dermatologie et dans les autres spécialités. Le prix à payer quand même, c’est qu’on a un certain nombre d’effets indésirables, parfois paradoxaux, on est sensé parfois traiter plusieurs maladies à la fois, on traite une spondylarthrite ankylosante et un psoriasis apparait. Alors on ne comprend pas tout, il faut rester humble. D’autant plus qu’il y a plein de nouveaux biomédicaments, plein de nouvelles cibles, plein de cytokines, plein de nouveaux messagers intercellulaire qu’on arrive à bloquer. Mais plus on les bloque, plus finalement on arrive à avoir d’autres effets… Donc, on ne joue pas bien sur les apprentis sorciers. Mais l’évolution de la connaissance se fait aussi à vitesse grand V en ce moment. Donc, mon message c’est oui, c’est formidable, mais ça a un coût aussi pour la société. Donc, il faut être vigilant sur la façon de les prescrire. Faut être vigilant pour le patient, et puis, c’est affaire de spécialiste. Il faut rester humble, et ne pas hésiter à s’entourer de conseils de gens qui ont l’habitude de prescrire ces traitements »
(*) Même remarque qu’un peu plus haut pour le Pr GOUPILLE, CHU de Tours. Il s’agit une nouvelle fois d’une affirmation parfaitement fausse, pour ne pas dire mensongère dans la bouche du Pr GOEB...
Retour
Des associations de patients largement financées par les firmes pharmaceutiques
Les associations de patients ont également fait l’objet d’une analyse similaire
- Les 4 associations de patients : AFLAR, ANDAR, AFP ric, AFS
Cliquer ici ou sur l’image ci-dessous pour télécharger le fichier Excel des 4 associations de patients polyarthritiques
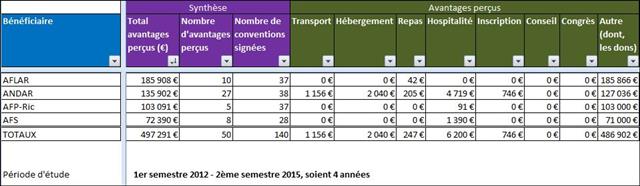
Ces associations sont avares en information sur leur financement
- ANDAR : Association nationale de défenses contre l’arthrite rhumatoïde, Gérard THIBAUD président (en 2013), Site web (ici),
- AFS : Association française de la spondylarthrite, Delphine LAFARGE, présidente (en 2016), Site web (ici),
- AFLAR : Association française de la lutte rhumatismale, Dr Laurent GRANGE président (en 2013), rhumatologue au CHU Grenoble, Site web (ici)
- AFP ric (Site web ici) : Marie-Anne CAMPESE-FAURE, Présidente ; Plaquette 2014 ; Composition du CA juin 2015 ; Rapport Moral juin 2015 ; Rapport financier juin 2015 ; Rapport commissaire aux comptes Exercice 2014 ; Compte « Emploi/ressources » année 2014 ; CR de l’assemblée générale ordinaire du 21 juin 2015
Au total pour la seule année 2014 : « Les partenariats avec l’industrie pharmaceutique ont augmenté de 14 % pour l’AFP-Ric avec un total de 238 879 €. Cette augmentation résulte du développement de nouvelles activités comme les enquêtes, mais aussi du maintien de notre secteur d’édition et de nos Salons de la polyarthrite… La baisse des cotisations et des abonnements s’est poursuivie. Les dons faits à l’association sont, eux, en hausse de 5 %. Au final, les ressources collectées auprès de nos membres sont en baisse, à 247 434 € ».
L’association est donc financée pour moitié par les firmes !!!
Des montants qui n’apparaissent pas sur le site Transparence santé !!!
Pour l’ANDAR, si vous souhaitez consulter le « rapport moral et financiers », par exemple pour connaître les financements de l’association, voici la page dédiée du site web : 
Avouez que cela ne fait pas très sérieux : « En cours de rédaction » depuis le 25 mars 2016 et sans doute davantage. Si le rapport 2015 n’est pas encore disponible, au moins que l'on nous donne la possibilité de télécharger les rapports précédents.
Pour l’AFLAR, le dernier rapport moral et financier accessible est celui de 2013 (accessibles sur la page ici). Le rapport financier 2013 (ici), approuvé par une assemblée générale du 3 juillet 2014, ne fait que 4 pages et ne précise pas l’origine des produits d’exploitation…
Deux ans de retard dans la publication du rapport financier !!!
La page “traitements de fond” (ici) sur le site de l’ANDAR (Association Nationale de Défense contre l’Arthrite Rhumatoïde) : Vous pouvez toujours chercher une « notice » portant sur la trithérapie, vous ne la trouverez pas !

Retour
Et les autorités sanitaires en France, comment ont-elles contribué à ce fiasco de l’évaluation des médicaments fondée sur les preuves cliniques ?
L’immobilisme total de l’ANSM, qui subit le dictat de l’EMA, et reste campée sur des positions anachroniques
Comment se fait-il que les libellés d’indication AMM ne soient jamais révisés ?
Ci-dessous, l’exemple du REMICADE®

Source : le lien vers l’EPAR (ici) de l’EMA fourni par la base de données médicamenteuses du Ministère de la Santé (ici)
Pour la première sous-indication, ne serait-il pas opportun de spécifier à la suite de « dont le méthotrexate » : « et en cas d’échec de la trithérapie conventionnelle associant méthotrexate, sulfasalazine et hydroxychloroquine » ?
Quant à la seconde sous-indication, chez les « patients adultes ayant une maladie active, sévère et évolutive », naïfs de tout traitement par méthotrexate ou autres DMARDs conventionnels, il faudrait tout simplement la supprimer. Puisque les anti-TNF-alpha associés au méthotrexate n’ont pas démontré de supériorité à la trithérapie dans cette situation.
Enfin, le « ralentissement de la destruction articulaire, mesuré par radiographie » n’a pas d’intérêt, puisque qu’il est démontré que les différences observées dans les essais cliniques entre les différentes stratégies thérapeutiques de traitement de fond de la polyarthrite rhumatoïde n’ont pas de signification clinique (Voir la méta-analyse canadienne en réseau du BMJ 2016, et les études cliniques comparatives triple thérapie conventionnelle versus méthotrexate + infliximab ou étanercept américaines et suédoises, et les publications finlandaise objectivant la chute des arthroplasties… ici)
Par ailleurs, l’ANSM, l’agence la plus réfractaire à l’Open data en santé, est un véritable coffre-fort. Elle n’a diffusé aucune analyse des ventes de médicaments en France (ici, descendre jusqu’au deuxième paragraphe) depuis son très succin rapport sur des données très fragmentaires de l’année 2013, publié en juin 2014 (ici).
Parallèlement, alors qu’elle est dépositaire des chiffres de ventes en officines et à l’hôpital qui lui sont communiqués par les firmes pharmaceutiques, elle refuse toute demande de partage de ces données.
Précisons qu’elle est la seule détentrice des consommations de médicaments inclus dans les GHS à l’hôpital. Excusez du peu, cela représentait en 2013 (d’après le rapport ANSM précité) tout de même 55% des dépenses intra-hospitalières, 3,4 milliards d’euros sur un total de 6,2 milliards…
L’ANSM a même trouvé une Commission CADA très accommodante, comme en atteste l’avis défavorable reçu en juin 2016 (ici). Je ne comprends toujours pas où ce situe la difficulté de me transmettre le fichier intégral des ventes de médicaments entre 2001 et 2015. L’ANSM se situe à des années lumières de la Cnamts qui, elle, partage ses données depuis 2001 pour MEDIC’AM annuel (Ex : MEDIC’AM 2015), et a ouvert de nouveaux champs d’Open data, avec MEDIC’AM Mensuel, et Open MEDIC…
Retour
Après avoir suspendu en 2011 ses recommandations 2007 (C.f. plus haut ici), la HAS n’aurait pas dû « labelliser » en 2013 les « conseils d’utilisation des traitements anti-TNF et recommandations nationales de bonne pratique » élaborés par la SFR et les CRI (Club Rhumatismes et Inflammations)
En effet, le meilleur moyen de ne pas exposer les patients inutilement aux effets très fortement immunosuppresseurs responsables d’événements indésirables graves, dont des décès, aurait été de proposer la trithérapie conventionnelle en traitement initial ou après échec du méthotrexate en monothérapie, plutôt que les biothérapies anti-TNF-alpha ou autres. Voilà ce qu’aurait dû être le premier des conseils, la première des recommandations formulé(e)s dans ce texte…
Retour
La Commission de la Transparence (CT) de la Haute Autorité de Santé (HAS) n’a pas su prendre les décisions qui s’imposaient à la suite de ses belles trouvailles de juillet 2014
A l’occasion des avis de la commission de la transparence rendus le 24 juillet 2014 (mais mis en ligne seulement le 25 février 2015, soient 7 mois plus tard…), en vue du renouvellement de l’inscription sur la liste des médicaments remboursables aux assurés sociaux des spécialités de DMARDs conventionnel PLAQUENIL®, hydroxychloroquine (ici) et SALAZOPYRINE®, sulfasalazine (là), la HAS découvrait pour la première fois les vertus de la triple association.
Il semble que ce soit en fait à Sanofi Aventis que l’on doive cette révélation, puisque la firme avait osé porter 3 nouvelles études cliniques à la connaissance des membres de la commission, à savoir les essais américain TEAR, suédois SWEFOT, finlandais FIN-RACo avec suivi après 11 années.
En revanche, Pfizer qui commercialise ENBREL®, étanercept, n’avait aucun intérêt à faire de l’ombre à son anti-TNF-alpha avec la sulfasalazine, un produit mineur sur le plan stratégique, et n’a donc, contrairement à Sanofi, pas fourni les études portant sur la trithérapie conventionnelle (Au contraire même, l’américain n’a pas hésité à transmettre à la commission une étude plutôt négative pour la sulfasalazine, et il faut bien le dire, sans grand intérêt tellement les résultats étaient courus d’avance. En effet, cette étude dont le premier auteur n’est autre que le Montpelliérain Bernard COMBE, l’un des tous premiers de notre palmarès, comparait chez trois groupes de patients en échec de sulfasalazine administrée pendant 3 ou 4 mois, l’étanercept seul, l’étanercept associé à la sulfasalazine, la sulfasalazine en monothérapie. Pas très éthique ce protocole qui laisse dans un bras des patients en échec de traitement et à risque élevé d’érosion articulaire. Encore une bonne occasion de perdue d’essayer la trithérapie. Cet essai est en accès libre ici).
Du coup, le service d’évaluation des médicaments a procédé à une recherche bibliographique complémentaire qui a sorti notamment les études néerlandaises BeSt et tREACH, danoise CIMESTRA, finlandaise NEO-RACo, et américaine RACAT. Il aurait pu trouver aussi l’étude écossaise TICORA. Mais bon, saluons cet excellent travail bibliographique de la Commission.
L’examen de tous ces travaux conduit la CT à conclure (page 6 de l’avis) : « L’ensemble de ces données confirment l’efficacité de l’hydroxychloroquine en association à d’autres traitements de fond classiques non biologiques (l’association au méthotrexate et à la sulfasalazine étant les plus étudiées) et ou non à la corticothérapie dans le traitement de la polyarthrite rhumatoïde active. La non-infériorité de la trithérapie MTX, sulfasalazine et hydroxychloroquine a été démontrée par rapport à l’association biothérapie anti-TNF (étanercept) +MTX à court terme (48 semaines).
L’avis de la CT sur SALAZOPYRINE®, comporte à peu de choses près les mêmes études et se conclue de manière identique.
Mais pourquoi donc la commission n’a-t-elle pas été plus loin ? Il était de son ressort de programmer une réévaluation de l’ASMR des anti-TNF-alpha et autres biothérapies « non anti-TNF-alpha » qui ont constamment été évaluées dans les essais comparativement au méthotrexate en monothérapie.
Le Président de la Commission de la transparence, le Pr Loïc GUILLEVIN, n’a probablement pas pu siéger et encore moins voter lors de ces réunions. En effet, comme il l’expliquait lors de sa conférence de clôture du colloque 2014 « Surmédicalisation, surdiagnostics et surtraitements » (ici, voir le second paragraphe de la page 3), ayant été co-investigateur d’un essai du rituximab (MABTHERA®) dans les vascularites dont les résultats ont été publiés dans le NEJM, et ayant fait une conférence en 2013 sur les « effets secondaires infectieux sous immunosuppresseurs » dans un symposium de médecine interne sponsorisé par Pfizer, il ne peut ni instruire le dossier du médicament, ni voter, et doit sortir de la salle. Et cela pour tous les produits du laboratoire, mais aussi pour tous les laboratoires qui ont des comparateurs…
Retour
En septembre et novembre 2016, la Commission de la Transparence HAS, ne tombe pas dans le panneau des biothérapies en 1ère ligne, mais elle loupe encore le coche !
Le 30 septembre 2016, la HAS met en ligne les 3 avis de réévaluation du SMR dans l’indication de 1ère ligne dans la PR sévère chez des patients naïf de méthotrexate, pour HUMIRA®, ENBREL® et REMICADE®. Idem, le 25 novembre 2016 pour SIMPONI®. Le verdict est sans appel : Service médical insuffisant…
Oui, mais, elle n’a toujours pas « acté » qu’il faudrait recaler ces biothérapies en 3ème ligne, après échec de la trithérapie conventionnelle…
Le fait que les deux précédent présidents de la CT aient été rhumatologues (Gilles BOUVENOT et Bernard AVOUAC) et que l’actuel soit médecin interniste, a-t-il un rapport avec les ASMR de niveau III très complaisamment accordées aux anti-TNF-alpha dans la polyarthrite rhumatoïde ? La question mérite tout de même d’être posée.
Retour
Les « travaux secrets » de la Commission d’évaluation économique et de santé publique (CEESP) de la HAS
Cette commission, après saisine de la Direction de la Sécurité Sociale, avait produit en novembre 2015 une feuille de route intitulée « l’évaluation médico-économique des biothérapies dans la prise en charge de la polyarthrite rhumatoïde », publiée en décembre 2015 (ici). L’examen des références bibliographiques citées sur cette feuille de route montrait une telle pauvreté des travaux sélectionnés, semblable en tous points à la recommandation 2014 de la Société Française de Rhumatologie, que je saisi l’occasion qui m’était donnée d’interpeller Madame Catherine LE GALLES, Vice-présidente de la CEESP aux amphis de la santé le 1er mars 2016 :
Cliquer ici ou sur l’image ci-dessous pour ouvrir la vidéo au début de l’interpellation (environ 5 min 30s) avec la réponse de Mme LE GALLES.

La Vice-Présidente n’était manifestement pas « au fait » du dossier et ignorait le sort réservé à la note de cadrage que la CEESP avait prévu de publier en janvier 2016 selon sa feuille de route sus mentionnée.
Le BOAMP (bulletin officiel d’annonce des marchés publics) publie une consultation de la HAS (ici) dont l’objet était « Réalisation d'un modèle médico-économique dans la prise en charge de la polyarthrite rhumatoïde ». Ce type de modèle de simulation médico-économique est généralement réalisé par des prestataires privés très proches des firmes pharmaceutiques. Cliquer ici pour télécharger l’acte d’engagement valant cahier des clauses particulières.
Le 30 avril 2016, la note de cadrage n’étant toujours pas publiée, j’écris à la responsable du service, Mme Catherine RUMEAU-PICHON.
Sans réponse dans un délai d’un mois, comme la Loi m’y autorise, le 30 mai 2016, je saisi une première fois la CADA (Commission d’Accès aux Documents Administratifs) afin d’obtenir cette fameuse note de cadrage.
Dans les jours qui suivirent la notification par la CADA de la date d’examen de ma demande, je reçois (enfin) le 28 juin 2016 une réponse étonnante de la part de Madame Catherine RUMEAU-PICHON : « Cette note de cadrage, bien qu’envisagée dans la partie « Calendrier prévisionnel » de la feuille de route, n’a finalement jamais été réalisée car la feuille de route semblait suffisamment détaillée pour démarrer le travail ».
Après quelques jours de réflexion, le 8 juillet 2016, je saisi une seconde fois la CADA, cette fois-ci pour obtenir l’acte d’engagement qui désigne le bénéficiaire du marché de prestations dont aucun avis d’attribution n’a été publié.
Ce ne sera que le 20 octobre 2016, que la CADA ayant rendu son avis, me répond que « le directeur de la Haute Autorité de santé a informé la commission que le document sollicité n’existait pas dans la mesure où la procédure de marché a été déclarée sans suite ».
Le 16 novembre 2016, lors du colloque annuel de la HAS, je profite de la participation de l’adjointe à la Direction de l’Evaluation Médicale, Economique et de Santé Publique, Madame RUMEAU-PICHON, à une table ronde, pour lui demander si la HAS poursuivait ses travaux sur les biothérapies dans la polyarthrite rhumatoïde ?
Réponse « Oui, avec ses ressources internes »
Je me retourne alors sur une autre ressource potentielle à laquelle je n’avais pas pensé jusque-là, les comptes-rendus des réunions de la CEESP.
Ô surprise, en cliquant sur lien (ici) vous constaterez avec nous, que la CEESP ne publie aucun procès-verbal ou compte-rendu, mais seulement des « ordres du jour prévisionnels » qui tiennent tous sur une page, c’est dire la pauvreté informationnelle de leur contenu. Sans compter, que ces « ODJ » ne sont publiés qu’une fois par an. Ainsi, pas moins de 14 ODJ ont été mis en ligne le 17 octobre 2016 (réunions du 21 juillet 2015 au 11 octobre 2016). Les ODJ précédents avaient été publiés le 27 juillet 2015.
Seul l’ODJ du 15 septembre 2015, mentionne la feuille de route, publiée en décembre la même année, avec les « rapporteurs ». Mais, aucune trace des biothérapies dans la PR dans les autres ODJ…
Bref, une très grande opacité entoure les travaux de cette commission hautement stratégique, puisqu’elle est notamment chargée de donner un « avis d’efficience » pour éclairer le Comité économique des produits de santé (CEPS) sur les médicaments qui ont un impact significatif sur les comptes de l’assurance maladie…
Retour
Pour finir avec la HAS, sa présidente qui pourrait bien se tromper d’expertise
Madame la Professeure Agnès BUZYN, alors présidente de l’Institut National du Cancer, lors d’une audition sur « la prévention des conflits d’intérêts en matière d’expertise sanitaire » devant la Commission des Affaires Sociales du Sénat, le 20 janvier 2015 (ici), n’avait pas hésité à qualifier de « dérive vers l’interprétation jusqu’au-boutiste des liens d’intérêts comme un conflit » ce qui à ses yeux rend l’expertise sanitaire « périlleuse » en France…
Cliquer ici ou sur l’image ci-dessous pour ouvrir la vidéo (1 min 34 s) de l’intervention de Mme BUZYN au Sénat le 20 janvier 2015

Lors de la même audition au Sénat, Mme Chantal BELORGEY, alors proche collaboratrice de Madame BUZYN à l’INCa, que l’actuelle Présidente de la HAS a fait venir avec elle, pour justement diriger la DEMESP (voir l’organigramme ici), s’interroge sur la différence entre liens et conflits d’intérêts. « Est-ce qu’un médecin qui va au plus grand congrès mondial en cancéro peut ou ne peut pas être dans le groupe d’experts qui propose ces recommandations (pour la pratique clinique) ? … On peut être très sévère, on peut l’être un peu moins…»
Cliquer ici ou sur l’image ci-dessous pour ouvrir la vidéo (durée 1 minute et 22 secondes) de l’intervention de Madame BELORGEY au Sénat le 20 janvier 2015

La réponse allait être apportée dans l’audition suivante par M. Jean-Sébastien BORDE, alors Président du FORMINDEP : « Un conflit d’intérêts est un lien qui peut avoir ou paraître avoir une incidence sur son jugement et sur son activité principale… Il n’est absolument jamais mentionné qu’il y avait des liens d’intérêts plus ou moins importants, etc… Il a été démontré par énormément d’étude que tous les liens d’intérêts pouvaient induire un jugement biaisé. Et donc toutes ces définitions ne font pas la distinction entre liens d’intérêts et conflits d’intérêts »
Cliquer ici ou sur l’image ci-dessous pour ouvrir la vidéo de l’intervention de M. Jean-Sébastien BORDE devant les Sénateurs (durée 1 minute et 1 seconde) le 20 janvier 2015.

En définitive, Madame BUZYN, nul besoin d’être un expert PU-PH en rhumatologie, présent à tous les congrès de la planète dans sa discipline, à l’ACR, à l’EULAR ou à la SFR, pour se forger un jugement robuste sur quelle serait la meilleure option dans le traitement de fond de la polyarthrite rhumatoïde.
Puisse cet article contribuer à faire émerger la nécessaire indépendance de l’expertise sanitaire.
François PESTY
12/12/2016 - Après la méta-analyse canadienne en réseau, la messe est dite dans la polyarthrite rhumatoïde : La trithérapie conventionnelle est supérieure aux biothérapies !
Il faudra bien que les rhumatologues intègrent cette évidence longtemps cachée dans leur pratique et leurs recommandations, pour le plus grand bénéfice des patients et des assurés…
Cet article fait partie d’une trilogie dont les deux autres volets sont :
- « Alibabamumab et les trois cent-quarante rhumatologues » - Pourquoi aurez-vous bien du mal à trouver un rhumatologue pour vous prescrire le meilleur traitement de fond dans la polyarthrite rhumatoïde » ici,
- « La caverne d’Ali baba ou l’indescriptible chaos qui a présidé à la naissance de la bien mal nommée « Transparence.santé » » (prochainement en ligne).
Cliquer sur les liens hypertextes pour vous déplacer aisément dans cet article et revenir au plan
Plan de l’article :
- La 1ère étude pivot de la trithérapie conventionnelle dans le traitement de fond de la polyarthrite rhumatoïde, NEJM 1996
- La méta-analyse canadienne en réseau qui la consacre, BMJ 2016
- Les recommandations biaisées de la Société Française de Rhumatologie (SFR) dans la polyarthrite rhumatoïde
- Le tableau des différentes posologies utilisées pour la trithérapie conventionnelle
- Le coût annuel en France des différentes stratégies de traitement de fond de la polyarthrite rhumatoïde en 2016
- Le problème du choix de comparateurs médiocres dans les essais thérapeutiques
- Les rhumatologues sont également réticents à l’idée de prescrire les biosimilaires des anti-TNF-alpha
- Les biothérapies dans la polyarthrite rhumatoïde ne sont pas dénuées de risque : revues générales, rapport de l’ISMP, Eudravigilance
- La triple association de DMARDs conventionnels est extrêmement peu utilisée en France
- En conclusion, la nécessaire évolution des exigences à remplir pour l’autorisation de mise sur le marché des nouveaux médicaments
Pourquoi et comment l’appétit du gain des firmes pharmaceutiques et la cupidité des rhumatologues, ont produit depuis 20 ans des recommandations biaisées dans la polyarthrite rhumatoïde, dissimulé la vérité aux patients sur le meilleur traitement et floué la sécu…C’est un prolongement indissociable à cet article que vous trouverez en cliquant : ici.
16 mai 1996 et 21 avril 2016, deux dates mémorables dans la connaissance scientifique de l’utilité d’une stratégie du traitement de fond de la polyarthrite rhumatoïde :
La 1ère étude pivot de la trithérapie conventionnelle dans le traitement de fond de la polyarthrite rhumatoïde, NEJM 1996 Retour
Il y a vingt ans, James O’DELL, médecin interniste spécialisé en rhumatologie, exerçant dans un centre du Veterans Affairs, à Omaha, Nebraska aux USA, démontrait la nette supériorité d’une triple association de médicaments conventionnels, le méthotrexate, la sulfasalazine et l’hydroxychloroquine sur le méthotrexate en monothérapie, qui était déjà alors le traitement de fond de 1ère intention dans la polyarthrite rhumatoïde ; Les résultats de cet essai randomisé en double aveugle avec un suivi de deux ans étaient publiés dans la très fameuse revue médicale, the New England Journal of Medicine. Nous avions ici-même largement commenté voici trois ans cette étude pivot.
La méta-analyse canadienne en réseau qui la consacre, BMJ 2016 Retour
Il y a huit mois, le 21 avril 2016, le BMJ publiait les résultats d’une revue systématique Cochrane (version abrégée) et d’une gigantesque méta-analyse canadienne en réseau ayant porté sur 158 essais cliniques randomisés publiés ou non et plus de 37.000 patients. Ces résultats mettent un terme à toute controverse scientifique sur le traitement de fond de la polyarthrite rhumatoïde (en accès libre : ici). N’en déplaise aux rhumatologues intéressés par les avantages qu’ils et que leurs institutions hospitalières retirent de l’utilisation préférentielle pour ne pas dire « industrialisée » des biothérapies, eh bien non, les meilleurs traitements ne sont pas les anti-TNF-alpha…
Tout d’abord, expliquons ce que sont les méta-analyses en réseau, et quelle est leur utilité :
Dans leur quête permanente d’exagération de l’efficacité et de la tolérance de leurs médicaments*, les firmes pharmaceutiques évitent à tous prix les essais comparatifs avec des alternatives thérapeutiques existantes, leur préférant le placebo, bien moins risqué. Les anti-TNF-alpha n’ont pas échappé à cette règle d’or. Mais, c’était sans compter justement sur la méta-analyse en réseau :
En effet, lorsque nous disposons d’un ou de plusieurs essais cliniques ayant comparé le médicament « A » avec le médicament « B ». « B » pouvant être le placebo. Et que par ailleurs, « B » a été comparé à « C » dans une ou plusieurs autres études randomisées. Il est alors possible de comparer indirectement « A » avec « C ». Plus nous avons d’études et de patients, plus la puissance de la méta-analyse permet de mesurer des différences d’efficacité, voire de tolérance entre les traitements ou stratégies thérapeutiques.
(*) : Source : The Inverse Benefit Law: How Drug Marketing Undermines Patient Safety and Public Health. Howard Brody and Donald W. Light. American Journal of Public Health. March 2011, 101;3:399-404. Accès gratuit vérifié le 28/02/2016 : ici
La figure ci-dessous présente l’ensemble des options thérapeutiques qui ont pu être comparées par la méta-analyse canadienne en réseau :
Abréviations utilisées : ABAT =abatacept; ADA=adalimumab; AZA=azathioprine; CQ=chloroquine; ETN=etanercept; CTL-certolizumab; CyA=ciclosporin; GOL=golimumab; HCQ=hydroxychloroquine; IFX=infliximab; IM=intramuscular; IR=inadequate response; IV=intravenous; LEF=leflunomide; MTX=methotrexate; RT X=rituximab; sc=subcutaneous; SSZ=sulfasalazine; TOFA=tofacitinib; TCZ=tocilizumab
Paradoxalement, au nez et à la barbe des rhumatologues « intéressés » aux USA, en Europe, comme en France, lesquels ont permis aux firmes de réaliser tant d’essais thérapeutiques (pour ne pas dire la quasi-totalité) comparativement au placebo, l’omniprésence de cette stratégie du « rien du tout » dans les bras de contrôle de ces études cliniques constitue, dans le cas d’une méta-analyse en réseau un énorme facteur de succès pour évaluer à leur juste valeur les alternatives thérapeutiques. Ce qui a été fait ici dans le traitement de fond de la polyarthrite rhumatoïde.
Nul besoin d’être « fluent in English » pour appréhender les conclusions auxquelles sont parvenus nos amis canadiens :

Les recommandations biaisées de la Société Française de Rhumatologie (SFR) dans la polyarthrite rhumatoïde Retour
Dans l’extrait suivant des recommandations 2014 de la Société Française de Rhumatologie pour la prise en charge de la polyarthrite rhumatoïde (accès libre vérifié le 29/07/2016 : ici), page 5 au paragraphe « 4.2. Traitement de 1ère ligne », les auteurs se sont appliqués à démolir la place de la triple association de DMARDs conventionnels dans la stratégie de prise en charge initiale.
Les auteurs ont mentis à la fois par omission de la quasi-totalité des travaux publiés sur l’efficacité de la triple thérapie, mais aussi en tenant des propos non conformes aux résultats publiés qu’ils ont l’audace de citer à l’appui de leur argumentation fallacieuse. Une démarche totalement à coté de la plaque. Au football, cela mériterait un carton rouge :
« Deux études récentes ont comparé l’efficacité clinique et structurale de la triple association MTX + sulfasalazine + hydroxychloroquine par rapport au MTX seul [53,54]. L’étude tREACH est un essai contrôlé, randomisé en simple insu chez des patients souffrant de polyarthrite récente à haut risque d’évoluer vers une polyarthrite établie sans critère spécifique de mauvais pronostic [53]. Cette étude (avec corticothérapie) était en faveur, sur certains paramètres, de la triple association de traitements de fond. Cependant, l’étude TEAR nuançait cette stratégie intensive d’emblée puisque dans le cadre d’un contrôle serré avec adaptation thérapeutique dynamique selon un objectif prédéfini, il n’y avait pas d’avantage clinique ou radiographique à une triple association d’emblée par rapport au MTX en monothérapie [54]. À noter, fin 2013, que de nouvelles données ont été apportées par l’étude CareRA conduite en Belgique [55]. Cet essai contrôlé randomisé ne montrait pas de supériorité de la triple association de traitements de fond, par rapport au MTX seul (avec corticothérapie dans les 2 bras) [55]. Enfin, la triple association peut être mal acceptée par le patient (nombre de comprimés, tolérance.) et s’accompagne d’un maintien thérapeutique médiocre [56]. Ainsi, compte tenu de l’insuffisance de données consistantes et concordantes, la recommandation propose le MTX en monothérapie comme traitement de fond de 1ère ligne ».
Nous devrions proposer ce texte pour l'enseignement de la lecture critique aux internes en rhumatologie…
Contre-expertise et analyse du texte en toute indépendance :
Alors que les recommandations 2014 de la SFR ont été publiées en ligne en juin 2014, seule l’étude TEAR (O’DELL, 2012) est citée (référence 54). Mais les auteurs des recommandations ont intentionnellement omis de préciser quel était le principal enseignement de cet essai qui comparait la triple association à l’association étanercept (ENBREL®) au méthotrexate en traitement intensif immédiat ou après 24 semaines de méthotrexate en monothérapie. A savoir, que la triple association n’était pas inférieure à l’anti-TNF-alpha combiné au méthotrexate. La tendance est même plutôt favorable à la triple thérapie avec 3 à 4 points de taux de rémission supérieur. L’interprétation donnée par les leaders d’opinion de la SFR est même en totale contradiction avec les résultats de l’étude TEAR.
Une autre étude, « tREACH », néerlandaise, démontrant la nette supériorité de la triple association sur le méthotrexate en monothérapie, est également citée en faveur de la triple association ; Il s’agissait des premiers résultats de cette étude publiés en ligne en juin 2012 (référence 53, résumé accessible librement : ici) ; Bien plus intéressants furent les résultats des suivis à un an, publiés en 2014 (accès libre au texte intégral : ici), et après deux ans, publiés en juin 2016 (résumé accessible en suivant le lien : ici). En effet, à un an, les objectifs de traitements étaient atteints plus vite avec la triple association et se maintenaient avec un moindre recours aux biothérapies. Les échecs de traitement sont 40% moins fréquents qu’avec le méthotrexate en monothérapie. Au bout de deux ans, 57% des patients auront été au moins une fois en rémission prolongée (DAS < 1,6 lors de deux consultations successives à 3 mois d’intervalle) et 80% présentaient une faible activité de la maladie (DAS < 2,4). Une désescalade thérapeutique a été initiée chez respectivement 118 patients traités par DMARDs conventionnels (trithérapie) et 23 sous biothérapie associée au MTX ; Douze mois après l’initiation de la désescalade un échappement thérapeutique était observé chez 41% et 37% (sans différence significative) des patients respectivement. La rémission était restaurée chez 65% des patients lors de l’intensification des traitements de fond ré-initiée après échappement thérapeutique.
En fait, il s’agit d’un « baisé de Juda » aussitôt tempérée par deux attaques aussi sournoises qu’infondées, s’appuyant sur de simples abstracts (références 55 et 56), au demeurant inaccessibles à partir des liens fournis dans la recommandation !!! Notamment, il est affirmé par nos leaders d'opinion sous influence, je cite « À noter, fin 2013, que de nouvelles données ont été apportées par l’étude CareRA conduite en Belgique [55]. Cet essai contrôlé randomisé ne montrait pas de supériorité de la triple association de traitements de fond, par rapport au MTX seul (avec corticothérapie dans les 2 bras) [55] » Or, les résultats de l’étude belge CareRA (référence [55] des recommandations SFR 2014) n’ont été publiés en ligne que le 30 octobre 2014 (accès ici vérifié le 21/07/2016) : ) c'est-à-dire postérieurement à leur publication en juin dans la Revue du Rhumatisme ; Juste un problème, après lecture attentive de la publication, il s’avère que l’essai CareRA ne comportait aucun bras avec la triple association !
Nous avons retrouvé l’abstract [55] en question. Il est téléchargeable ici. Pas d’erreur, la triple association ne figure pas dans les bras de l’étude… D’ailleurs les résultats à 16 semaines de l’étude belge CareRA ont été publiés en janvier 2015 (et avant cela, en ligne le 30 octobre 2014, donc après les recommandations SFR. Accès au résumé vérifié le 1er août 2016 : ici)
Quant à la référence [56] des recommandations 2014 de la SFR, vous la retrouverez page 459 du numéro spécial de la revue de l’ACR faisant 1341 pages et téléchargeable en suivant le lien : ici. Franchement, ce travail ne présente aucun intérêt dès lors que l’on prendra connaissance du suivi à onze ans de l’étude finlandaise « FIN-RACo » (Cf. infra) publié en mai 2009, et qui n’est évidemment pas mentionné par les experts SFR, pas même dans leur bibliographie…
Enfin, selon la méta-analyse canadienne en réseau précité (BMJ, 04/2016), aucune différence cliniquement significative n’est observée sur le critère de la progression radiographique.
En clair, l’interprétation faite par les leaders d’opinion de la SFR de l’étude TEAR n’a rien à voir avec les résultats publiés. Et le fait de contester l’efficacité de la triple association de DMARDs conventionnels en s’appuyant sur l’essai CareRA, qui n’a pas évalué cette stratégie thérapeutique, est une véritable forfaiture. Nous pouvons parler de « tromperie » organisée.
En revanche, aucun des autres travaux importants publiés depuis 2012, et tout particulièrement en 2013 n’est cité, bien que les auteurs des recommandations 2014 de la SFR aient disposé de 12 mois pour en prendre connaissance ! Il s’agit cette fois-ci de « mensonges par omission » :
Ainsi, la publication tonitruante dans le New England Journal of Medicine le 11 juin 2013, des résultats probants obtenus aux USA et au Canada lors d’un premier essai dénommé RACAT, randomisé en double aveugle comparant frontalement la triple thérapie à l’étanercept (ENBREL®) associé au méthotrexate, aurait du mettre le feu aux poudres ! Surdité de nos experts SFR…
Egalement, la possibilité de décider dès 12 semaines de méthotrexate en monothérapie du passage à la triple association conventionnelle en cas de réponse insuffisante, était une observation intéressante disponible en libre accès depuis juin 2013 suite à la publication des résultats de suivi à deux ans justement dans l’étude TEAR (ici). Les auteurs démontraient aussi pour la première fois, et en double aveugle, que 28% des patients en monothérapie de méthotrexate sont en rémission après 24 semaines ce qui valide cette stratégie de démarrer en première ligne. Cette seconde publication des résultats à deux ans dans l’essai TEAR en août 2013 est en accès libre sur PMC depuis février 2016 (ici).
Pas plus que nos experts de pacotille n’auront été intéressés par le suivi à 2 ans de l’étude suédoise SWEFOT, publiée, s’il vous plait, dans le Lancet le 5 mai 2012 et comparant en « head-to-head » la triple association conventionnelle à l’infliximab (REMICADE®) combiné au méthotrexate !
Avait suivi dans une autre très grande revue médicale, le JAMA Internal Medicine les observations faites sur les registres de la sécurité sociale suédoise pour les patients de l’étude SWEFOT en termes de nombre de journées de travail perdues et d’indemnité d’invalidité perçue.
Ni même, l’étude d’efficience économique après 2 ans de suivi dans l’essai SWEFOT qui conclut en affirmant que l’infliximab (REMICADE®) n’est pas « coût efficace ». Cette dernière étude a pourtant été publiée en ligne le 15 avril 2014, bien avant la publication des recommandations 2014 SFR. Accessible librement : ici.
Nos leaders d’opinion auraient-ils une lecture sélective des publications médicales ?
Ne parlons pas des travaux finlandais, et notamment de l’étude « FIN-RACo » et de son suivi après 11 ans, publié en 2010 ! (Accès libre sur Pub Med Central en suivant le lien : ici).
Ou encore de l’essai NEO-RACo, publié en ligne le 30 juin 2012, dans lequel l’ajout à la trithérapie conventionnelle de l’infliximab (REMICADE®) pendant six mois n’apporte aucune amélioration clinique significative. (Abstract accessible en suivant le lien : ici).
Une publication par une équipe finlandaise dans Acta Orthopaedica en août 2013 enregistre une forte réduction entre 1995 et 2010 de la chirurgie de reconstruction articulaire en Finlande, pays qui avait immédiatement adopté la triple association méthotrexate + sulfasalazine + hydroxychloroquine dans ses recommandations pour le traitement de la polyarthrite rhumatoïde. Travail en accès libre vérifié le 20/07/2016 : ici). Résultat en tout point comparable à ce qui a été observé dans les pays recourant fortement aux biothérapies…
L'incidence annuelle des prothèses de hanche, de genou, d'épaule et de coude chez les patients souffrant de polyarthrite rhumatoïde (graphique A), la part des prothèses posées chaque année pour polyarthrite rhumatoïde par rapport à la totalité des prothèses posées (graphique B), l’utilisation de chacun des médicaments du traitement de fond de la PR (DMARDs) entre 1995 et 2010 selon les registres de santé finlandais (Graphique C). La relation inverse entre l’utilisation du méthotrexate et la pose de prothèses articulaires dans la polyarthrite rhumatoïde (graphique D)
En Finlande, entre 1995 et 2010, l’essor de la trithérapie conventionnelle (graphique C) coïncide avec une forte réduction des poses de prothèses de hanche, de genou et surtout d’épaule et de coude. Une réduction considérable de la proportion des patients atteints de polyarthrite rhumatoïde sujets à la pose de ce type de prothèses. Par exemple, en 1995 plus de 80% des prothèses de coude étaient posées chez des patients polyarthritiques, moins de 50% en 2010. Plus de deux tiers des prothèses d’épaule en 1995, à peine plus de 10% en 2010. Les poses de prothèses de genou et de hanche causées par l’évolution d’une polyarthrite rhumatoïde sont devenues rares en Finlande (graphique B). Dans ce pays nordique en 2010, pour 100.000 habitants, les utilisateurs d’hydroxychloroquine, de sulfasalazine et de méthotrexate, sont de 3 à 5 fois plus nombreux que les utilisateurs de biothérapies. Voir plus loin pour comparer avec les pratiques en France. Une relation inverse entre l’utilisation croissante du méthotrexate et la forte baisse des poses de prothèses articulaires est établie.
Nos rhumatologues leaders d’opinion, ont complètement occulté l’étude pivot d’O’DELL et de ses collègues du Veterans Affairs, publiée dans le célébrissime New England Journal of Medicine en… 1996. Laquelle étude établissait avec un excellent niveau de preuve la nette supériorité de la triple association sur le méthotrexate en monothérapie. Lequel méthotrexate seul, n’aurait jamais du rester le traitement de référence dans les groupes de contrôle des essais randomisés dans le traitement de fond de la polyarthrite rhumatoïde.
Dans une revue générale des stratégies thérapeutiques dans la polyarthrite rhumatoïde, publiée dans le NEJM en Juin 2004 (ici), James O’DELL présentait de manière juxtaposée 7 essais thérapeutiques comparant au méthotrexate en monothérapie l’association au méthotrexate de différents DMARDs conventionnels ou biologiques.
Avec 71% des patients chez lesquels était constatée une amélioration de +20% des symptômes selon les critères de l’ACR (American College of Rheumatology), il était déjà prévisible que la triple association de DMARDs conventionnels ferait jeu égal avec les biothérapies dans les essais cliniques frontaux qui suivirent quelques années plus tard…
Il est fort instructif d’observer que 4 de nos leaders d’opinion (ici), les Pr. Maxime DOUGADOS, Bernard COMBE, Alain CANTAGREL, et Philippe GOUPILLE, écrivaient en avril 1999 en discussion de la publication de leurs résultats obtenus lors d’une étude multicentrique menées en France, en Allemagne et en… Finlande, et qui avait comparé la sulfasalazine, le méthotrexate seul, et l’association des deux molécules, en citant l’étude pivot d’O’DELL et al., qu’ « Une autre étude récemment publiée suggère que la triple association sulfasalazine, méthotrexate et hudroxychloroquine apporte un meilleur bénéfice par rapport à la combinaison de la sulfasalazine au méthotrexate ou par rapport au méthotrexate seul ». L’accès libre à ce travail a été vérifié le 21/07/2016 : ici).
Pour quelle raison n’ont-ils pas poursuivi dans cette direction ?
Nous pouvons encore citer les travaux écossais, avec l’étude « TICORA » randomisée en simple insu avec contrôle strict et stratégie d’intensification thérapeutique sur la base de l’utilisation de l’association triple (MTX + SSA + HCQ) avec si besoin augmentation des doses de DMARDs et ajout de prednisolone, se fixant pour objectif une réduction d’au moins 1,2 du score d’activité de la maladie (DAS, Disease Activity Score, définition de l’EULAR) et afin d’obtenir une « bonne réponse » (DAS < 2,4). Les patients étaient vus chaque mois en consultation dans le groupe traitement intensif, et seulement tous les 3 mois dans le groupe de contrôle « soins habituels ». Les résultats à dix-huit mois de suivi furent éloquents et publiés dans le Lancet en 2004 (Accès vérifié le 05/08/2016 : ici).
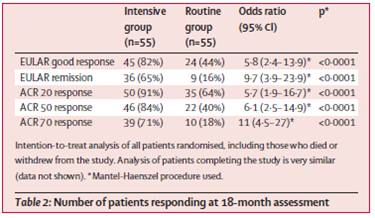
Enfin, il est intéressant aussi de signaler l’étude multicentrique néerlandaise BeSt, même si elle est jugée assez complexe, car comparant initialement chez 508 patients 4 stratégies différentes d’intensification thérapeutique en faisant appel à 9 DMARDs différents, ce qui autorisait une multitude de combinaisons possibles. Les principaux enseignements de cette étude, selon l’éditorial qui accompagnait la publication des résultats après deux ans de suivi dans Annals of Internal Medicine en mars 2007 (full-text en suivant ce lien vérifié le 05/08/2016 : ici ; Editorial accessible aux abonnés : là), sont les suivants :
- Lorsque les cliniciens ont la liberté de modifier ou d’intensifier les traitements, une très large majorité de patients ira très bien après deux années quelque soit le traitement initial ;
- L’état clinique sera excellent pour la plupart des patients qui auront atteint un bas niveau d’activité de la maladie (DAS < 2,4) ;
- Le traitement doit être individualisé.
Dès 15 mois de suivi (publié en novembre 2005 : ici), puis à deux ans (voir précédemment), puis après 7 années de suivi (ici) et enfin à 10 ans (résultats publiés le 19 avril 2016 ; Accès au résumé vérifié le 05/08/2016 : ici), l’amélioration clinique est sans différence significative entre les 4 bras de l’essai. Dans le deuxième bras de l’étude les patients commençaient par le méthotrexate en monothérapie, puis l’intensification thérapeutique consistait en l’ajout de la sulfasalazine, puis d’hydroxychloroquine (trithérapie, introduite donc en 3ème ligne), et si la réponse était insuffisante de la prednisolone était rajoutée ; Dans le quatrième bras, le traitement initial consistait d’emblée en l’association infliximab + méthotrexate. A dix ans de suivi, 53% des patients sont en rémission, et 14% en rémission sans médicament, sans différence entre les stratégies thérapeutiques. Les dommages radiographiques sont limités et la survie similaire entre les groupes.
Bref, la triple association a été utilisée avec succès aux USA, en Finlande, en Suède, aux Pays-Bas, en Ecosse, se montrant largement supérieure au méthotrexate en monothérapie et non inférieure à l’étanercept et à l’infliximab associés au méthotrexate dans les essais randomisés en double aveugle.
Et ce, qu’il s’agisse d’efficacité clinique, de nombre de journées de travail perdu, d’indemnité pour invalidité, ou de réduction des arthroplasties dans la PR…
La méta-analyse canadienne en réseau qui a comparé tous les traitements de fond, à base de DMARDs de synthèse ou biologiques, la consacre « meilleur traitement », mieux tolérée notamment que l’association méthotrexate + infliximab, après avoir compilé les données de 158 essais randomisés totalisant 37.000 patients souffrant de polyarthrite rhumatoïde. Et les rhumatologues français ne l’ont pas encore essayé !
Soyons très clairs, ces oublis, ces erreurs sont tellement énormes, et le fait qu’ils n’aient pas été corrigés par les relecteurs, aggrave encore notre perception. Au bout du compte, on a bien du mal à croire qu’elles n’aient pas été intentionnelles…
Tableau des différentes posologies utilisées pour la trithérapie conventionnelle Retour
Pays / Auteurs / Essais/ Années | Méthotrexate | SALAZOPYRINE® | PLAQUENIL® |
USA O’DELL 1996, 2002 TEAR 2012 RACAT 2013 | 7,5 mg à 17,5 mg/sem. | 2 x 500 mg/j. | 2x200 mg/j. |
Jusqu’à 20 mg/sem. | 2x500 mg à 2x1.000 mg/j. | 2x200 mg/j. |
15 mg à 25 mg/sem. | 2x500 mg à 2x1.000 mg/j. | 2x200 mg/j. |
|
|
|
|
FINLANDE * FIN-RACo 1999 Suivi après 11 ans 2009 NEO-RACo 2012 | 7,5 mg à 15 mg/sem. | 2x500 mg à 2x1.000 mg/j. | 300 mg/j. |
10 mg à 25 mg/j. | 2x500 mg à 2x1.000 mg/j. | 35 mg/kg/sem. |
|
|
|
|
ECOSSE TICORA 2004 | 7,5 mg à 25 mg/sem. | 500 mg/j. à 40 mg/kg/j. | 200 mg à 400 mg < 6,5 mg/kg/j. |
|
|
|
|
PAYS-BAS BeSt 2005 2007 | 15 mg à 30 mg/sem. | 2.000 mg à 3.000 mg/j. | 400 mg/j. |
|
|
|
|
SUEDE SWEFOT 2012 | 20 mg/sem. | 2x1.000 mg/j. | 400 mg/j. |
(*) + prednisolone 5 mg à 10 mg/j. dans les études finlandaises (FIN-RACo et NEO-RACo)
Coûts annuels en France des différentes stratégies de traitement de fond de la polyarthrite rhumatoïde Retour
Cliquer sur le tableau ci-dessous pour télécharger le fichier Excel et passer la souris sur les cellules à coin rouge pour lire les commentaires
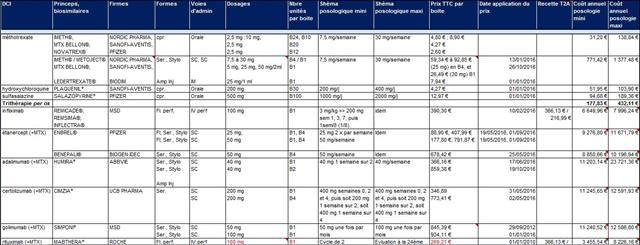
En terme de coût de traitement journalier, sachant que le prix TTC d’une boite de 30 comprimés de PLAQUENIL® dosés à 200 mg d’hydroxychloroquine délivrée en officine de ville s’élève à 4,27 €, que celui d’une boite de 100 comprimés de SALAZOPYRINE® dosés à 500 mg de sulfasalazine est de 12,97 €, nous nous situons aux posologies du tableau précédent entre 14 et 28 centimes d’euros et entre 26 et 78 centimes d’euros respectivement. Ces deux DMARDs conventionnels représentent donc un coût annuel additionnel au méthotrexate compris entre 147 et 388 €.
En ce qui concerne le méthotrexate, la firme NORDIC PHARMA détient un quasi monopole sur l’injectable, avec une gamme de seringues pré-remplies dosées à 7,5, 10, 12,5, 15, 17,5, 20, 22,5, et 25 mg et des prix astronomiques, allant de 59,34 € TTC la boite de 4 seringues (marque IMETH®) dosées à 7,5 mg, à 92,85 € TTC les 4 seringues dosées à 25 mg ou en boite de 1 seringue pré-remplie (marque IMETH® ou METOJECT®). Le laboratoire MEDAC, commercialise METOJECT® 30 mg stylo prérempli.
Au total, en fonction de la dose hebdomadaire, le méthotrexate injectable est de 10 à 25 fois plus onéreux que le méthotrexate « per os »…
- Pfizer avec une seule présentation pharmaceutique en comprimés à 2,5 mg boites de 12, commercialisée sous le nom de marque NOVATREX® non compétitif au prix de 2,60 € TTC, par rapport à la boite de 24 cpr IMETH 2,5 mg proposée à 4,80 € chez NORDIC PHARMA,
- Sanofi-Aventis, fidèle à la marque BELLON, Mais le METHOTREXATE BELLON CPR 2,5 MG B20 est à 4,27 € TTC ce qui est encore trop cher par rapport à NORDIC PHARMA
- BIODIM (encore sous le nom de LEDERTREXATE®)
Le coût annuel de la trithérapie conventionnel est modique, s’échelonnant entre 178 et 432 € selon les posologies minimales ou maximales retenues
Aux posologies minimales, par rapport à la trithérapie orale, les biothérapies sont de 19 fois (rituximab, MABTHERA®) à 82 fois (abatacept, ORENCIA®) plus onéreuses. Les moyennes arithmétiques des multiples de coûts entre biothérapies et triple association conventionnelle sont de 57 fois et 34 fois, respectivement pour les posologies basses et fortes.
Aux posologies maximales, le coefficient multiplicateur des coûts va de 18 fois (infliximab, REMICADE et biosimilaires) à 58 fois (abatacept, ORENCIA®) celui de l’association triple de DMARDs conventionnels.
Cliquer sur l’image pour ouvrir la présentation diapositives qui contient ce graphique
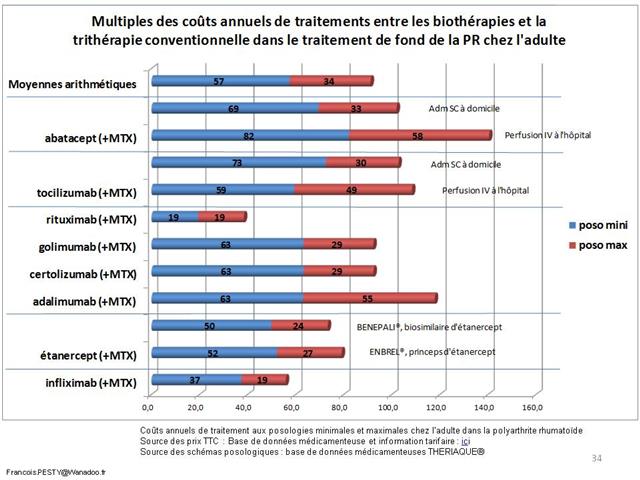
Les différentiels de coûts annuels de traitement par patient entre la stratégie « trithérapie » et celles d’associer au méthotrexate une biothérapie, vont de 3.278 euros (MABTHÉRA®, rituximab) à 14.428 euros (ORENCIA®, abatacept), aux posologies les plus faibles (avec prise en charge hospitalière dans les deux cas) et de 7.794 euros (encore le rituximab) à 24.786 euros (toujours l’abatacept). Les moyennes arithmétiques de ces différentiels de coûts annuels de traitement des biothérapies avec l’association triple de DMARDs conventionnels sont respectivement de 10.034 euros et 14.165 euros par patient pour les posologies les plus basses et les plus fortes…
Cliquer sur l’image pour ouvrir la présentation diapositives qui contient ce graphique
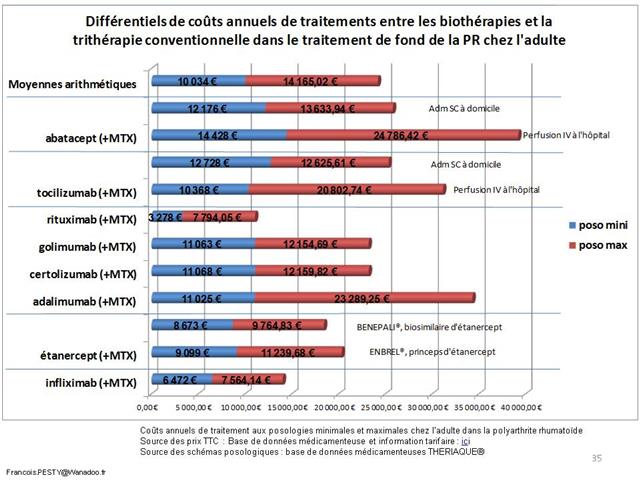
Le problème du choix de comparateurs médiocres dans les essais thérapeutiques : Retour
A ce propos, signalons une excellente revue générale cosignée du Pr Philippe RAVAUD, responsable de la Cochrane française, dans Archives of Internal Medicine, qui dénonce l’absence de groupe de contrôle avec un traitement de référence dans les essais évaluant les biothérapies dans la polyarthrite rhumatoïde. Selon l’épidémiologiste clinicien, cela soulève un sérieux problème d’éthique médicale. Comment est-il possible en effet de laisser pendant des mois des patients que l’on sait insuffisamment traités subir des érosions et des destructions articulaires irréversibles ? Tout cela dans le seul but de tromper la communauté scientifique et de pouvoir exagérer l’efficacité des biothérapies coûteuses. Rappelons que toutes les études dans ce domaine jusqu’à ces travaux récemment publiés aux USA et en Suède, ont évalué l’association biothérapie au méthotrexate contre le méthotrexate en monothérapie (cela revient quasiment à comparer la biothérapie à un placebo…). Bien évidemment, ce travail n’a pas le droit de citer dans les recommandations SFR 2014. Il est néanmoins en accès libre : ici.
Ce problème de non pertinence des comparateurs choisis dans les essais perdure encore aujourd’hui (et que l’on ne nous dise pas que les investigateurs n’ont pas leur part de responsabilité). Outre l’exagération recherchée de l’efficacité et de la tolérance des molécules testées, des conséquences graves en lien avec la marge thérapeutique étroite de ces médicaments sont à redouter. Pour preuve, les dernières études présentées par BMS pour l’examen par la commission de la transparence de leur spécialité CIMZIA®, certolizumab pégol (4ème anti-TNF-alpha commercialisé en France dans la polyarthrite rhumatoïde, un « me-too »), toutes ont été conduites sur ce même modèle, et chacune avait au moins un co-investigateur parmi nos experts de la SFR :
Smolen JS, Emery P, Ferracioli GF, et al. Certolizumab pégol in rheumatoid arthritis patients with low to moderate activity: the CERTAIN double-blind, randomized, placebo-controlled trial. Ann Rheum Dis 2015. Etude CERTAIN (CIMZIA®) : ici et supplément : là (Pr. Francis BERENBAUM)
Weinblatt ME, Fleischmann R, Huizinga TW et al. Efficacy and safety of certolizumab pégol in a broad population of patients with active rheumatoid arthritis: results from the REALISTIC phase IIIb study, Rheumatology 2012;51:2204-2214. Accessible : ici. (Pr. Maxime DOUGADOS)
Keystone E, Landewé R, Van Volenhoven R, et al. Long-term safety and efficacy of certolizumab pégol in combination with methotrexate in the treatment of rheumatoid arthritis: 5 year results from the RAPID 1 trial and open-label extension. Ann Rheum Dis. 2013; 0:1-7. Accessible : ici et le supplément : là. (Pr. Bernard COMBE)
Autres études plus récentes sur CIMZIA® avec nos KOL français comme co-investigateurs :
Combe B et al. Certolizumab Pegol Efficacy Across Methotrexate Regimens: A Pre-Specified Analysis of Two Phase III Trials. Arthritis Care Res (Hoboken). 2016 Mar;68(3):299-307. doi: 10.1002/acr.22676. (Accès libre vérifié le 25/07/2016 : Ici.) = nième « resucée » de 2 études publiées 8 ans plus tôt !
1ère publication des résultats de RAPID-1 : Keystone E et al. Certolizumab Pegol Plus Methotrexate Is Significantly More Effective Than Placebo Plus Methotrexate in Active Rheumatoid Arthritis. Findings of a Fifty-Two–Week, Phase III, Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group Study. ARTHRITIS & RHEUMATISM. Vol. 58, No. 11, November 2008, pp 3319–3329 DOI 10.1002/art.23964 (Accès libre vérifié le 27/07/2016 : ici)
1ère publication des résultats de RAPID-2 : Smolen J et al. Efficacy and safety of certolizumab pegol plus methotrexate in active rheumatoid arthritis: the RAPID 2 study. A randomised controlled trial. Ann Rheum Dis. 2009 Jun;68(6):797-804. doi: 10.1136/ard.2008.101659. Epub 2008 Nov 17. Accès libre vérifié le 25/07/2016 : ici)
Le suivi à 5 ans de l’essai RAPID-1 : Keystone E et al. Long-term safety and efficacy of certolizumab pegol in combination with methotrexate in the treatment of rheumatoid arthritis: 5-year results from the RAPID 1 trial and open-label extension. Ann Rheum Dis. 2014 Dec;73(12):2094-100. doi: 10.1136/annrheumdis-2013-203695. Epub 2013 Aug 5. (Accès libre vérifié le 25/07/2016 : Ici). Pas de quoi pavoiser : 21 décès (2,2%)…
Le suivi à 5 ans de l’essai RAPID-2 : Smolen J et al. Certolizumab pegol plus methotrexate 5-year results from the rheumatoid arthritis prevention of structural damage (RAPID) 2 randomized controlled trial and long-term extension in rheumatoid arthritis patients. Arthritis Research & Therapy 2015.17:245. DOI: 10.1186/s13075-015-0767-2. (Accès libre vérifié le 25/07/2016 : ici). Pas très glorieux : 15,7% d’événements indésirables graves par année patient, 8 à 15% d’arrêt de traitement par an pendant les 4 premières années et 19 décès (3%)… NB : Bernard COMBE ne figure pas parmi les auteurs.
Le Dr Bernard COMBE a aussi participé à un essai avec Etanercept, publié en 2014 dans le NEJM :
Emery P et al. Sustained remission with etanercept tapering in early rheumatoid arthritis. N Engl J Med. 2014 Nov 6;371(19):1781-92. doi: 10.1056/NEJMoa1316133. (Accès libre vérifié le 25/07/2016 : Ici)
Les rhumatologues sont également réticents à l’idée de prescrire les biosimilaires des anti-TNF-alpha Retour
Au Royaume-Uni, une enquête récente montrait que chez 3.000 patients atteints de la maladie de Crohn sur une période d’un an se terminant en février 2016, les biosimilaires de l’infliximab ne représentait que seulement 20% du total des prescriptions de cet anti-TNF-alpha, alors que des biosimilaires étaient disponibles depuis février 2015. Rapport du Royal College of Physician accessible librement : ici. En France, sur l’ensemble de l’année 2015, les biosimilaires ne représentent que 2,5% du total de l’infliximab (tous spécialistes confondus)
Les biothérapies dans la polyarthrite rhumatoïde ne sont pas dénuées de risque, c’est un euphémisme. Il ne faut pas se « cacher derrière son petit doigt, comme le font les leaders d’opinion de la SFR qui minimisent ces risques… Retour
En juin 2014, l’American Journal of Medicine publiait en ligne les résultats d’une méta-analyse de 44 essais randomisés portant sur 11.700 patients traités par anti-TNF-α et 5.901 patients traités par placebo ou DMARD conventionnel(s) qui concluait à une augmentation significative de 42% de l’incidence de complications infectieuses sévères (ODD ratio 1,42 IC95% 1,13-1,78) et des arrêts de traitements suite à des événements indésirables (+23% IC95% 1,06-1,43). Accès au résumé vérifié le 24 juillet 2016 : Ici.
Selon l’ISMP (Institute for Safe Medication Practices) aux USA, HUMIRA® (adalimumab) et ENBREL® (étanercept), 2 anti-TNF-alpha indiqués dans la polyarthrite rhumatoïde, arrivaient en tête des médicaments ayant fait l’objet des plus grands nombres de signalement d’effets indésirables sévères en 2014 avec près de 47.000 et de 39.000 signalements respectivement et auraient été à l’origine de 1.809 décès. Source : Rapport annuel ISMP publié le 23 septembre 2015 : ici. L’effet immunosuppresseur puissant de ces médicaments est à l’origine d’un risque augmenté d’infections fongiques et bactériennes, de réactivation d’hépatites virales et de cancers. Le marketing intensif et la multiplication des contacts entre firmes pharmaceutiques ou leurs agents et les patients contribuent aussi à ce nombre important de signalements…
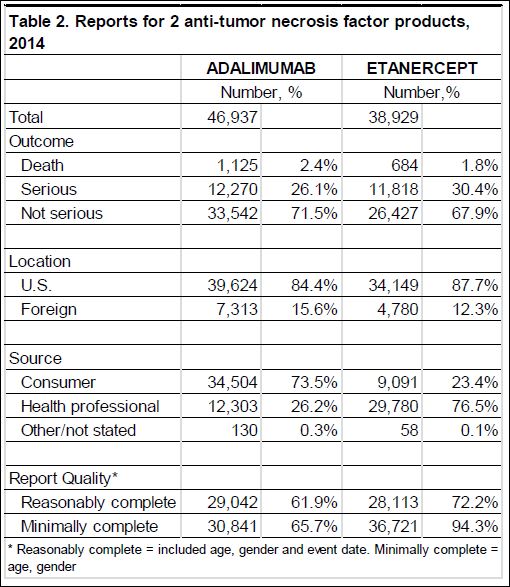
Notre étude exclusive à partir des données de la base Eudravigilance
Nous avons procédé à une analyse méthodique des déclarations d’événements indésirables graves dans la base Eudravigilance de l’EMA, agence européenne du médicament. Notre méthodologie est consignée dans un tutoriel que vous pouvez télécharger ici. Voici les principaux résultats présentés sous formes de graphiques :
Cliquer sur l’image pour ouvrir la présentation diapositives qui contient ce graphique
Cliquer sur l’image pour ouvrir la présentation diapositives qui contient ce graphique
Cliquer sur l’image pour ouvrir la présentation diapositives qui contient ce graphique
Télécharger les fichiers de ce travail en cliquant sur les liens ci-dessous :
Le fichier synthétisant l’ensemble des résultats avec ses graphiques :
- EMA_Dashboard_of_number of individual cases identified in EudraVigilance for RA_12-09-2016
Les fichiers d’analyse individuelle des médicaments de traitement de fond de la PR:
- EMA_number of individual cases identified in EudraVigilance for ORENCIA (up to August 2016)_10-09-2016
- EMA_number of individual cases identified in EudraVigilance for SIMPONI (up to July 2016)_29-08-2016
- EMA_number of individual cases identified in EudraVigilance for COSENTYX (up to August 2016)_11-09-2016
- EMA_number of individual cases identified in EudraVigilance for ROACTEMRA (up to August 2016)_11-09-2016
- EMA_number of individual cases identified in EudraVigilance for Infliximab (up to August 2016)_10-09-2016
- EMA_number of individual cases identified in EudraVigilance for MABTHERA (up to August 2016)_11-09-2016
- EMA_number of individual cases identified in EudraVigilance for Leflunomide (up to August 2016)_09-09-2016
- EMA_number of individual cases identified in EudraVigilance for Hydroxychloroquine (up to July 2016)_07-09-2016
- EMA_number of individual cases identified in EudraVigilance for Sulfasalazine (up to July 2016)_07-09-2016
- EMA_number of individual cases identified in EudraVigilance for Methotrexate (up to July 2016)_29-08-2016
- EMA_number of individual cases identified in EudraVigilance for REMICADE (up to July 2016)_25-08-2016
- EMA_number of individual cases identified in EudraVigilance for CIMZIA (up to July 2016)_28-08-2016
- EMA_number of individual cases identified in EudraVigilance for ENBREL (up to July 2016)_28-08-2016
- EMA_number of individual cases identified in EudraVigilance for HUMIRA (up to July 2016)_26-08-2016
Vu le caractère extrêmement chronophage de ce type d’étude, il est inadmissible que l’EMA n’ait pas conçu un accès aux données de manière à automatiser en quelques clics l’exportation de ce type d’analyse. Tout est fait pour rendre difficile la connaissance des données pertinentes : nombres de décès mensuels, nombres d’événements indésirables graves mensuels…
A noter, une étude brésilienne sur les registres de décès de Sao Paulo, entre 1996 et 2010. Les auteurs montrent une diminution très préoccupante de l’âge de décès après 50 ans chez les patients dont la cause du décès est la polyarthrite rhumatoïde.
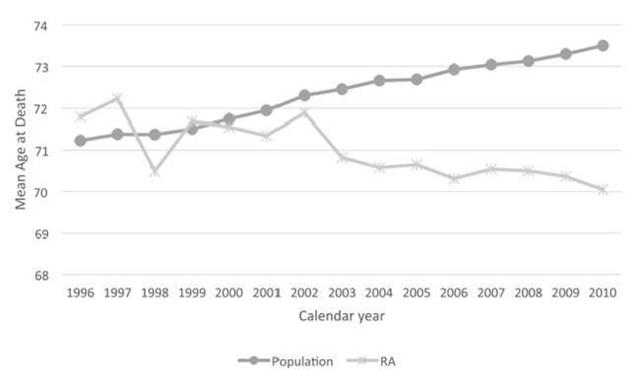
Tendance observée sur les âges du décès inscrits sur les certificats de décès dans la population générale et chez les patients atteints de polyarthrite rhumatoïde entre 1996 et 2010 dans l’Etat de Sao Paulo, Brésil
Les auteurs enregistrent aussi une forte croissance entre la période antérieure à l’avènement des biothérapies (1996-2000) et la période postérieure (2006-2010) pour les causes de décès « pneumonie » et « Sepsis ». Source : A Study of Multiple Causes of Death in Rheumatoid Arthritis. Frederico A.G. Pinheiro, Deborah C.C. Souza, and Emilia I. Sato. J Rheumatol First Release October 15 2015; doi:10.3899/jrheum.150166. Accès au résumé vérifié le 25/07/2016 : Ici.
Une revue récente, rapporte que d’après les études réalisées à partir des registres nationaux et autres données populationnelles, le taux d’incidence d’infections sévères avec les anti-TNF-alpha serait de 3 à 8 pour cent patients-années, avec une fréquence typiquement 1,5 à 2 fois plus élevée qu’avec les thérapies conventionnelles (non biologiques) particulièrement dans les 3 à 6 mois qui suivent le début du traitement. Les arthrites septiques sont 2 fois plus fréquentes sous anti-TNF-alpha qu’avec les DMARDs conventionnels. Le germe le plus souvent impliqué est le staphylocoque doré (57%) mais des espèces bactériennes moins fréquentes ont également été rapportées : listéria, salmonelles, pseudomonas. Les auteurs, regrettant l’absence d’études observationnelles pour les biothérapies non anti-TNF-alpha passent en revue les essais randomisés. Des réactivations d’hépatite B avec décès ont été observées avec le rituximab, ce qui le contre-indique chez les patients porteurs chroniques du virus. L’analyse des données de sécurité de 8 essais randomisés avec le tocilizumab (à 8 mg/kg) montre un taux d’infections sévères de 4,9 pour 100 patients-années, contre 3,5 pour cent patients-années avec le placebo ou le tocilizumab à faible dose (4 mg/kg). Une étude post-marketing au Japon, conduite chez près de 4.000 patients traités par tolicizumab, faisait ressortir un taux d’infection de 9 pour cent patients-années, dont des tuberculoses, des mycobactéries non tuberculeuses, des herpes. (Novosad SA, Winthrop KL. Beyond tumor necrosis factor inhibition: the expanding pipeline of biologic therapies for inflammatory diseases and their associated infectious sequelae. Clin Infect Dis. 2014;58(11):1587-1598. En accès libre : ici).
S’agissant des biothérapies « non anti-TNF-alpha », l’étude multicentrique française dont les résultats ont été publiés dans le JAMA en septembre 2016 (téléchargeable sur le site de la SFR : ici), n’est pas très encourageante. Cet essai clinique randomisé se proposait de comparer chez 300 patients en échec d’un premier anti-TNF-alpha, la stratégie de recourir à un second anti-TNF-alpha, au traitement par l’une des 3 biothérapies non anti-TNF-alpha (rituximab, tocilizumab ou abatacept). Passons sur le fait qu’il aurait été très pertinent de prévoir un troisième bras avec la trithérapie conventionnelle, et soulignons que cette étude a manifestement été construite pour mettre en évidence une supériorité d’efficacité, somme toute modeste, des non anti-TNF-alpha sur les anti-TNF-alpha (après échec d'un premier). En revanche, dans cet essai, le nombre de patient n’était pas suffisant pour détecter une différence significative sur les événements indésirables sévères. Pourtant, les tendances sont vraiment très défavorables :
Effets indésirables sévères (EIS), décès, cancers | « Non anti-TNF-alpha » | Anti-TNF-alpha |
Au moins 1 EIS | 16/146 (11%) | 8/146 (5%) |
1 EIS | 14/146 (10%) | 4/146 (3%) |
2 EIS | 2/146 (1%) | 3/146 (2%) |
3 EIS | 0/146 (0%) | 1/146 (0,7%) |
Total EIS | 18 | 13 |
Décès | 1/18 (6%) | 0/13 |
Cancer | 1/18 (6%) | 0/13 |
Alors que les complications cardiaques de la PR sont connues, le suivi à 2 ans de l’étude TEAR, montre une amélioration du profil lipidique sous trithérapie conventionnelle, avec une diminution du LDL-cholestérol (« mauvais cholestérol ») et une augmentation du HDL-cholestérol (« bon cholestérol »), par rapport à ce qui est observé dans les groupes traités par méthotrexate seul ou associé à l’étanercept (Accès libre à la publication de mars 2016 : ici)
La triple association de DMARDs conventionnels est extrêmement peu utilisée en France Retour
Le graphique d’évolution des nombres de boites remboursées en ville chaque année (Fichiers MEDIC’AM de l’assurance maladie) montre une légère baisse pour SALAZOPYRINE® depuis 2012 (passé de 248.000 à 228.000 boites en 3 ans) alors que le PLAQUENIL® croit lentement (de 949.000 à 1.065.000 boites) et que l’augmentation plus vigoureuse du méthotrexate (de 3.111.000 à 3.601.000 boites) est due en totalité à la progression des formes injectables promues par NORDIC PHARMA (formes orales stables)
Cliquer sur l’image pour ouvrir la présentation diapositives qui contient ce graphique 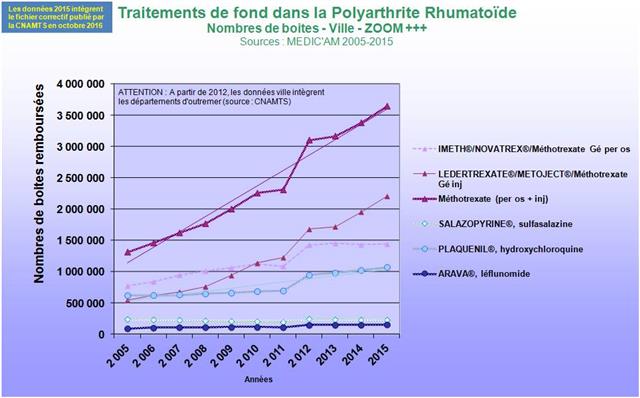
Attention : Le décalage des courbes d’évolution entre 2011 et 2012 est du à l’augmentation du périmètre des données de l’assurance maladie qui intègrent les départements d’outremer depuis 2012… A noter tout le maintien à un très bas niveau de la SALAZOPYRINE®, un médicament beaucoup plus utilisé dans ses indications gastro-entérologiques (maladie de Crohn et rectocolite hémorragique) que dans la polyarthrite rhumatoïde
La trithérapie conventionnelle n’est qu’exceptionnellement prescrite en France
Potentiellement, près de 500.000 patients en affection de longue durée pourraient être concernés par les DMARDs (Disease-modifying antirheumatic drugs) de traitement du fond de la polyarthrite rhumatoïde, puisque nombre d’entre-eux sont indiqués dans deux autres affections de longue durée (ALD). Le graphique ci-dessous présente l’évolution de la prévalence et de l’incidence de 3 ALD, la polyarthrite rhumatoïde (ALD N°22), la spondylarthrite ankylosante grave (ALD N° 27) et la rectocolite hémorragique et maladie de Crohn (ALD N° 24).
Cliquer sur l’image pour ouvrir la présentation diapositives qui contient ce graphique
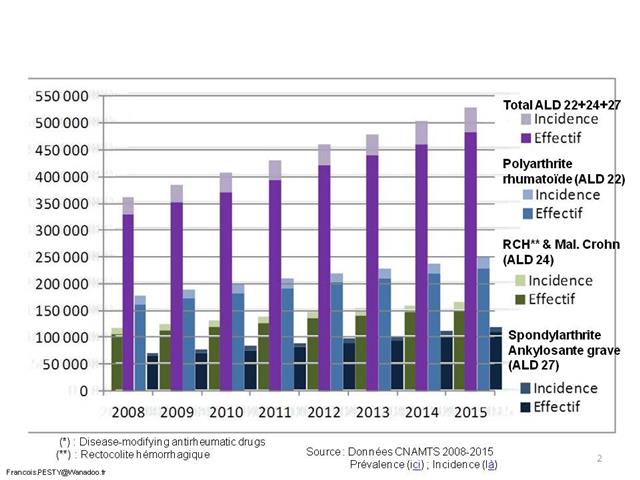
La polyarthrite rhumatoïde (PR) est une pathologie chronique qui touchait en 2015 en France 226.640 patients, pris en charge à 100%, car bénéficiaires de l’ALD N°22, dont 20.510 nouveaux cas
Le méthotrexate en monothérapie demeure le traitement de fond en 1ère ligne et doit être également associé à d’autres DMARDs conventionnels et à toutes les biothérapies, comme l’a rappelé récemment la HAS en attribuant des SMR insuffisants et en émettant un avis défavorable au remboursement pour l’utilisation de plusieurs anti-TNF-alpha chez des patients naïf de méthotrexate (voir les récents avis de la commission de la transparence rendus en juillet 2016 pour l’adalimumab, l’étanercept, et l’infliximab, en novembre 2016 pour le golimumab). Tant et si bien que presque tous les patients souffrant de PR devraient bénéficier de ce traitement.
A partir des données « OPEN MEDIC » récemment libérées par la CNAMTS, l’Institut PUPPEM a pu estimer les nombres de patients chez lesquels une délivrance en officine de ville de DMARDs a été réalisée en 2014 et 2015.
Toutes spécialités médicales confondues :
Cliquer sur l’image pour ouvrir la présentation diapositives qui contient ce graphique
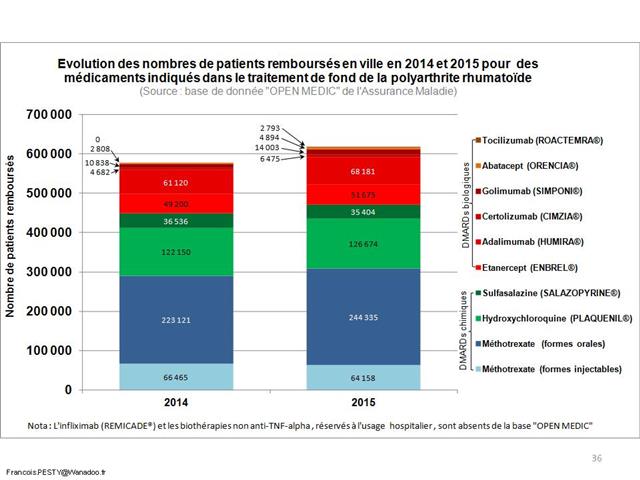
Et par spécialité :
Cliquer sur l’image pour ouvrir la présentation diapositives qui contient ce graphique
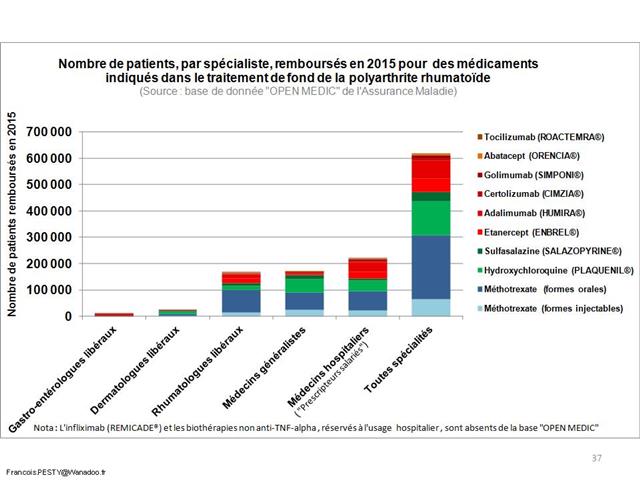
Il est clair que les rhumatologues libéraux sont de bien plus gros prescripteurs de biothérapies que les gastro-entérologues libéraux. Les médecins généralistes sont de petits prescripteurs de ces traitements biologiques. Il n’est pas possible aujourd’hui de détailler le plus gros poste, à savoir les prescriptions hospitalières délivrées en officine de ville, notamment entre les rhumatologues, gastro-entérologues et dermatologues…
La même analyse, exprimée en nombre de boites remboursées :
Evolution 2014-2015, toutes spécialités médicales confondues
Cliquer sur l’image pour ouvrir la présentation diapositives qui contient ce graphique
Nombres de boites de DMARDs remboursées en 2015 par spécialité :
Cliquer sur l’image pour ouvrir la présentation diapositives qui contient ce graphique
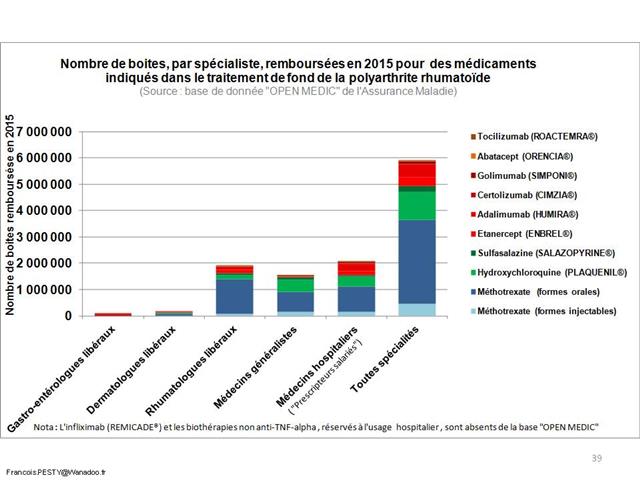
Les graphiques en montants remboursés donnent le vertige !
Evolution des montants 2014 et 2015 :
Cliquer sur l’image pour ouvrir la présentation diapositives qui contient ce graphique
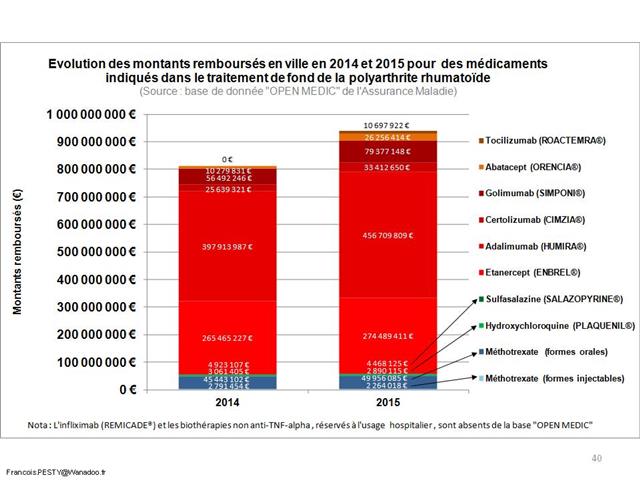
Montants remboursés en 2015 par spécialiste :
Cliquer sur l’image pour ouvrir la présentation diapositives qui contient ce graphique
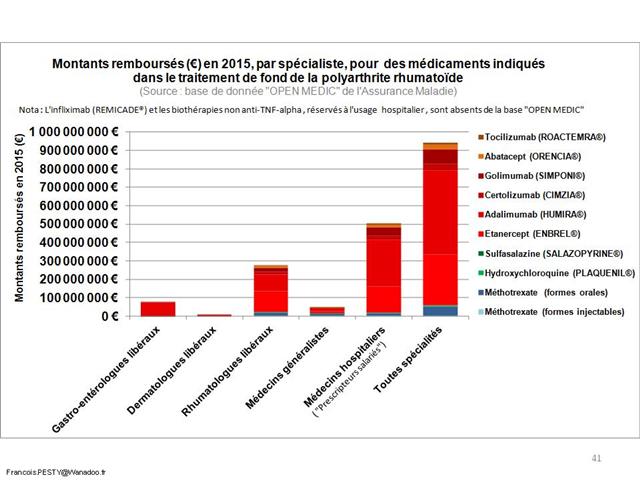
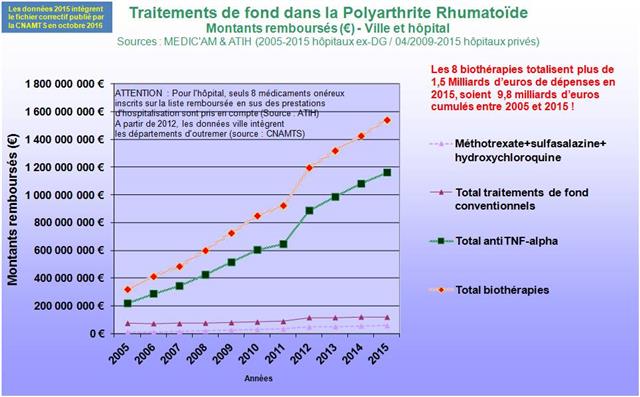
En conclusion, la nécessaire évolution des exigences à remplir pour l’autorisation de mise sur le marché des nouveaux médicaments
Retour
Depuis vingt ans en France, et malheureusement dans bien d’autres pays (mais pas tous), les rhumatologues ont confisqué à leurs patients la meilleure option thérapeutique dans le traitement de fond de la polyarthrite rhumatoïde, préférant satisfaire à leurs intérêts particuliers (ici), et cela au mépris de l’efficience. Ils n’ont pas hésité à exposer leurs patients à des traitements plus fortement immunosuppresseurs, et selon toutes vraisemblances plus fréquemment responsables d’événements indésirables graves.
Pour mieux dissimuler cette inacceptable confiscation, les experts en rhumatologie se faisant ainsi les complices des firmes pharmaceutiques dont ils ont bénéficié de nombreux avantages, ont non seulement occulter dans leur pratique la trithérapie conventionnelle, mais aussi dans leurs recommandations, dont la malfaçon pour la version 2014 est avérée.
Pourtant la supériorité au méthotrexate en monothérapie de cette option thérapeutique est parfaitement établie depuis 1996. Les rhumatologues leaders d’opinion ont également accepté d’être investigateur principal ou co-investigateurs d’essais cliniques sans intérêt, car se comparant au placebo, et même parfois en choisissant des critères de jugement sans signification clinique (Progression radiographique mesurée en nombres de point sur l’échelle de Sharp-Van der Heidje).
La Haute Autorité de Santé, chargée de l’évaluation comparative des médicaments, n’y a vu que du feu. Elle a accordé très généreusement des ASMRs de niveau III (Par exemple, pour REMICADE®, infliximab, Avis de la Commission de la transparence du 8 novembre 2000 : ici)
Au-delà de la tromperie sur leur réel apport thérapeutique, il convient de souligner à nouveau le coût exorbitant de ces biothérapies, près de 10 Milliards d’euros de dépenses cumulées entre 2005 et 2015 !
Comment prévenir ce type de situations qui ne bénéficient finalement qu’aux firmes, ne sont pas spécifiques à la rhumatologie mais touchent de nombreux domaines thérapeutiques et dont les victimes collatérales sont les patients et les assurés sociaux ?
En réalité, ce ne serait pas si compliqué. Il suffirait de changer les règles d’enregistrement des nouveaux médicaments par les agences de régulation. Au législateur donc de mettre en musique les principes suivants :
En 2016, il n’est plus acceptable, ni concevable, d’autoriser de nouveaux médicaments :
- Sans tenir compte des alternatives thérapeutiques déjà existantes sur le marché,
- Sur la seule base d’un rapport bénéfice / risque d’autant plus mal évalué que la procédure d’enregistrement aura été « accélérée », en sachant que celui-ci est voué à se détériorer puisque les événements indésirables rares et graves sont à découvrir lors de l’utilisation sur de plus larges populations…,
- Sur la base d’essais cliniques randomisés versus placebo, ou comparateur non pertinent, alors qu’il existe déjà des comparateurs d’efficacité supérieure au placebo,
- Sur la base de critères intermédiaires de jugement,
Donc, ne pas accorder d’autorisation, si le dossier est vide d’essai randomisé versus meilleur comparateur portant sur un critère pertinent centré sur le patient (survie globale, morbidités, qualité de vie…).
Puis n’accorder un prix plus élevé au nouveau médicament que s’il démontre sa supériorité au meilleur comparateur sur les mêmes critères pertinents
29/06/2015 - Les nouveaux antiviraux dans l’hépatite C chronique, dont le sofosbuvir, pourraient ne pas être aussi bien tolérés qu’ont le dit, selon les chiffres préoccupants relevés dans la base de données ouverte au public, Eudravigilance. « Lettre ouverte » aux autorités de santé européenne (EMA), américaine (FDA) et françaises (ANSM, HAS).
English: Click here to navigate directly to the English version
The new antivirals in chronic hepatitis C, included sofosbuvir, might not be as safe as claimed, according to worrying figures derived from Eudravigilance, a database open to the public. "Open Letter" to the European (EMA), American (FDA), and French (ANSM, HAS), health authorities.
French version
Introduction :
Selon les nombres de décès déclarés par mois et rapportés aux nombres d’événements indésirables graves dans la base de données EudraVigilance ouverte au public, le sofosbuvir et la plupart des nouveaux antiviraux proposés dans l’hépatite C chronique pourraient ne pas être mieux tolérés que les traitements de référence, interféron pégylé et ribavirine.
L’Institut PUPPEM « Pour Une Prescription Plus Efficiente des Médicaments », interpelle les principales autorités de santé en charge de la pharmacovigilance et de l’évaluation du médicament
Méthodologie :
Interrogation de la base de données publique, Eudravigilance, effectuée en juin 2015 portant sur les données de déclaration des suspicions d’effets indésirables graves des médicaments en provenance des pays de l’espace économique européen (EEE) et extérieurs à l’EEE, actualisées à fin mai 2015. Calcul pour deux principes actifs et 11 médicaments de marque des nombres de mois inclus dans la base de données à partir des dates d’autorisation de mise sur le marché publiées sur le site de l’EMA ; Calcul des nombres de décès et des nombres d’événements indésirables graves déclarés par mois (moyennes) ; Calcul du taux de décès rapporté au nombre d’EIG déclarés. Cliquer (ici) pour télécharger l’ensemble des fichiers détaillés par médicament extraits de la base de données Eudravigilance
Résultats :
Même si l'interprétation de ces chiffres doit se faire avec prudence et si il y a beaucoup d'incertitude, avec respectivement 13,8; 13,2 et 13,4 décès rapportés mensuellement dans la base de données de l’Agence Européenne des Médicaments (EMA) pour la ribavirine; l’interféron pégylé et le sofosbuvir, le «premier de la classe» des antiviraux à action directe pourrait ne pas être aussi sûr que le prétendent GILEAD et les leaders d'opinion en hépatologie. Voir le tableau de bord et les graphiques ci-dessous
Cliquer sur l’image ci-dessous pour ouvrir le tableau et les graphiques / Click on the image bellow to download the Dashboard and figures
Figure 1. Nombres moyens de décès déclarés par mois dans Eudravigilance
Figure 2. Nombres d’événements indésirables graves déclarés par mois (moyennes) dans Eudravigilance
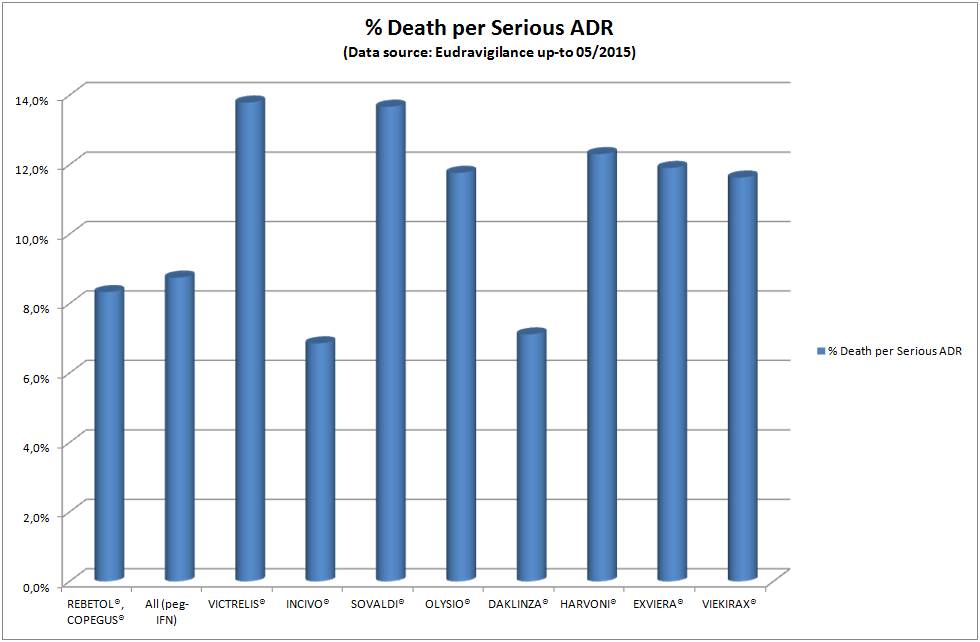
Figure 3. Taux de décès rapporté aux événements indésirables graves déclarés dans Eudravigilance
Il est probable que le taux de décès rapporté au nombre d’événements indésirables graves (EIG) soit un ratio plus précis et pertinent pour comparer les profiles de tolérance des médicaments, car il est indépendant des volumes de prescription et de déclarations des EIG suspectés
Ces ratios calculés à partir d'extractions de la base de données Eudravigilance ne sont pas en faveur des nouveaux médicaments dans l'hépatite C chronique :
- Ribavirine : 8,3%
- Peg-IFN : 8,7%
- SOVALDI®, SOFOSBUVIR : 13,7%
- VICTRELIS®, bocéprévir : 13,8%
- HARVONI®, SOFOSBUVIR + ledipasvir : 12,3%
- EXVIERA®, dasbuvir : 11,9%
- OLYSIO®, simeprevir : 11,8%
- VIEKIRAX®, Ombitasvir + paritaprevir + ritonavir : 11,6%
Paradoxalement, le télaprévir, un médicament retiré par JANSSEN, semble avoir un profil moins dangereux que le simeprevir, un médicament nouvellement commercialisé par la même société ...
Discussion / Conclusion
Après avoir montré qu’en France l’absence de gestion des conflits d’intérêts des hépatologues impliqués dans l’élaboration d’un rapport ministériel de recommandations portant sur les hépatites B et C, a entraîné l’Etat français à définir une cible de patients à traiter probablement trop large et à surestimer grandement le bénéfice procuré aux patients par le sofosbuvir (ici), les données extraites d’Eudravigilanve suggèrent également une importante surestimation de la tolérance des nouveaux Antiviraux à Action Directe.
Selon une revue générale « le dépistage étendu de l’hépatite C est-il justifié ? » publiée dans le BMJ en janvier 2015 1, 2 (téléchargeable ici), et provenant de chercheurs dépourvus de liens d’intérêts, il s’avère que :
- L’efficacité du sofosbuvir et des autres antiviraux à action directe, se base principalement sur des études aux faibles effectifs et de courte durée, uniquement sur un critère intermédiaire, la réponse virologique soutenue, plutôt que sur des critères cliniques,
- Le risque d’évoluer vers un stade terminal de la maladie hépatique est faible pendant les 30 premières années qui suivent l’infection par le virus de l’hépatite C
- Il est vraisemblable que 80 à 85% des patients porteurs chroniques du virus de l’hépatite C mourront d’une cause extra-hépatique et ne bénéficieront ni du dépistage ni du traitement,
- Dans la mesure où la plupart des patients inclus dans les essais cliniques n’évolueront pas jusqu’au stade terminal de la maladie hépatique, l’efficacité des traitements, y compris l’interféron pégylé associé ou non à la ribavirine, n’est pas prouvé,
- La disparition du virus du sérum pourrait n’être qu’un marqueur chez les patients moins susceptibles de progresser même en l’absence de tout traitement,
- La réponse virologique soutenue n’est pas synonyme de guérison, l’ARN viral ayant été retrouvé dans des tissus chez des patients dont le sérum est débarrassé du virus, et par ailleurs le même virus peut réapparaître après avoir été indétectable,
Les auteurs de cette revue rappellent également que dans la seule étude comparative disponible pour le sofosbuvir + ribavirine versus interféron pégylé + ribavirine, FISSION, 7 patients avaient subi un événement indésirable grave sous sofosbuvir contre seulement 3 sous interféron pégylé (sans différence significative), alors que cet essai n’avait pas été dimensionné pour comparer les effets indésirables sévères.
Tableau1 - En annexes des résultats de l’étude FISSION
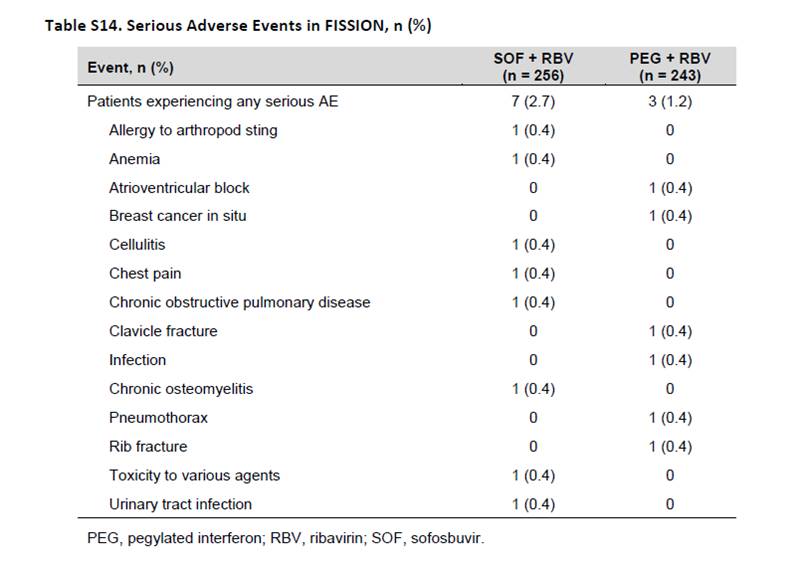
Télécharger les résultats de l’étude FISSION (ici) et les documents annexés (ici)
Le tableau ci-dessous, extrait de la version anglaise de l’avis de la commission de la transparence sur le sofosbuvir en date du 14 Mai 2014 (téléchargeable ici), permet d’observer une fréquence plus importante d’EIG dans les groupes de patients traités par sofosbuvir, dans 4 des 5 essais thérapeutiques (dont FISSION), examinés par la commission de la transparence.
Tableau 2 - Extrait de la version anglaise de l’avis de la commission de la transparence sur SOVALDI®
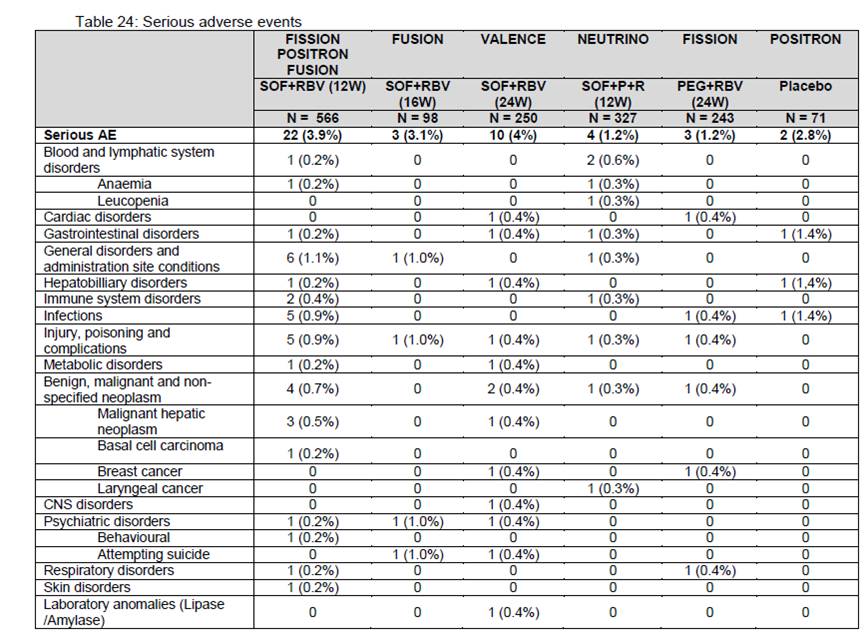
Il serait donc fort utile que les autorités de santé en charge d’assurer le suivi des médicaments après leur mise sur le marché, en France, en Europe et aux USA, examinent ces chiffres pour le moins préoccupants et prennent position afin de préciser dans « la vraie vie » quel est le profil de sécurité du sofosbuvir et des autres antiviraux à action directe, et que le cas échéant, elles redéfinissent le rapport bénéfice / risque et le « progrès thérapeutique » de ces médicaments aux prix exorbitants.
En France, il serait probablement opportun de prévoir un plan de gestion du risque (PGR) pour ces médicaments (ANSM), ainsi que des études cliniques post-AMM permettant d’apprécier comparativement au traitement de référence (interféron pégylé + ribavirine), l’efficacité et la tolérance réelles de ces nouveaux traitements.
L’EMA devrait aussi améliorer très sensiblement l’accès aux données et élargir les possibilités d’interrogation de la base Eudravigilance ouverte au public. Il est en effet déconcertant d’observer que des données aussi essentielles que les consommations des médicaments exprimées en nombres de patients, de boites ou d’unités sont manquantes et que cette absence limite considérablement l’intérêt de conduire des analyses à partir de cette base. L’impossibilité d’interroger la base sur une période de temps donnée, l’absence d’information complète sur le contenu d’Eudravigilance sont des lacunes qu’il conviendrait de combler rapidement.
[1] R. KORETZ, K. LIN, J. LOANNIDIS, J. LENZER. Is widespread screening for hepatitis C justified? BMJ 2015;350:g7809 doi: 10.1136/bmj.g7809 (Published 13 January 2015)
[2] F. GODLEE. Think hard before expanding cancer screening. Editor’s Choice. BMJ 2015;350:h226 doi: 10.1136/bmj.h226 (Published 14 January 2015)
English version
Introduction:
According to the numbers of deaths reported monthly and according to the rate of death per serious adverse events reported in EudraVigilance, a public database, sofosbuvir and most of new antivirals proposed in chronic hepatitis C might not be better tolerated than reference treatment, pegylated interferon and ribavirin.
The Institute PUPPEM "For A More Efficient Prescribing of Medicines", requests the main health authorities in charge of pharmacovigilance and drug evaluation to clarify these important safety and efficiency issues
Methodology:
Our search in the public database, Eudravigilance, was conducted during June 2015 considering reported data for suspected serious adverse drug reactions from countries belonging to the European Economic Area (EEA) and outside the EEA. We calculated for two active substances and 11 brand name drugs the duration in months in the database from the marketing authorization dates published on the EMA website, or from December 2001 (launching of the first operating version of the database, for medicines authorized before) to May 2015 (last up-date) ; Also, the numbers of deaths and numbers of serious adverse events reported per month (average), as well as the death rates per reported Serious Adverse Drug Reactions (ADR) were derived from the database extractions. Click (here) to download the set of detailed working files extracted from Eudravigilance database (one for each studied medicine)
Results:
Even if the interpretation of these figures must be cautious and if there is a lot of uncertainty, with respectively 13,8 ; 13,2 and 13,4 deaths reported monthly in the European Medicines Agency database for ribavirin ; peg-IFN and sofosbuvir, the “first in class” direct-acting antiviral might not be as safe as claimed by GILEAD and the key opinion leaders in hepatology. See above the dashboard and figures, and also the extracted files from Eudravigilance (here)
Average numbers of deaths reported monthly in Eudravigilance database (see above “figure 1”)
Mean numbers of serious adverse events reported monthly in Eudravigilance (see above “figure 2”)
Death rates per reported Serious Adverse Drug Reactions (ADR) in Eudravigilance (see above “figure 3”)
Maybe, the percent death per serious adverse drug reaction is a more accurate ratio with higher value for safety profile comparative purposes. This ratio is independent of prescribing volumes and ADR reporting volumes, but probably dependent of threshold of reporting serious adverse events...
These ratios derived from extractions in Eudravigilance database don’t favour the new medicines in chronic hepatitis C:
- ribavirin: 8.3%
- peg-IFN: 8.7%
- SOVALDI®, sofosbuvir: 13.7%
- VICTRELIS®, boceprevir: 13.8%
- HARVONI®, sofosbuvir + ledipasvir: 12.3%
- EXVIERA®, dasbuvir: 11.9%
- OLYSIO®, simeprevir: 11.8%
- VIEKIRAX®, Ombitasvir + paritaprevir + ritonavir: 11.6%
Paradoxically, telaprevir, a drug withdrawn by JANSSEN, seems to have a less dangerous profile than simeprevir, the newly marketed drug by the same company…
Discussion / Conclusion:
After showing that in France the lack of management of conflicts of interest of more than thifty hepatologists involved in the writing of a French Health Care Ministry report on recommendations for hepatitis B and C, led the French government to set a target to treat patients probably too broad and to greatly overestimate the benefit provided to patients by sofosbuvir (here), data extracted from Eudravigilanve also suggest a significant overestimation of the tolerance of the new Direct-Acting Antivirals.
According to a general review "Is widespread screening for hepatitis C justified?", published in the BMJ in January 2015 1, 2 (downloadable here), written by independent researchers, it appears that:
- “Claims for effectiveness are based mainly on small, short term trials that use surrogate rather than clinical outcomes",
- “The risk of developing end stage liver disease is low for the first three decades of infection",
- “It is likely that 80-85% of patients with chronic hepatitis C will die from non-hepatic causes, exposing them to the harms of treatment with no possible benefit",
- “The ability of therapy to reduce the incidence of end stage liver disease is unproved",
- “Patients who achieve sustained response are less likely to have the risk factors associated with disease progression and it may be simply a marker of those who were less likely to progress even without treatment",
- “Sustained virological response is not a cure. Viral RNA is sometimes found in body tissues even when the serum is clear and the virus also reappears in some patients with sustained response, with at least sometimes the reappearance of the same virus",
The authors of this review also warn that in the only comparative study available for sofosbuvir + ribavirin versus pegylated interferon + ribavirin, FISSION, 7 patients had a serious adverse event in the sofosbuvir group against only 3 under pegylated interferon (no significant difference), although this trial was not sized to compare severe adverse effects.
Table in the appendix material of the results for FISSION study (See above “Tableau 1”)
Download the results of FISSION study (here) and the appendix material (here)
The table (See above “Tableau 2”) is extracted from the English version of the French Transparency Committee Opinion on SOVADI®, published on the 14th May of 2014 (downloadable here), and shows a tendency to greater incidence of Serious Adverse Drug Events in patients groups treated with sofosbuvir in 4 out of 5 clinical trials (FISSION included) the committee took into account.
Therefore, it would be useful that health authorities in charge of monitoring drugs after marketing, in France, in Europe and the US, consider these worrying figures and take position in order to clarify in the "real life "what are the safety profile and the efficiency of sofosbuvir and other direct-acting antivirals, and that if necessary, redefine the benefit / risk and "therapeutic progress" of these medicines sold at exorbitant prices.
In France, it would probably be appropriate to provide a risk management plan (PGR) for these drugs (ANSM), as well as post-marketing clinical studies to assess comparatively to the reference treatment (Pegylated Interferon + ribavirin), the efficiency and real tolerance of these new treatments.
EMA should also improve significantly the access to data and expand modalities for querying the Eudravigilance database open to the public. It is indeed disconcerting that such key data as the consumption of drugs expressed in numbers of patients, boxes or units doses, are missing and that this lack considerably limits the interest of conducting analyzes from this base. Impossibility to query the database for a given period of time, the lack of comprehensive information on the content of Eudravigilance are gaps that should be filled quickly.
[1] R. KORETZ, K. LIN, J. LOANNIDIS, J. LENZER. Is widespread screening for hepatitis C justified? BMJ 2015;350:g7809 doi: 10.1136/bmj.g7809 (Published 13 January 2015)
[2] F. GODLEE. Think hard before expanding cancer screening. Editor’s Choice. BMJ 2015;350:h226 doi: 10.1136/bmj.h226 (Published 14 January 2015)
30/12/2014 - La transparence nécessaire des données de santé : Le Colloque MTRL d’octobre 2014 s’invite au débat sur l’open data et devrait inspirer le législateur afin qu’il enrichisse la future Loi de Santé
Le 4 octobre 2014 avait lieu à Lyon le 4ème Colloque d’économie de la santé organisé par la MTRL et l’association Charles-Gide. Le numéro de décembre de la revue de la mutuelle lui ouvre la moitié de ses 40 pages et les vidéos intégrales du colloque sont en ligne depuis le 17 décembre.
L’Institut PUPPEM « Pour Une Prescription Plus Efficiente du Médicament » est heureux de contribuer à la diffusion des actes de ce colloque articulé en deux parties :
1ère partie « L’opacité des pouvoirs publics vise à maintenir l’illusion que la santé des français est gérée avec rigueur et discernement ». Pr. Didier SICARD, Professeur de Médecine, Président d’honneur du Comité consultatif national d’éthique, Président du Comité d’experts de l’Institut des Données de Santé.
2ème partie « L’utilité de l’ouverture des données de santé pour juger de la qualité des politiques du médicament ». François PESTY, Pharmacien, Expert-Conseil en médicaments.
Autour des deux intervenants, une table ronde réunissait les participants :
- Patrick Guérin, Docteur vétérinaire, Président de Celtipharm
- Thomas Laurenceau, Rédacteur en Chef de 60 Millions de consommateurs
- Jean Matouk, Professeur honoraire de sciences économiques
- Jean-Louis Touraine, Professeur d’immunologie, Député de Lyon
- François Blanchardon, Président du Collectif interassociatif sur la santé Rhône-Alpes
La vidéo d’interviews flash des participants à la sortie du colloque, postée sur Dailymotion (10 min)
Une courte vidéo (3 min) présentant des extraits d’intervention de chaque participant à la table ronde
La vidéo intégrale de la première partie du colloque (1 h 31)
La vidéo intégrale de la seconde partie du colloque (1 h 40)
La présentation diapositives sonorisée de l’intervention de François PESTY :
« L’utilité de l’ouverture des données de santé pour juger de la qualité des politiques du médicament »
Cliquer sur l’image ci-dessous pour lancer le diaporama (51 minutes, défilement automatique des diapositives synchronisées sur la bande son) 
Le texte de la première partie du colloque et les échanges publiés dans la revue « Mutuelle et Santé » : ici (16 pages) ;
Les temps forts de l’intervention de François PESTY en seconde partie du colloque, publiés dans la revue « Mutuelle et Santé » : ici (4 pages)
La transcription intégrale des actes du colloque, « remasterisée » par Christian CHARRON : ici (49 pages)
Le N°84 publié en décembre 2014 de la revue « Mutuelle et Santé » est téléchargeable dans son intégralité sur le site de la MTRL : ici (40 pages)
29/10/2014 - La Ministre et les députés pensaient peut être que les médicaments onéreux de la « liste en sus » représentaient un fort enjeu stratégique pour nos fleurons industriels du médicament…
L’article 44 du PLFSS 2015 a traversé sans trop d’encombre son examen devant la commission des affaires sociales le 15 octobre (10 min de vidéo entre 1:57:42 et 2:07:41 de l’enregistrement ici), puis en plénière dans l’hémicycle de l’assemblée nationale le 24 octobre (21 min vidéo entre 2:18:59 et 2:40:10 de l’enregistrement ici).
Si l’ambition du dispositif reste aussi microscopique (15 millions d’économies en 2015 sur 2,8 milliards de dépenses soit moins de 0,5%), si son mécanisme demeure d’une telle complexité que plusieurs députés (de tous bords) ont avoué n’y rien comprendre, s’il est en réalité si peu incitatif et qu'il sera quasiment impossible à mettre en œuvre, ce doit être pour une bonne raison :
Et si la Ministre et nos députés redoutaient un effet délétère sur nos entreprises nationales du médicament, en ces temps où il est si mal vu de remettre en cause le fameux « pacte de responsabilité ».
Pour y répondre, nous vous livrons une analyse inédite. Quels sont les laboratoires et les pays qui tirent leur épingle du jeu sur la liste en sus ?
L’Institut PUPPEM « Pour une Prescription Plus Efficiente du Médicament » a donc fait tourner ses ordinateurs sur les données gracieusement transmises par l’ATIH (Agence Techniques de l’Information sur l’Hospitalisation).
Classement des dépenses 2013 de la liste en sus regroupées par laboratoire
Cliquer sur l’image ci-dessous pour télécharger le fichier Excel 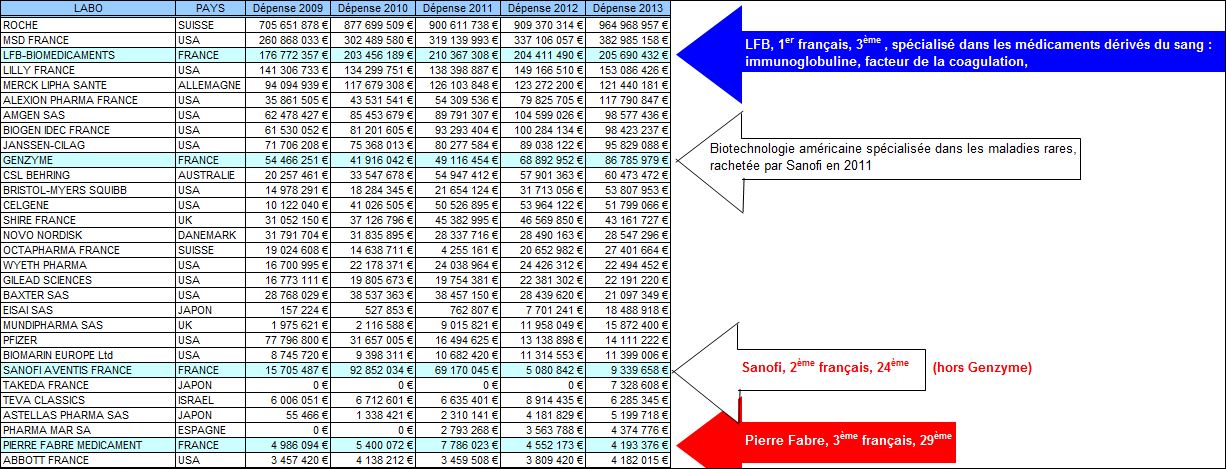
1er laboratoire français en 2013, le LFB, acronyme pour « Laboratoire français du fractionnement et des biotechnologies », est un établissement pharmaceutique public créé en 1993 par la Loi relative à la sécurité en matière de transfusion sanguine et de médicament (dans les suites de l’affaire du sang contaminé), transformée en 2006 en société anonyme dont les actions sont détenues à 100% par l’Etat français (source : Wikipedia ici). En contrepartie d’une seule obligation, fournir prioritairement les hôpitaux français, il dispose de l’exclusivité du fractionnement du plasma français collecté sur le territoire national par l’Etablissement Français du Sang (EFS).
2ème laboratoire français, Genzyme est une biotech américaine rachetée en 2011 par Sanofi, hautement spécialisée dans les maladies rares. Le caractère innovant de ses spécialités paraît donc difficilement contestable, et par définition l’absence d’économie d’échelle justifie pleinement leur caractère très onéreux.
Sanofi Aventis, le champion tricolore, arrive en 24ème position avec guère plus de 9 millions d’euros de dépenses en 2013. Une misère. Puis vient Pierre Fabre Médicaments (29ème) avec à peine 4 millions d’euros.
Classement des dépenses 2013 de la liste en sus regroupées par pays
Cliquer sur l’image ci-dessous pour télécharger le fichier Excel
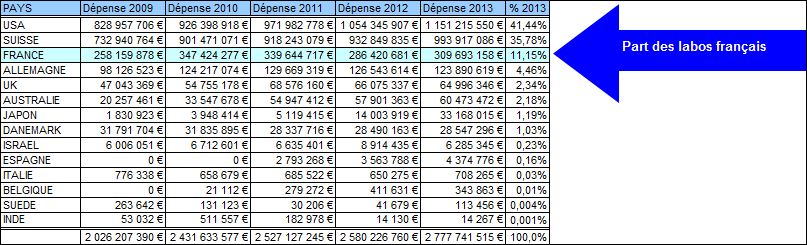
Constat : Les USA et la Suisse totalisent 77% des dépenses de médicaments inscrits sur la liste en 2013. La France seulement 11%...
Les interventions de deux courageux députés sont à saluer et méritent d’être méditées au Sénat qui va à son tour examiner le texte à partir du 5 novembre.
Cliquer sur l’image, l’intervention de Gérard BAPT débute à 2:28:14 de l’enregistrement vidéo
Le Député Gérard BAPT, Cardiologue et Rapporteur pour les recettes et l’équilibre général du PLFSS 2015, a notamment déclaré « Je vous avais écrit Madame la Ministre il y a deux ans la dessus en insistant à ce que des produits qui n’ont aucune valeur ajoutée par rapport à d’autres produits qui sont à la T2A soient retirés de cette liste »
Cliquer sur l’image, l’intervention de Jean-Louis ROUMEGAS débute à 2:29:55 de l’enregistrement vidéo
Le Député Jean-Louis ROUMEGAS, défendant un amendement visant à insérer un article additionnel après l’article 44, propose de « retirer de la liste en sus les médicaments qui seraient inscrits en ASMR V ou IV, donc qui n’ont pas d’amélioration du service médical rendu, ce qui est effectivement une anomalie, puisqu’on les retrouve dans cette liste »
Le Sénat pourra-t-il (voudra-t-il) améliorer le texte ?
A suivre ...
08/10/2014 - Article 44 du PLFSS 2015 : Quand la technocratie à la française vole au secours des firmes. Comment faire compliqué quand on peut faire simple : Une usine à gaz qui ne servira qu’à ponctionner encore et encore le contribuable pour régler la note salée des fausses innovations thérapeutiques…
Le PLFSS 2015, présenté en conseil des ministres ce mercredi 8 octobre, avait circulé sous le manteau la semaine passée, avec une version contenant 66 articles, téléchargeable sur le site « Liaison sociales » : ici.

Photo AFP
Les bonnes intentions extraites du dossier de presse présenté par Marisol TOURAINE, Ministre en charge de la santé, avec ses collègues de Bercy, le 29 septembre 2014 1 pouvaient paraître sincères :
« Les établissements de santé contribueront aux économies par l’optimisation de leurs dépenses, à niveau de qualité identique. Plusieurs actions seront conduites en ce sens, qui ne relèvent pas toutes du PLFSS pour 2015 2… »
Notamment, peut-on lire plus loin :
« Une gestion dynamique et pertinente de la liste « en sus », c'est-à-dire les produits de santé qui du fait de leur coût donnent lieu à un remboursement intégral aux établissements de santé par l’assurance maladie. Ces dépenses se situent à un niveau très élevé (4,4 milliards en 2013, dont 2,8 milliards pour les médicaments) et sont très dynamiques ».
Effectivement !
Cliquer sur l’image ci-dessous pour télécharger les diapositives
Données mises gracieusement à la disposition du consultant par l’ATIH
« Leur maîtrise reposera sur des actions sur les prix ainsi que sur le périmètre de la liste en sus, afin de contenir les dépenses hospitalières.
En outre, dans le cadre du PLFSS, les établissements de santé seront incités financièrement au bon usage de la prescription des produits sur la liste en sus : est donc créé un outil tarifaire, dont l’effet sera globalement neutre pour les établissements de santé, mais qui avantagera les établissements ayant une prescription modérée de ces produits »
C’est cet « outil tarifaire », nouvelle curiosité de la maîtrise (comptable) médicalisée dont nous avons le secret en France 3, que nous allons passer à la loupe de « puppem 4 ».
Hélas, la satisfaction de voir enfin se profiler des économies substantielles à réaliser sur les nombreuses fausses innovations coûteuses de la liste en sus 5-10 fut immédiatement douchée par la lecture d’un tableau ci-dessous, publié le jour même par le Quotidien du Médecin 11.
Cliquer sur l’image ci-dessous pour télécharger les diapositives
Selon le Quotidien du Médecin 11 du 29/09/2014
Examinons à présent cet article 44 du projet de Loi, en commençant par l’exposé des motifs et essayons de comprendre, mais peut être faudrait-il que nous soyons ENArque ou polytechnicien…
En bleu, le texte du projet de loi, en noir nos commentaires :
« Exposé des motifs
Les produits de santé inscrits sur la liste mentionnée à l’article L. 162-22-7 (liste en sus) peuvent donner lieu à des pratiques de prescription très hétérogènes, traduisant de fortes disparités dans le bon usage et la pertinence des prescriptions, bien que les pouvoirs publics aient mis en place et poursuivent des actions sur la promotion et la diffusion du bon usage du médicament ».
Nous aimerions bien savoir lesquelles ? (« actions sur la promotion et la diffusion du bon usage du médicament »)
Dans ce domaine, il aurait pu y avoir « la carotte » :
- Visites itératives en face à face des délégués de l’assurance maladie et/ou de praticiens conseils auprès des médecins prescripteurs hospitaliers ?
- Supports décisionnels intégrés aux logiciels de prescription à l’hôpital ?
et « le bâton » :
- Ciblage des établissements, contrôle des prescriptions hors référentiels, plan d’actions, récupération d’indus
Il n’y a même pas eu le bâton…
Un graphique et un tableau suffiront à mesurer la forte implication des pouvoirs publics dans ce domaine :
Etablissements ciblés, contrôlés sur leurs prescriptions de médicaments de la liste en sus et ayant fait l’objet d’un plan d’actions
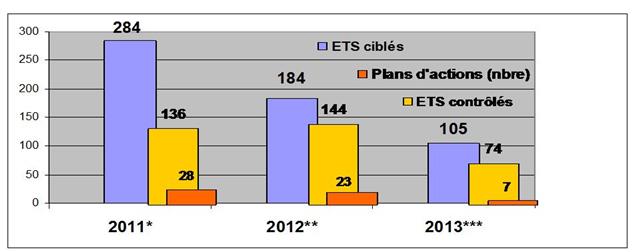
Cliquer sur l'image ci-dessus pour télécharger les diapositives.
| 2011* | 2012** | 2013*** |
ETS ciblés | 284 | 184 | 105 |
ETS contrôlés | 136 | 144 | 74 |
Dossiers patients contrôlés | 3 481 | 2 856 | ND |
Plans d'actions (nbre) | 28 | 23 | 7 |
Plans d'actions (regions) | 8 | 10 | 2 |
Récupération d'indus | 0 | 1 | ND |
Sources :
(*) Circulaire DSS/1C/DGOS/PF2 no 2011-448 du 1er décembre 2011 relative à la mise en œuvre du dispositif de régulation des dépenses des produits de santé des listes en sus/actions locales à conduire en 2011 et 2012
(**) Circulaire DSS/DGOS du 31 janvier 2013 relative à la maîtrise des dépenses (listes en sus / actions locales pour 2013)
(***) Circulaire DSS/DGOS du 9 avril 2014 relative à la mise en œuvre en 2014 de la maîtrise des dépenses et du CBUM
Dans des conditions aussi laxistes, nous comprenons mieux pourquoi le taux national d’évolution fixé pour la liste en sus chaque année par arrêté ministériel, a baissé années après années, pour finalement disparaitre en 2014.
Cliquer sur l’image ci-dessous pour télécharger les diapositives
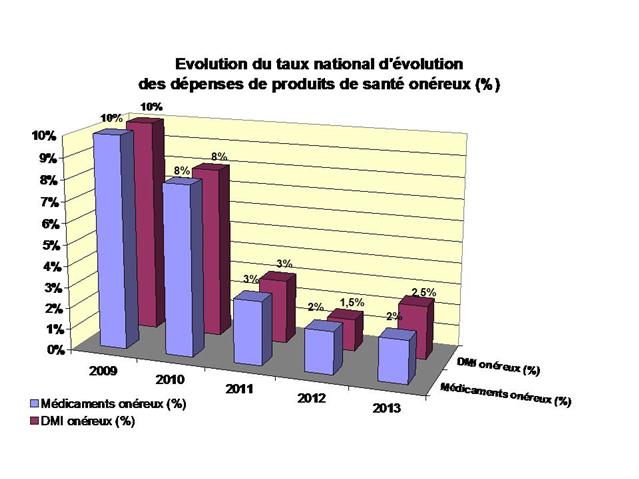
« Or les dépenses des produits de santé inscrits sur la liste en sus demeurent à un niveau très élevé et croissent de manière très dynamique ».
C’est un euphémisme que de le dire !
« Par ailleurs, il a également été constaté que des spécialités de la liste en sus prescrites en dehors des indications de leur autorisation de mise sur le marché (AMM), donc en dehors du périmètre remboursable, sont facturées et indûment prises en charge sur cette liste en sus, notamment lorsque la mention obligatoire « hors AMM » est omise lors de la prescription.
Le gouvernement feint encore de pas avoir compris que le hors AMM est la partie immergée de l’iceberg et qu’un gisement bien plus important d’économies sans perte de chance pour les patients se situe au contraire sur les indications AMM avec progrès nul ou mineur !!!
« Afin de garantir que cette liste répond bien à son objet, c’est-à-dire permettre aux patients dont l’état le nécessite le recours à de réelles innovations, et afin de s’assurer du bon usage de ces produits, il convient aujourd’hui de mobiliser l’outil tarifaire pour inciter au respect des bonnes pratiques et à la pertinence des prescriptions, en créant une incitation financière positive à la prescription des alternatives thérapeutiques prises en charge dans les tarifs d’hospitalisation dès lors qu’elles ne sont pas moins efficaces ».
Il est donc créé une incitation financière positive à la prescription en dehors de la liste en sus ! Le paragraphe suivant va nous expliquer comment. Mais ne serait-il pas plus efficace tout simplement de radier les médicaments de la liste en sus dans leurs indications non innovantes (absence de progrès ou progrès mineur) ?
À cette fin, il est créé un forfait à la charge des établissements de santé pour les prescriptions dans la liste en sus d’un certain nombre de spécialités. Le rendement global de ce forfait étant réintégré dans les tarifs, la mesure est neutre pour les établissements ayant une pratique moyenne de prescription, positive pour ceux qui recourent moins à la liste en sus, et se traduit par un surcoût pour les établissements qui prescrivent plus que la moyenne dans la liste en sus. Mécaniquement, une augmentation des prescriptions dans les produits pris en charge dans les tarifs d’hospitalisation devrait en outre se traduire par une diminution des prescriptions de produits de la liste en sus, pris en charge à tort, car hors AMM.
Avez-vous compris quelque chose ? Pas facile ! Et puis, cela soulève nombre de questions :
- L’enveloppe globale (« Dotation globale des hôpitaux publics avant la T2A) serait-elle de retour pour les médicaments onéreux ?
- Comment pondérer selon les médicaments concernés par le dispositif ? Entre les différentes indications d’un même médicament ? Selon l’activité des établissements ? (CHU/CHR, CH, CRLCC),
- Et surtout comment contrôler que la prescription de tel médicament moins coûteux, inclus dans les GHS, a été faite à la place d’un médicament de la liste ? En effet, seuls pour l’instant les médicaments de la liste en sus sont tracés dans le PMSI ! Pour pouvoir tracer dans la PMSI les médicaments inclus dans les GHS, beaucoup plus nombreux et représentant 55% des dépenses de médicaments à l’hôpital, l’idéal serait de lire un code barres avant leur administration, ce qui permettrait de développer la comptabilité analytique hospitalière et d’intégrer le médicament dans la FIDES (facturation individuelles des établissements de santé), tout en renforçant fortement la sécurité des patients 12.
Prenons deux ou trois exemples, pour bien fixer les idées :
AVASTIN®, bévacizumab, Laboratoires ROCHE (Suisse), premier anticancéreux de la liste en sus avec 393 millions d’euros en 2013 (données gracieusement fournies au consultant par l’ATIH). La commission de la transparence a évalué le progrès thérapeutique apporté par cette molécule, dans 5 indications AMM : Absence d’amélioration dans les cancers du poumon et du sein, progrès mineur dans les cancers du colon, du rein et de l’ovaire. Comment pourrait-on définir la part de prescription efficiente dans chacune des 5 indications AMM ? Comment l'ARS pourra-t-elle vérifier que l’oxaliplatine ou la capécitabine ou encore le raltitrexed, des médicaments moins onéreux inclus dans les GHS, auront été prescrits dans le cancer colorectal à la place de l’AVASTIN® si cela n’est pas tracé dans le PMSI ? Ne serait-il pas plus simple et sage de radier l’AVASTIN® de la liste ?
REMICADE®, infliximab, anti-TNF-alpha des laboratoires MSD (USA, exploitant de l’AMM, anciennement SCHERING PLOUGH) indiqué notamment dans le traitement de fond de la polyarthrite rhumatoïde, 303 millions d’euros en 2013. Comment prouver à l’ARS que l’association méthotrexate + sulfasalazine + hydroxychloroquine qui s’est avérée non inférieure à l’association infliximab + méthotrexate dans plusieurs essais randomisés récents a bien été prescrite à la place de l’anti-TNF-alpha ? Les médicaments conventionnels qui peuvent permettre une économie sans perte de chance pouvant aller jusqu’à 12.000 euros par patient (voir le dossier sur ce site : ici) et par an, ne sont pas actuellement tracés dans le PMSI… N’est-il pas plus simple et sage de ne plus rembourser REMICADE® en sus des prestations d’hospitalisation dans l’indication « traitement de fond de la PR » ?
ALIMTA®, pemetrexed, Laboratoire LILLY (USA), 153 millions d’euros en 2013, possède 3 indications AMM, le mésothéliome pleural (cancer de l’amiante) pour lequel ce médicament apporte un progrès modéré (ASMR III) pour une population estimée de 871 patients par an (Avis de la commission de la transparence du 30/05/2005), en « 1ère et 2ème lignes de cancer du poumon non à petites cellules localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde » ou le progrès est nul (avis de la commission de la transparence en date du 26/11/2008) par rapport au GEMZAR® et au TAXOTÈRE®, génériqués, beaucoup moins coûteux et radiés de la liste voici plusieurs années ; La population cible estimée par la HAS dans cette indication sans progrès thérapeutique est de 17.000 patients par an… Enfin, l’amélioration du service médicale rendu est mineure dans la dernière indication obtenue en « maintenance » dans le cancer bronchique, soient 2.700 à 4.400 de plus (avis HAS du 05/05/2010). Mêmes questions, mêmes remarques que pour AVASTIN® et REMICADE®. Comment l’ARS pourra-telle s’assurer que le paclitaxel (30€ environ la séance de chimiothérapie), radié de la liste en 2006, aura été préféré à l’ALIMTA® (environ 2.000 € par séance, soit 70 fois plus onéreux pour un progrès thérapeutique nul), en nièmes lignes de traitement d’un cancer bronchique métastasé terminal, dans les quinze derniers jours de fin de vie d’un patient, si le paclitaxel n’est pas tracé dans le PMSI ?
Article 44
I. - Après l’article L. 162-22-7-1 du code de la sécurité sociale, il est inséré un article L. 162-22-7-2 ainsi rédigé :
« Art. L. 162-22-7-2. - Lorsqu’une spécialité pharmaceutique mentionnée à l’article L. 162-22-7 est facturée en sus d’une prestation d’hospitalisation visée au 1° de l’article L. 162-22-6, le tarif national applicable à cette prestation est minoré d’un montant forfaitaire fixé par arrêté des ministres chargés de la santé et de la sécurité sociale. Le montant de la minoration ne peut en aucun cas être facturé aux patients ».
Le montant des minorations devront encore être définis par des arrêtés à venir…
« La minoration s’applique aux prestations définies par arrêté, pour lesquelles la fréquence de prescription des spécialités de la liste mentionnée à l’article L. 162-22-7 est au moins égale à 25 % de l’activité afférente à ces prestations et qui représentent au moins 15 % des dépenses totales afférentes aux spécialités inscrites sur la liste précitée. »
Si vous avez compris quelque chose, merci de me passer un petit coup de fil pour éclairer ma lanterne…
II. - Les dispositions du présent article s’appliquent à compter du 1er mars 2015 ».
Effectivement, il faudra bien 6 mois pour mettre tout ça en musique et construire un système pertinent et équitable à défaut d’être lisible de tous !
Pour Conclure :
Une usine à gaz de plus, alors que pour faire des économies considérables sans perte de chance pour les patients, il suffirait simplement d’appliquer à la lettre la recommandation 2010-25 du Conseil de l’Hospitalisation, dont nous allons en octobre fêter le 4ème anniversaire. Ce qu’aucun ministre n’a osé faire jusqu’à présent. Il s’agit juste de radier de la liste en sus les fausses innovations dont elle regorge, pour in fine ne plus rembourser en dehors de la T2A que les seuls médicaments qui apportent un progrès majeur, important ou modeste (vraies innovations). La LFSS 2014 avait créé les conditions d’une gestion de la liste en sus « indication par indication », il ne manque plus qu’un peu de courage à la Ministre pour procéder au toilettage qui s’impose…
François PESTY
Dernière minute : Pire que tout ce que l’on pouvait imaginer. L’Assemblée nationale vient de mettre en ligne sur son site le PLFSS 2015 (ici) avec un texte explicatif un peu étoffé et surtout une estimation de l’impact d’économies prévues. Edifiant ! Mes commentaires directement sur l’article 44 à télécharger ci-dessous.
Cliquer sur l’image pour télécharger l’article 44 du PLFSS 2015 annoté par François PESTY

[1] PLFSS 2015 - Dossier de Presse ; Chapitre 6, « Améliorer l'efficience de la dépense des hôpitaux ». Accès vérifié le 08/10/2014 : ici.
[2] Ce bout de phrase, laisse augurer d’autres leviers de maîtrise des dépenses non portés par la future Loi de financement de la sécurité sociale…
[3] Pour celles et ceux qui auraient davantage de temps à consacrer aux dispositifs labyrinthiques du PLFSS 2015, ne manquer surtout pas d’examiner l’article 10, qui retoque le fameux « taux K », pour le simplifier nous dit-on… (5 pages du PLFSS 2015, 17 à 21, pour l’expliquer à nos parlementaires : ici.)
[4] « Pour une Prescription Plus Efficiente du Médicament », marque déposée de notre site web…
[5] Les progrès apportés par les nouveaux médicaments dans le traitement du cancer sont en réalité bien modestes, comparés à l’augmentation exponentielle de leur coût. Nous devrions plutôt prendre exemple sur nos voisins britanniques, bien plus exigeants que nous sur le rapport coût/efficacité des innovations thérapeutiques ! 10/06/2010 : ici.
[6] Ne vaudrait-il pas mieux tout bonnement supprimer la liste des médicaments onéreux, au moins en ce qui concerne les anticancéreux, et réintégrer ces médicaments dans le financement par l’activité (T2A) 23/07/2010 : ici.
[7] La liste des médicaments onéreux : Propositions pour réformer un système dispendieux, opaque, irrationnel et non éthique, qui profite bien plus aux firmes qu’aux patients. 18/08/2011 : ici.
[8] Gérer « indication par indication » les médicaments de la liste en sus, une solution « dans les tuyaux », médicalement justifiée, éthique et responsable pour trouver les 700 millions d’euros d’économies manquantes afin d’abaisser l’ONDAM 2012 à 2,5%. 08/11/2011 : ici.
[9] Madame la Ministre, vous ne pourrez plus ignorer comme votre prédécesseur, la recommandation 2010-25 du Conseil de l’Hospitalisation, après ces 2 rapports de l’IGAS qui pointent du doigt la mauvaise gestion de la liste des médicaments onéreux ! 27/07/2012 : ici.
[10] Quels médicaments onéreux faut-il radier en priorité de la « liste en sus » pour davantage d’efficience, d’éthique et sans perte de chance pour les patients ? 31/01/2014 : ici.
[11] Le PLFSS : 3,2 milliards d’euros d’économies pour l’assurance-maladie, ce qu’il faut retenir. Christophe Gattuso. Le Quotidien du Médecin. 29/09/2014 (ici)
[12] Voir l’article récent suite au décès d’un patient bordelais voici quelques semaines après injection par erreur de chlorure de potassium en IVD : ici). Il faudrait pour cela commencer par exiger de l’industrie du médicament un code barres ou datamatrix présent sur chaque conditionnement primaire, ce qui a été fait il y a dix ans aux USA mais pas encore chez nous (en 2013, seulement 21% des médicaments dans nos hôpitaux disposaient d’un code barres sur leur conditionnement primaire et seuls 12% avaient un code barres lisible par un lecteur…).
31/01/2014 - Quels médicaments onéreux faut-il radier en priorité de la « liste en sus » pour davantage d’efficience, d’éthique et sans perte de chance pour les patients ?
Ce qu’il faut retenir :
- La liste des médicaments onéreux (2,6 milliards d’euros en 2012) remboursés en dehors de la tarification à l’activité (T2A), comporte de nombreuses fausses innovations,
- La mauvaise gestion de la liste a travesti le dispositif initialement prévu qui devait garantir à tous un accès à l’innovation. Une perversion qui profite davantage aux firmes pharmaceutiques qu’aux patients et usagers,
- De nouvelles règles d’inscription, non inscription et radiation de la liste ont pourtant été définies voici plus de trois ans (novembre 2010). Elles n’ont jamais été suivies à la lettre par les Ministres en charge de la Santé,
- La Loi de financement de la sécurité sociale pour 2014 ouvre enfin la possibilité d’une gestion plus efficiente et éthique du dispositif en permettant plus aisément de gérer la liste « indication par indication »,
- Un décret ou arrêté devra probablement encore définir les seules indications prises en charge par l’assurance maladie en dehors de la T2A,
- Nous proposons ci-après une liste de médicaments à radier prioritairement de la liste en sus et donc à réintégrer dans le financement « T2A »,
- Deux principes ont guidé notre choix : La performance financière de la nouvelle liste et sa contribution à l’atteinte des objectifs ambitieux de réduction de la dépense publique fixés par le Président ; Le principe d’égalité et de cohérence visant à traiter de la même manière toutes les spécialités faussement innovantes de la liste qui partagent une même indication,
- In fine, le gain économique, difficile à estimer plus précisément en l’absence d’un accès au public des données de remboursement détaillées par diagnostics principaux, reliés et associés (codage PMSI), devrait être a minima supérieur au demi-milliard d’euros…
Le contexte
Jugeriez-vous normal, particulièrement en période de crise économique, de demander aux françaises et aux français de financer sur leurs cotisations sociales et leur pouvoir d’achat, des médicaments ultra onéreux et qui n’apporteraient aucun ou très peu de progrès thérapeutique ?
La Loi du 23 décembre 2013 de financement de la sécurité sociale en 2014 (LFSS 2014), promulguée manu militari le lendemain même, a enfin fixé le cadre législatif tant attendu, ouvrant à la gestion « indication par indication » des médicaments onéreux remboursés à nos hôpitaux en dehors de la tarification à l’activité (T2A). Encore appelée « liste en sus » par celles et ceux qui tiennent les cordons de la bourse à l’hôpital, un raccourci pour « liste des médicaments onéreux remboursés en sus des prestations d’hospitalisation », mais pas « en sus » de nos cotisations...
En effet, plus de trois ans après que le Conseil de l’Hospitalisation ait redéfini de manière moins laxiste les critères d’inscription, de non inscription et de radiation sur la liste (avis 2010-25 du consultable ici), et après que pas moins de 2 rapports IGAS1,2, dont l’un conjoint avec l’IGF2, et un rapport FHF3, se soient prononcés en faveur de l’application de ces bons principes, le Code de la Sécurité Sociale est donc modifié par la LFSS 2014 en son article L. 162-22-7 par une petite phrase qui change tout :
« Cette liste précise les seules indications thérapeutiques ouvrant droit à la prise en charge des médicaments en sus des prestations d’hospitalisation mentionnées à l’article L. 162-22-6 ».
Mais, quels sont donc ces grands principes « refondateurs » de la gestion de la liste en sus, qui viennent enfin de trouver un cadre réglementaire ?
Principe N°1 : Ne doivent pas être inscrits sur la liste, les médicaments qui n’apportent pas de progrès thérapeutique ou un progrès mineur
Il s’agit des médicaments ayant obtenu de la commission de la transparence de la HAS une amélioration du service médical rendu de niveau V (absence de progrès) ou de niveau IV (progrès mineur). Le progrès thérapeutique étant évalué pour chacune des indications de l’AMM.
Principe N°2 : Pour une radiation de la liste, il faut toujours examiner la situation des médicaments ayant la même indication thérapeutique
Il s’agit d’être équitable et de garantir à chaque médicament de la liste une « égalité de traitement ».
A l’exception du principe N°1, respecté à peu de chose prêt par Marisol TOURAINE, jusqu’au 2 décembre 2013 où elle a fini par inscrire (voir l’arrêté au JO) le ZALTRAP® de SANOFI-AVENTIS (Joli cadeau de Noël pour un labo français, cocorico, auquel tout est permis ?) indiqué dans le cancer colorectal, et ce malgré une ASMR V, aucun ministre n’a appliqué les règles d’inscription et encore moins de radiation, fixées par le Conseil de l’hospitalisation, approuvées par l’IGAS, l’IGF, la FHF…
Que peut changer le nouveau cadre réglementaire ? Que chacun comprenne bien, la générosité de l’assurance maladie qui remboursait jusqu’ici aveuglément les pharaoniques dépenses des nombreuses fausses innovations thérapeutiques, c’est (peut être) fini...
Seulement peut-être, ne nous emballons pas, puisqu’il nous faudra attendre encore la publication de quelques décrets ou arrêtés d’application (ne serait-ce pour définir ces « dites » indications qui conduiront les médicaments au « sésame », sans jeu de mot avec SESAM-Vitale, et celles qui les en priveront) et avant cela d’âpres négociations (auxquelles le LEEM, syndicat des firmes pharmaceutiques, aura évidemment toute sa place, et hélas probablement bien davantage) pour rehausser les tarifs d’hospitalisation des GHS (pathologies) correspondant(e)s, afin d’atténuer l’effet dévastateur pour les finances des actionnaires et salariés des firmes concernées...
Mais, le Président lui-même, n’a-t-il pas été très clair sur le cap à suivre pour un grand nettoyage des dépenses publiques, l’assurance maladie devant elle aussi contribuer aux 50 milliards d’économies…
Cliquer sur l’image pour revoir le Président lors des vœux à la Presse, le 14 janvier 2014 (vers 20 min de l’enregistrement)

« Ce qu’il faut c’est réduire la multiplication des prescriptions, des actes médicaux redondants, des médicaments qui, en France, nous font connaitre un record de consommation », a-t-il martelé…
Il s’agit de s’attaquer enfin à ce que les économistes de la santé appellent « l’effet structure4 » de l’évolution des dépenses pharmaceutiques.
En clair, la forte propension des médecins français, en ville comme à l’hôpital, à prescrire aussi largement toutes ces nouveautés médicamenteuses, toujours plus coûteuses, toujours aussi peu et mal évaluées, le plus souvent faussement innovantes, et bien entendu massivement promues par les firmes pharmaceutiques sans qu’il y ait en en face « d’émetteur public audible5 » pour faire contrepoids.
A noter que déjà en 2011, un groupe de travail mixte, Académie Nationale de Médecine et Haute Autorité de Santé (HAS), à l’occasion d’une mise au point sur la prescription des molécules onéreuses en cancérologie6, pointait du doigt notre pays comme le plus gros consommateur européen de médicaments dans le Cancer :
- En France, 5 M€ d‘anticancéreux pour 100.000 habitants sont vendus chaque année, contre un peu moins de 4 M€ en Autriche, 3.5 M€ en Suisse, 3 M€ en Allemagne, un peu moins de 3 M€ aux Pays-Bas et un peu moins de 2 M€ au Royaume Uni,
- En 2007, on prescrivait en France près de 40 kg de bévacizumab (AVASTIN®, cf. infra) pour 100.000 habitants (1ère place) contre près de 28 kg en Autriche (2ème place), 18 kg aux Pays-Bas, 15 kg en Allemagne…,
L’historique des événements (inscriptions, radiations, modifications de tarifs) concernant les médicaments de la liste en sus est régulièrement actualisée par l’ATIH, au fil des publications au J.O., et est proposé en téléchargement sous forme d’un fichier Excel : ici (au bas de la page qui s'ouvre en cliquant sur le lien précédent)
La Direction de la Sécurité Sociale propose sur son site une fiche d’éclairage sur les médicaments de la liste en sus, extraite du rapport de juin 2013 de la Commission des Comptes de la Sécurité Sociale.
Les graphiques ci-dessous, empruntés à cette fiche, rendent bien compte de la situation actuelle.
Suite à une panne d’innovation, mais aussi au faible nombre des radiations de la liste, la dépense reste stable depuis 2010, à proximité des 2,5 milliards d’euros.
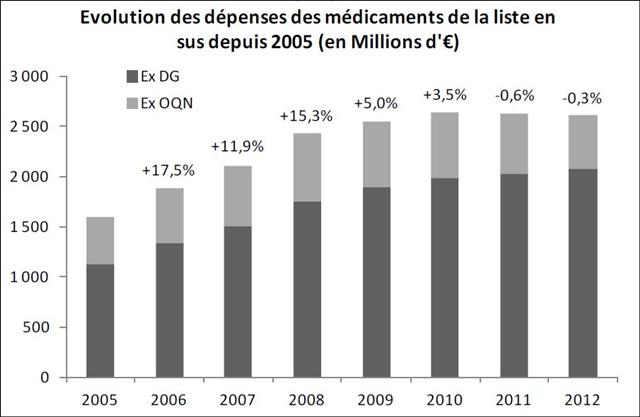
Source : Extrait du rapport de la CCSS en juin 2013
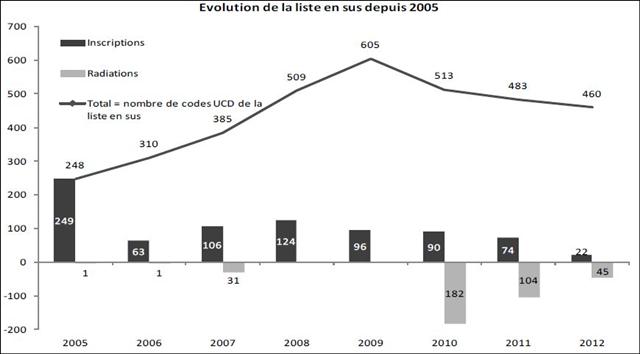
Source : Extrait du rapport de la CCSS en juin 2013
A noter que les radiations ont touché essentiellement des médicaments devenus moins coûteux suite à l’arrivée de génériques, et n’ont absolument pas été guidées par l’application des nouveaux principes de gestion de la liste en sus…
Que s’est il passé en 2013 sur la liste ? Il suffit de jeter un rapide coup d’œil à l’historique actualisé par l’ATIH, accessible : ici
- 18 nouvelles présentations pharmaceutiques (codes UCD) ont été inscrites en 2013, correspondant à 12 molécules différentes, mais à seulement 4 nouvelles entités thérapeutiques (brentuximab vedotin, cabazitaxel, aflibercept, pertuzumab),
- 32 présentations ont été radiées de la liste en sus en 2013, correspondant à 6 molécules différentes parmi lesquelles 4 étaient génériquées ou retirées du marché (topotécan, idarubicine, alemtuzumab, époetine alfa), les 2 autres étaient d’utilisation confidentielle (miglustat, dans la maladie de Gaucher) ou se sont avérées produire des effets indésirables graves sans pour autant être d’efficacité supérieure (occurrence plus fréquente de leucémies aiguës myéloïdes et de seconds cancers primitifs observées avec le lénalidomide). Ces radiations représentaient moins de 10 M€ de dépenses en 2012, soit environ 0,4% de la liste en sus… Donc un enjeu financier microscopique !
Les 50 molécules onéreuses les plus coûteuses de la liste remboursée en sus en 2012
Cliquer sur l’image pour télécharger les classements complets par molécule (DCI) et par présentation pharmaceutique (fichier EXCEL®)
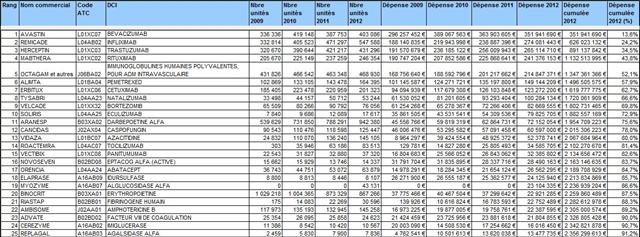
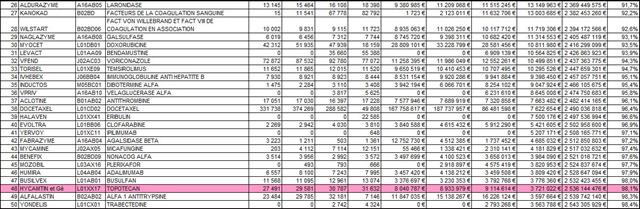
Travail réalisé à partir de données transmises aimablement en septembre 2012 par l’ATIH, que nous remercions.
(En rose, le topotécan, radié de la liste en 2013)
La stricte application des critères définis par le Conseil de l’Hospitalisation en novembre 2010, nous conduit à proposer après examen minutieux de leurs progrès thérapeutiques, la vingtaine de molécules ci-après pour une radiation prioritaire de la liste en sus.
Nous avons également veillé scrupuleusement à traiter de la même manière (principe d’équité) les molécules ayant une même visée thérapeutique (exemple : molécules indiquées dans la polyarthrite rhumatoïde, les cancers bronchique, colorectal et du sein, les antifongiques…).
Le tableau suivant classe ces molécules onéreuses à radier prioritairement dans l’ordre dégressif des montants totaux de dépenses remboursées par l’assurance maladie en 2012 :
Rang
2012 | Nom / DCI | Firme | Indication AMM | ASMR - Date | Population
cible / an | Dépense
2012* | Remarques |
1 | AVASTIN® /
bévacizumab | ROCHE | Cancer du poumon | V - 05/2008 | 6.500-6.900 | 352 M€ | Dans le cancer bronchique non à petites cellules (CBNPC) avancé ou métastasé, l’ajout d’AVASTIN® à l’association paclitaxel / carboplatine améliore moins la survie globale7 (2 mois) que les soins palliatifs précoces8 (2,7 mois). Un comble ! L’étude AVAiL dont les résultats intermédiaires avaient été examinés en 2008 par la commission de la transparence, n’a confirmé aucun bénéfice sur la survie globale9, 10, 11.
D’anciens médicaments de la liste, radiés en 2010 (paclitaxel), 2011 (gemcitabine), et 2012 (docetaxel), ne sont pas moins efficaces que le bévacizumab et coûtent jusqu’à 70 fois moins cher… |
Cancer du sein | V - 05/2011 | 9.400-14.000
(Avis 12/2007) | Aucune amélioration de la survie globale9
Indication retirée aux USA12 |
Cancer du rein | IV - 09/2008 | 5.500 | Les résultats de survie globale (critère principal) ne sont pas interprétables ; Aucune donnée de qualité de vie |
Cancer du colon | IV - 03/2009 | 3.300 | Gain de survie de 2,2 mois au prix d’effets indésirables graves plus fréquents : hémorragies (4,9% vs 0,7%) et perforations gastro-intestinales (2,1% vs 0%) |
Cancer de l’ovaire | IV - 12/2012 | 3.460 | Pas d’amélioration de la survie globale ; Pas d’évaluation de la qualité de vie ; Evénements indésirables plus fréquents (hémorragies, perforation gastro-intestinale, HTA) |
2 | REMICADE® / infliximab | MSD | Polyarthrite rhumatoïde | II - 04/2006 | 10.000-26.000 | 274 M€ | A la lumière de 5 publications récentes, relatives aux résultats de 4 études ayant démontré avec un bon niveau de preuve la non-infériorité à l’infliximab d’une part et d’autre part à l’étanercept, tous deux associés au méthotrexate, d’une triple association de médicaments conventionnels : méthotrexate + sulfasalazine + hydroxychloroquine, tant en termes d’efficacité clinique sur le contrôle de la maladie13-15, qu’en termes de perte de journées travaillées16 et de pension d’invalidité, ou l’absence de justification à ajouter de l’infliximab pendant les 6 premiers mois (versus placebo) à la triple association conventionnelle17 (92% de rémission après 2 ans selon le DAS28 dans les 2 bras de l’étude et différence d’évolution radiologique sans signification clinique), les mesures suivantes sont à prendre :
- L’ASMR des anti-TNF-alpha (infliximab, mais aussi les 4 autres aujourd’hui commercialisés en France : étanercept, adalimumab, certolizumab et golimumab) doit être rétrogradée de II (important) à V (absence de progrès), le comparateur pertinent à prendre en considération étant désormais l’association triple et non pas le méthotrexate seul, lequel n’est efficace que chez 28% des patients ; - L’indication AMM doit être modifiée. Les anti-TNF-alpha ne devant être utilisés qu’après échec d’un traitement par triple association ; - La différence de coût de traitement entre les deux stratégies s’élève à 12.000 par patient et par an ! - La polyarthrite rhumatoïde pourrait représenter environ 20-25% des indications de l’infliximab (selon une étude menée par l’OMEDIT Haute-Normandie en 2008 sur les 3 principaux anti-TNF-alpha) ; |
3 | HERCEPTIN® / trastuzumab | ROCHE | Cancer gastrique | IV - 02/2011 | 500-800 | 265 M€ | Gain de survie globale de 2,7 mois, probablement surestimé suite à l’arrêt prématuré de l’étude |
Cancer du sein néo-adjuvant | ND - 01/2013 | 700-1.700 | Pas d’impact sur la survie globale |
4 | MABTHÉRA® / rituximab | ROCHE | Polyarthrite rhumatoïde | II - 12/2006 | 3.500-8.000 | 241 M€ | L’indication AMM concerne des patients en échec d’au moins un anti-TNF-alpha (rituximab est un médicament de 3ème intention dans la polyarthrite rhumatoïde). Or, dans un essai randomisé en double aveugle15, publié en juin 2013, la triple association de médicaments conventionnels déjà mentionnée pour REMICADE®, n’est pas inférieure à l’étanercept (ENBREL®). L’amélioration clinique observée chez les patients basculés sous trithérapie après un échec du traitement par étanercept au bout de 24 semaines est comparable à celle obtenue chez les patients placés sous biothérapie après échec de l’association triple dans les mêmes délais (p<0,001 dans les deux cas) et sans différence significative entre les deux groupes (p=0,08). Par conséquent, les chances d’obtenir une rémission avec la trithérapie après échec d’un anti-TNF-alpha sont réelles. En l’absence d’étude ayant comparé après échec d’un anti-TNF-alpha, le rituximab à la triple association, il devient impératif de réévaluer le niveau d’ASMR du rituximab, mais aussi de 2 autres biothérapies figurant sur la liste en sus (ROACTEMRA®, tocilizumab et ORENCIA®, abatacept). |
6 | ALIMTA® / pémetrexed | LILLY | Cancer bronchique | V - 11/2008 | 17.000 | 149 M€ | Pas d’avantage clinique démontré par rapport à la gemcitabine dans son indication : « cancer bronchique non à petites cellules, si l’histologie n’est pas à prédominance épidermoïde » ;
Au Royaume Uni, le NICE déconseille l’utilisation du pémétrexed dans cette indication (« Do not do recommendations »)
A noter que dans le CBNPC avancé ou métastasé, les soins palliatifs précoces améliorent de 2,7 mois la survie globale8, un résultat supérieur aux soins habituels, dont la chimiothérapie…
D’anciens médicaments de la liste, radiés en 2010 (paclitaxel), 2011 (gemcitabine), et 2012 (docetaxel), ne sont pas moins efficaces que le bévacizumab et coûtent jusqu’à 70 fois moins cher…
|
7 | ERBITUX® / cétuximab | MERCK KgaA | Cancer colorectal | IV - 05/2009
V - 05/2009 | 7.400-12.300 | 123 M€ | Progrès thérapeutique mineur en monothérapie par rapport au traitement symptomatique seul dans certaines formes de cancer colorectal après échec d’un traitement à base d’oxaliplatine ou d’irinotécan
En première ou seconde ligne, ERBITUX associé à une chimiothérapie standard n’apporte pas d’amélioration du service médical rendu (niveau V) par rapport à une prise en charge habituelle.
|
9 | VELCADE® / bortézomib | JANSSEN CILAG | Myélome multiple | IV - 03/2007
V - 04/2006 | 1.900 | 83 M€ | Amélioration nulle (2006), puis mineure (2007) par rapport à la dexaméthasone dans le cadre du traitement du myélome multiple en deuxième ligne (une seule étude clinique18) |
12 | CANCIDAS® / caspofungine | MSD | Infections fongiques | IV - 02/2005
? - 07/2003 | 2.000-2.500 | 61 M€ | Cancidas apporte une amélioration du service médical rendu mineure de niveau IV en termes de tolérance par rapport à Ambisome® dans le traitement empirique des infections fongiques présumées (notamment à Candida ou Aspergillus) chez les patients adultes neutropéniques fébriles à haut risque d’insuffisance rénale La commission regrette en particulier de ne pas disposer de données permettant de situer la caspofungine par rapport au voriconazole |
14 | ROACTEMRA® / tocilizumab | ROCHE | Polyarthrite rhumatoïde | IV - 12/2013
V - 09/2009
II - 09/2009 | 6.000-8.000
16.000-20.000
5.000-7.000 | 35 M€ | idem que REMICADE® + Plan de gestion de risques (ici) avec de nombreux et sérieux motifs |
15 | VECTIBIX® / panitumumab | AMGEN | Cancer colorectal | V - 10/2012 | 11.700-14.100 | 32 M€ | En l’absence d’étude comparative versus ERBITUX®, VECTIBIX® n’apporte pas d’amélioration du service médical rendu (ASMR inexistante, V) dans la prise en charge du cancer colorectal métastatique avec gène KRAS non muté Après délibération, le collège de la Haute Autorité de santé, en sa séance du 4 décembre 2013, a constaté l'impact significatif du produit VECTIBIX 20mg/ml sur les dépenses de l'assurance maladie. En conséquence, la Commission d'évaluation économique et de santé publique procédera à l'évaluation médico-économique de ce produit. Fait partie des 68 médicaments que la revue médicale indépendante Prescrire recommande d’écarter en raison d’une balance bénéfice risque jugée défavorable19 |
17 | ORENCIA® / abatacept | BMS | Polyarthrite rhumatoïde | V - 12/2013
V - 03/2012
II - 07/2007
| 6.000-8.000
ND | 27 M€ | idem que REMICADE® + Plan de gestion de risques (ici) avec de nombreux et sérieux motifs |
22 | AMBISOME® & ABELCET® / amphotéricine B | GILEAD SCIENCES | Infections fongiques | II - 04/2001 | ? | 22 M€ | Pas de réévaluation de l’ASMR depuis 2001 et la commercialisation ultérieure de la caspofungine et du vériconazole, lesquels ont obtenu une ASMR IV par rapport à AMBISOME® Pas de population cible définie dans l’indication commune avec les 2 autres antifongiques |
30 | MYOCET® / | ELAN | Cancer du sein | V - 09/2001 | ? | 10 M€ | Par rapport à l’épirubicine (FARMORUBICINE®), MYOCET® n’apporte pas de progrès (ASMR V). Pas de réévaluation de l’ASMR depuis 2001… |
32 | VFEND® / vériconazole | PFIZER | Infections fongiques | IV - 11/2006 I - 09/2002 | 1.500-2.200 | 10 M€ | VFEND® apporte une amélioration du service médical rendu mineure (ASMR IV) en termes de tolérance par rapport à la FUNGIZONE® suivie du fluconazole dans le traitement des candidémies chez les patients non neutropéniques, pour les souches Candida résistantes au TRIFLUCAN®. Pas de réévaluation de l’ASMR depuis 2002 et la commercialisation ultérieure de la caspofungine |
39 | HALAVEN® / éribuline | EISAI | Cancer du sein | IV - 07/2011 | 7.400 | 8 M€ | Progrès thérapeutique mineur dans le cancer du sein au stade avancé en troisième ligne de chimiothérapie chez des patientes prétraitées par une anthracycline ou un taxane |
46 | HUMIRA® / adalimumab | ABBVIE | Polyarthrite rhumatoïde | II - 11/2005
II - 09/2004 | 10.000-26.000* | 4 M€** | idem que REMICADE® ; A noter que dans l’essai PREMIER20, mené chez des patients naïfs de méthotrexate, l’adalimumab seul est moins efficace cliniquement que le méthotrexate seul… |
60 | TOMUDEX® / raltitrexed | HOSPIRA | Cancer colorectal | Néant | ? | 1,6 M€ | Pas d’avis de la commission de la transparence Extrait de l’AMM : « L'efficacité et le profil de sécurité de raltitrexed ont été établis dans le traitement des cancers colorectaux métastasiques au cours de 4 études cliniques dont 3 études comparant raltitrexed à différents protocoles associant fluorouracile et acide folinique. Ces études ont montré que les taux de réponse obtenus avec le raltitrexed sont comparables à ceux observés avec les associations fluorouracile-acide folinique. Le raltitrexed s'est révélé inférieur aux comparateurs : - en terme de survie globale dans une étude - en terme de survie sans progression dans 2 études ». |
nc | CAELYX® / doxorubicine | JANSSEN CILAG | Cancer du sein | III - 12/2003 | 4.000-6.000 | 1,2 M€ | Progrès modérée par rapport aux autres présentations non pégylées de doxorubicine, en lien avec une moindre cardiotoxicité. Cependant, les arrêts de traitements pour effet secondaire sont plus fréquents (22% versus 9%).
Faut-il donc maintenir cette indication sur la liste en sus ? La question mérite d’être posée. |
78 | CIMZIA® / certolizumab | UCB | Polyarthrite rhumatoïde | V - 12/2013
V - 03/2010 | 16.000-20.000 | 0,4 M€ | idem que REMICADE® + « Pas d’avantage clinique démontré par rapport aux autres anti-TNFα » + Plan de gestion de risques (ici) avec de nombreux et sérieux motifs |
82 | ENBREL® / étanercept | PFIZER | Polyarthrite rhumatoïde | II - 03/2005 | 10.500-26.000* | 0,3 M€** | idem que REMICADE® |
99 | SIMPONI® / golimumab | MSD | Polyarthrite rhumatoïde | V - 02/2012 | 16.000-20.000 | 0,04 M€ | idem que REMICADE® + « Pas d’avantage clinique démontré par rapport aux autres anti-TNFα » |
(*) Seules sont mentionnés ici les montants totaux remboursés en 2012 pour chaque molécule. L’estimation précise des montants correspondants aux indications proposées à la radiation de la liste en sus, nécessiterait de disposer de la ventilation par diagnostic principal, associé et relié. Données qui ne sont pas pour l’instant accessibles au public.
(**) HUMIRA® et ENBREL®, contrairement aux autres anti-TNF-alpha, ne sont pas réservés à l’hôpital et sont beaucoup plus utilisés en médecine ambulatoire (HAD) qu’à l’hôpital. Leurs montants remboursés en ville en 2012 ont été respectivement de 257 M€ et 200 M€ (source CNAMTS : données MEDIC’AM).
Nos recommandations de radiations, partielles ou totales, explicitées et argumentées pour les dix premières molécules du tableau*** :
1. AVASTIN®, bévacizumab, Laboratoires Roche. Médicament le plus coûteux de la liste avec 352 millions d’euros de dépenses généreusement remboursées par l’assurance maladie en 2012, alors que le progrès thérapeutique qu’il apporte est mineur ou nul dans ses 5 indications AMM, et qu’il n’entre actuellement dans aucun PTT (protocole thérapeutique temporaire) (ici). AVASTIN® doit quitter la liste. D’anciens médicaments de la liste, radiés en 2010 (paclitaxel, oxaliplatine, vinorelbine), 2011 (gemcitabine, irinotécan), et 2012 (docetaxel), ne sont pas moins efficaces que le bévacizumab et coûtent jusqu’à 70 fois moins cher…L’an passé, AVASTIN® était le seul « produit traceur » rendu obligatoire par la circulaire ministérielle de cadrage annuel pour la régulation des dépenses de médicaments onéreux (31 janvier 2013). En particulier, les agences régionales de santé devaient sensibiliser les établissements de santé à limiter sa prescription dans le cancer du sein métastatique compte-tenu du SMR faible et de l’ASMR nulle et de privilégier pour cette indication l’utilisation de médicaments inclus dans les tarifs des GHS… AVASTIN® a reçu en novembre 2013 la suprême distinction de « médicament du mois » de la part de l’hebdomadaire Le Point, « dangereux, inutile, et coûteux ». Un collectif de 73 médecins et chirurgiens cancérologues a alors réagi avec véhémence21. Mais, nous sommes entrain de collecter sur le site « Sunshine Act » du Conseil National de l’Ordre des Médecins les informations concernant les rémunérations et avantages en nature perçus par ces « leaders » (dealers) d’opinion, et qui se chiffrent en dizaines de milliers d’euros… Un fichier récapitulatif et téléchargeable sera prochainement publié (ici). Il faudra qu’un jour les établissements hospitaliers comprennent bien qu’il va de leur intérêt et de celui de la collectivité de financer la prise en charge de leurs « pontes » dans les congrès, plutôt que de laisser cette responsabilité aux firmes, ce qui conduit immanquablement à ce type de dérives de prescription de médicaments tous aussi inutiles que coûteux.
2. REMICADE®, infliximab, Laboratoires MSD (anciennement Schering Plough). Ce médicament doit être radié de la liste dans son indication « Polyarthrite rhumatoïde », et maintenu pour les autres indications. En effet, l’ensemble de la stratégie de prise en charge de la polyarthrite rhumatoïde doit être revue en profondeur suite à l’efficacité non inférieure aux anti-TNF-alpha (infliximab, étanercept) d’une association de 3 DMARDs conventionnels (méthotrexate + sulfasalazine + hydroxychloroquine), beaucoup moins coûteuse (jusqu’à 12.000 € de moins par patient et par an), démontrée avec un excellent niveau de preuve par 3 équipes distinctes (américaine, suédoise et finlandaise) dans 4 études différentes aux résultats convergents et ayant fait l’objet de 5 publications en 2012 et 201313,17. Ainsi, l’ASMR de niveau II (progrès important) accordée généreusement aux biothérapies (anti-TNF-alpha et autres) de la liste en sus, sur la base d’études s’étant contentées de comparer l’association biothérapie + méthotrexate au méthotrexate seul, lequel s’avère ne pas être le meilleure comparateur (et ceci était au demeurant connu depuis fort longtemps, lire le dossier complet proposé sur notre site : ici) est très largement usurpée. La trithérapie conventionnelle doit donc devenir le traitement de seconde intention après échec constatée à la 12ème semaine de méthotrexate en monothérapie, le recours aux biothérapies ne devant s’envisager qu’après échec de la trithérapie (donc en 3ème intention pour les anti-TNF-alpha et en 4ème intention pour les autres biothérapies). Outre l’infliximab, seraient par la même occasion concernées pour une radiation toutes les autres biothérapies de la liste dans leur indication « polyarthrite rhumatoïde ». A savoir, les 4 autres anti-TNF-alpha (ENBREL®, étanercept, PFIZER ; HUMIRA®, adalimumab, ABBVIE ; CIMZIA®, certolizumab, UCB PHARMA ; SIMPONI®, golimumab, MSD France), et les 3 autres biothérapies (MABTHÉRA®, rituximab, Laboratoires ROCHE ; ORENCIA®, abatacept, BRISTOL MYERS SQUIBB ; ROACTEMRA®, tocilizumab, Laboratoires ROCHE). A noter qu’une revue générale et méta-analyse de 26 essais cliniques randomisés portant sur les anti-TNF-alpha dans la polyarthrite rhumatoïde, publiée dans PLOS MEDECINE en janvier 201222, ne retrouve aucune différence d’efficacité clinique entre les 5 molécules d’anti-TNF-alpha actuellement commercialisées en France. La tolérance semble meilleure avec l’étanercept. La circulaire ministérielle sus-mentionnée du 31 janvier 2013 insistait déjà sur la nécessité de veiller au respect de l’utilisation des anti-TNF-alpha en deuxième intention après les traitements de fond. Soulignons que ces médicaments sont loin d’être anodins, mais au contraire, sont responsables d’effets indésirables parfois gravissimes. Chez l’enfant (en dessous de 18 ans), l’Institut américain pour une utilisation sécurisée des médicaments (ISMP, Institute for Safe Medication Practices) dans sa dernière alerte trimestrielle (QuarterWatch®, janvier 2014), pointe à la première place le REMICADE® parmi les 15 médicaments responsables des événements indésirables les plus sérieux rapportés à la FDA (agence américaine du médicament) sur la période de 5 années entre 2008 et 2012. Dans son précédent rapport trimestriel (QuarterWatch®, octobre 2013), l’ISMP avait déjà souligné le grand nombre d’infections sévères (chez 3.324 adultes et enfants) déclarées à la FDA en 2012 pour les 3 principaux anti-TNF-alpha, dont REMICADE®, mais aussi des cancers de la peau et des démyélinisations (observées également dans la sclérose en plaque).
3. HERCEPTIN®, trastuzumab, Laboratoires Roche. Ce médicament apporte un progrès réel dans certains cancers du sein, ce qui justifie pleinement son maintien sur la liste pour ces seules indications. En revanche, et même si cela ne représente qu’une part limitée de son usage, il ne doit plus être remboursé en sus des prestations d’hospitalisation lorsqu’il est prescrit dans l’adénocarcinome de l’estomac ou comme adjuvant après une chimiothérapie néoadjuvante dans le cancer du sein.
4. MABTHÉRA®, rituximab, Laboratoire ROCHE. Ce médicament apporte un progrès incontestable dans la leucémie lymphoïde chronique. Par contre, dans la polyarthrite rhumatoïde, pour les raisons déjà exposées (Cf. infra, REMICADE®), il doit être radié.
5. ALIMTA®, pémétrexed, LILLY. Seul le progrès important apporté par cette molécule onéreuse dans le mésothéliome pleural malin non résécable, justifie son maintien sur la liste en sus pour une population cible de 600 patients. En revanche, dans le cancer bronchique non à petites cellules, localement avancé ou métastatique, si l’histologie n’est pas à prédominance épidermoïde, pour une population cible de 16.000 patients, ALIMTA® n’apporte aucun progrès en 1ère ligne associé au cisplatine par rapport à la gemcitabine (GEMZAR® et ses génériques), pas plus qu’en 2ème ligne en monothérapie par rapport au docétaxel (TAXOTÈRE® et génériques). Au Royaume Uni, le NICE recommande de ne pas l’utiliser dans cette indication (« Do not do recommendations »). Le problème étant que ce médicament est extrêmement onéreux (2.188 € par séance de chimiothérapie) et que les autres anticancéreux auxquels il a été comparé directement dans des essais de non infériorité, gemcitabine et docétaxel, et avant cela le paclitaxel auquel la gemcitabine n’est pas inférieure, ont tous les trois été radiés de la liste en sus alors qu’ils coûtent beaucoup moins cher (La séance de chimiothérapie avec paclitaxel est par exemple 70 fois moins coûteuse pour une efficacité a priori comparable…). Ainsi, lorsque qu’ALIMTA® est actuellement prescrit dans le cancer bronchique, il ne coûte rien à l’hôpital, mais très cher à la collectivité (l’assurance maladie remboursant près de 2.200 €). Alors que si du paclitaxel est utilisé pour le modique coût de séance d’une trentaine d’euros, l’hôpital devra financer l’achat de ce médicament par une partie du tarif facturé. Cet exemple illustre bien à quel point ce système restera « dispendieux, opaque, irrationnel et non éthique, profitant bien plus aux firmes qu’aux patients » tant que les principes de gestion de la liste définis en novembre 2010 par le Conseil de l’hospitalisation ne seront pas « appliqués à la lettre ».
6. ERBITUX®, cétuximab, MERCK KGaA. Ce médicament apporte un progrès notable dans la prise en charge des cancers « têtes et cou ». En revanche, dans le cancer colorectal, les progrès nul ou mineur ne justifient en rien sa prise en charge en dehors de la T2A, alors que ses comparateurs génériqués et beaucoup moins coûteux, oxaliplatine et irinotécan ont été radiés depuis 4 et 3 ans respectivement…
7. VELCADE®, bortézomib, Laboratoires JANSSEN CILAG. Si l’on applique les critères du Conseil de l’hospitalisation, la seule indication justifiant sa présence sur la liste en sus est son utilisation en association au melphalan et à la prednisone qui apporte un progrès modéré (ASMR de niveau III) en termes d’efficacité par rapport à l’association melphalan et prednisone seule dans le traitement de première intention des patients atteints de myélome multiple non éligibles à une chimiothérapie intensive accompagnée d’une greffe de moelle osseuse, pour une population cible de 2.600 à 2.800 patients par an (avis de la commission de la transparence du 10 juin 2009 (ici).
8. CANCIDAS®, caspofungine, Laboratoires MSD. Vu le peu d’études comparatives directes entre les 4 antifongiques présents sur la liste en sus, le vériconazole, la caspofungine, et l’amphotéricine B liposomale (respectivement, VFEND®, CANCIDAS®, AMBISOME®/ABELCET®), et l’absence totale entre VFEND® et CANCIDAS®, il n’est pas possible de juger leur progrès thérapeutique dans leur indication principale « traitement empirique des infections fongiques présumées (candidoses et aspergilloses). Le mieux est encore de les radier de la liste. Seule les indications pédiatriques du CANCIDAS® ayant reçu une ASMR III (progrès modeste) seraient maintenues sur la liste, et concernent une population cible estimée par la HAS entre 500 à 1.100 enfants par an.
9. ROACTEMRA®, tocilizumab, Laboratoires ROCHE. Cette spécialité à obtenu récemment (12/2013) une ASMR de niveau IV (progrès mineure) par rapport à HUMIRA®, adalimumab, tous deux utilisés en monothérapie après échec ou suite à une intolérance au méthotrexate seul, sur la base des résultats de l’essai ADACTA23.
10. VECTIBIX®, panitumumab, Laboratoires AMGEN. Cette molécule n’apporte selon la commission de la transparence aucun progrès dans le traitement du cancer colorectal et plombe les comptes de la Sécurité Sociale. La revue Prescrire dans son numéro de février 201419, recommande d’écarter ce médicament. Il doit quitter la liste en sus et réintégrer les GHS…
(***) Pour les autres molécules proposées à la radiation, se référer à l'argumentaire présenté dans le tableau précédent.
En conclusion :
Va-t-on enfin vers un dénouement heureux dans la gestion calamiteuse depuis son origine de la liste des médicaments onéreux remboursés en dehors des prestations d’hospitalisation ?
Nous sommes dans la bonne direction, mais ce n’est pas encore gagné. A moins que l’équipe aux affaires ne planche déjà sur les pistes que nous proposons…
François PESTY
ANNEXES
Coûts de traitement, quelques exemples instructifs :
AVASTIN®. Dans le cancer bronchique, la posologie varie de 7,5 à 15 mg/kg en espaçant les séances toutes les 3 semaines. Les prix TTC depuis le 01/10/2013 sont de 1.044,96 € pour AVASTIN 25MG/ML PERF FL 16ML et de 283,97 € pour AVASTIN 25MG/ML PERF FL 4ML. Au total, pour un patient de 60 kg, le coût de l’AVASTIN® lors d’une séance de chimiothérapie sera compris entre 1.328,93 € et 2373,89 €…
REMICADE®. Le prix d’un flacon de REMICADE® 100mg est de 492,806 € TTC depuis le 01/06/2011. Le coût annuel de traitement pour un sujet de 70 kg varie en fonction des différentes posologies :
En cas de réponse : 3mg/kg >> 210 mg arrondis à 200 mg = 2 flacons les semaines 1, 3, 7, 15, 23, 31, 39, 47 = 16 flacons = 7.885 € TTC ;En cas de non réponse, 2 schémas : 4,5 à 7,5mg/kg toutes les 8 semaines >>> 315 à 525 mg, soient 3 à 5 flacons toutes les 8 semaines = 20 à 33 flacons = 9.856 à16.263 € TTC ;3mg/kg toutes les 4 semaines >>> 210 mg, soient 2 flacons toutes les 4 semaines = 26 flacons = 12.813 € TTC
HERCEPTIN®. Dans le cancer du sein ou de l’estomac, la posologie initiale est de 8mg/kg/administration et la posologie d’entretien de 6mg/kg/administration toutes les 3 semaines. Il existe aussi pour le cancer du sein un schéma posologique hebdomadaire avec 4mg/kg en initiation de traitement et 2mg/kg en entretien. Le prix d’un flacon de poudre injectable pour perfusion HERCEPTIN® 150mg est de 548,14 € TTC. Le coût d’une séance de chimiothérapie est donc compris entre 548,14 € (2mg/kg en entretien avec le schéma hebdomadaire) et 2.192,56 € (avec 8mg/kg de posologie initiale).
MABTHÉRA®. Le prix d’un flacon de 500 mg est de 1.346, 035 € TTC; Posologie usuelle : 1.000 mg à deux semaines d’intervalle + éventuel nouveau cycle à la 24ème semaine >>> 2 x 2 flacons = 5.384 € TTC (hors prémédications qui doivent être systématiques : corticoïdes + analgésique/antipyrétique (ex : paracétamol) + antihistaminique (ex : diphénhydramine) ;
ALIMTA®. La posologie est de 500 mg / m2 / administration toutes les 3 semaines. Le prix d’un flacon de 500 mg est de 1.094,10 € TTC. Pour 1,9 m2, le coût d’une séance de chimiothérapie est donc de 2.188 €.
ERBITUX®. Posologie : 250 mg/m2/admin (entretien) et 400 mg/m2/admin (attaque). Soit pour un sujet de 1,9 m2 : 475 à 760 mg. Les prix pour un flacon de 500 mg ou de 100 mg sont respectivement de 904,54 € TTC et 180,91 € TTC depuis août 2013. Soit un coût par chimiothérapie compris entre 904,54 € et 1.447,27 €.
VELCADE®. Posologie : 1,3 mg/m2/administration, 2 fois par semaine. Pour 1,9 m2 : 2,5 mg. Prix du flacon à 1 mg = 304,90 € TTC depuis juin 2013 ; Flacon à 3,5 mg = 1.065,77 €. Coût pour une séance de chimiothérapie : 914,70 €.
Références bibliographiques
[1] «Evaluation du dispositif de financement des médicaments en sus des prestations d’hospitalisation dans les établissements de santé », Rapport IGAS, Dr et Dr Aquilino MORELLE, 04/2012
Gilles DUHAMEL[2] « Propositions pour la maîtrise de l’ONDAM 2013-2017», Rapport IGAS/IGF, Vincent LIDSKY, Dominique GIORGI, et al. 07/2012
[3] « Evaluation de la T2A » Rapport FHF, Pr Jean-Yves FAGON et al., 06/2013
[4] Voir le Points de Repère N°41, « Une stabilité des dépenses du médicament de ville », Vincent REDURON, CNAMTS, 06/2011 (Voir le tableau 1, page 2 ; Le chapitre « Un effet structure qui perdure à un niveau élevé » page 4 ; La définition donnée page 5)
[5] Relire l’excellent Rapport IGAS 2007, Pierre-Louis BRAS, Pierre RICORDEAU, et al., consacré à « l’information des médecins généralistes sur le médicament » qui employait cet adjectif
[6] Mise au point sur la prescription des molécules onéreuses en cancérologie - Groupe de travail mixte : Académie Nationale de Médecine - Haute Autorité de Santé - 15/03/2011
[7] Paclitaxel-Carboplatin Alone or with Bévacizumab for Non-Small-Cell Lung Cancer. Sandler A et al., N Engl J Med 2006;355:2542-50. Téléchargeable gratuitement ici.
[8] Early Palliative Care for Patients with Metastatic Non–Small-Cell Lung Cancer. Jennifer S. Temel et al., N Engl J Med 2010;363:733-42. Téléchargeable gratuitement ici.
[9] Addition of Bevacizumab to Chemotherapy for Treatment of Solid Tumors: Similar Results but Different Conclusions. Alberto Ocaña et al., Journal of Clinical Oncology 2011;29:254-256. Téléchargeable gratuitement ici.
[10] Phase III Trial of Cisplatin Plus Gemcitabine With Either Placebo or Bevacizumab As First-Line Therapy for Nonsquamous Non–Small-Cell Lung Cancer: AVAiL. Martin Reck et al., J Clin Oncol 27:1227-1234. Téléchargeable gratuitement ici.
[11] Overall survival with cisplatin–gemcitabine and bevacizumab or placebo as first-line therapy for nonsquamous non-small-cell lung cancer: results from a randomised phase III trial (AVAiL). Martin Reck et al., Annals of Oncology 2010 ; 21:1804–1809. Téléchargeable gratuitement ici.
[12] La FDA a retiré à l’AVASTIN® son indication dans le cancer du sein le 18/11/2011 : ici.
[13] Conventional combination treatment versus biological treatment in methotrexate-refractory early rheumatoid arthritis: 2 year follow-up of the randomised, non-blinded, parallel-group Swefot trial. R Van Vollenhoven et al. Lancet 2012;379:1712-20: http://www.thelancet.com/journals/lancet/article/PIIS0140-6736%2812%2960027-0/fulltext#article_upsell
[14] A Randomized Comparative Effectiveness Study of Oral Triple Therapy Versus Etanercept Plus Methotrexate in Early Aggressive Rheumatoid Arthritis - The Treatment of Early Aggressive Rheumatoid Arthritis Trial (TEAR Trial). L. Moreland et al. ARTHRITIS & RHEUMATISM Vol. 64, No. 9, September 2012, pp 2824–2835 DOI 10.1002/art.34498: http://211.144.68.84:9998/91keshi/Public/File/2/64-9/pdf/34498_ftp.pdf (accès libre)
[15] Therapies for Active Rheumatoid Arthritis after Methotrexate Failure. James R. O’Dell et al. N Engl J Med 2013. DOI: 10.1056/NEJMoa1303006 (publié « online » le 11 juin 2013)
[16] Biological vs Conventional Combination Treatment and Work Loss in Early Rheumatoid Arthritis - A Randomized Trial. Jonas K. Eriksson et al. JAMA Intern Med. doi:10.1001/jamainternmed.2013.7801 Published online July 1, 2013.
[17] Infliximab for 6 months added on combination therapy in early rheumatoid arthritis: 2-year results from an investigator-initiated, randomised, double-blind, placebo-controlled study (the NEO-RACo Study). Marjatta Leirisalo-Repo et al., Ann Rheum Dis 2013;72:851–857. Téléchargeable gratuitement ici.
[18] Bortezomib or High-Dose Dexamethasone for Relapsed Multiple Myeloma. Paul G. Richardson et al., N Engl J Med 2005;352:2487-98. Libre accès : ici.
[19] Pour mieux soigner, des médicaments à écarter : bilan 2014. Prescrire, février 2014, (34) ;364:137-43 (en accès libre ici)
[20] The PREMIER Study - A Multicenter, Randomized, Double-Blind Clinical Trial of Combination Therapy With Adalimumab Plus Methotrexate Versus Methotrexate Alone or Adalimumab Alone in Patients With Early, Aggressive Rheumatoid Arthritis Who Had Not Had Previous Methotrexate Treatment. Ferdinand C. Breedveld et al., ARTHRITIS & RHEUMATISM Vol. 54, No. 1, January 2006, pp 26–37. Accès libre ici
[21] Le Point/Avastin : “Les cons, ça ose tout. C’est même à ça qu’on les reconnait” sur le blog « DOCBUZZ ».
[22] Systematic Review and Meta-Analysis of the Efficacy and Safety of Existing TNF Blocking Agents in Treatment of Rheumatoid Arthritis. Kalle J. Aaltonen et al., PLoS ONE 2012 (accès libre : ici)
[23] Tocilizumab monotherapy versus adalimumab monotherapy for treatment of rheumatoid arthritis (ADACTA): a randomised, double-blind, controlled phase 4 trial. Cem Gabay et al., Lancet 2013, 381:1541-50 (accès libre à l’abstract : ici)