Actualités - Dernières nouvelles - Années 2012 & 2013
06/09/2013 - Pour 12.000 euros de plus par patient et par an dans la polyarthrite rhumatoïde, les biothérapies ne font pas mieux finalement que l’association bon marché de deux vieilles molécules.
Comment les agences sanitaires, le comité économique des produits de santé (CEPS) et l’assurance maladie ont-ils pu se faire berner à ce point par les firmes pharmaceutiques et leurs leaders d’opinion ?
L’institut PUPPEM dévoile pour la première fois l’évolution des prescriptions en ville et à l’hôpital des antirhumatismaux indiqués dans la polyarthrite rhumatoïde entre 2005 et 2012
Télécharger l’article complet au format pdf (ici)
Synthèse / Recommandations
Ce qu’il faut retenir :
- De nouvelles données scientifiques publiées ces 2 dernières années, avec en point d’orgue l’été 2013, établissent avec un bon niveau de preuve l’absence de supériorité tant en termes d’efficacité clinique, qu’en perte de journées travaillées chez les patients atteints de polyarthrite rhumatoïde au stade précoce, pour deux biothérapies coûteuses, l’étanercept et l’infliximab, par rapport à l’association de deux vieilles molécules peu onéreuses, la sulfasalazine et l’hydroxychloroquine,
- La supériorité de la trithérapie méthotrexate + sulfasalazine + hydroxychloroquine sur le méthotrexate en monothérapie, lequel constitue toujours le traitement initial de référence dans la prise en charge thérapeutique de la maladie, était connue dès … 1996,
- Malgré cela, au début des années 2000, lorsque les firmes pharmaceutiques ont commencé à commercialiser les premières biothérapies onéreuses, puis par la suite, les autorités sanitaires partout dans le monde, dont en France l’ANAES, devenue HAS et l’AFSSAPS, devenue ANSM, ont accepté très complaisamment de définir le progrès thérapeutique de ces médicaments en choisissant opportunément comme comparateur le méthotrexate en monothérapie,
- La « nouvelle donne » scientifique justifierait donc la rétrogradation des améliorations du service médical rendu (ASMR) octroyées si généreusement par la Haute Autorité de Santé, la radiation des spécialités concernées de la liste des médicaments onéreux remboursés en sus des prestations d’hospitalisation pour cette indication, la révision des libellés d’indication AMM, ainsi qu’une révision des recommandations pour la pratique clinique, et qu’une renégociation, en forte baisse, des prix de vente exorbitants que le CEPS avait acceptés de la part des industriels pour ces médicaments en définitive faussement innovants,
- L’impact médico-économique est considérable puisque la différence de coût de traitement est estimée à 12.000 euros par patient et par an, et que la dépense remboursée en ville et à l’hôpital pour les 3 premières biothérapies appartenant à la classe des anti-TNF-alpha s’élevait à 730 millions d’euros en 2012, soit un cumul de 3,8 milliards de remboursements sur la période 2005 à 2012…
- l’ATIH, et nous l’en remercions vivement, a accepté de nous communiquer les données hospitalières dont elle dispose (médicaments onéreux de la liste en sus pour l'activité MCO). En revanche, l’ANSM n’a pas souhaité nous transmettre ses données, ce qui nous prive d’une image complète de la situation (données hospitalières manquantes pour les médicaments non inscrits sur la liste),
- Une question demeure : existerait-il aussi une association de médicaments bon marché permettant de faire jeu égale avec les biothérapies dans leurs autres indications, notamment maladie de Crohn et spondylarthrite ankylosante ?
- Enfin, il serait très opportun que les délégués de l’assurance maladie et les praticiens conseils visitent les rhumatologues pour leur présenter ces nouvelles données et promouvoir une prescription plus efficiente dans la polyarthrite rhumatoïde…
********************
Plan
Cliquer sur les liens pour vous déplacer dans l’article
1. Quelques rappels préliminaires sur la polyarthrite rhumatoïde, ses traitements actuels et leurs coûts
- Qu’est-ce que la polyarthrite rhumatoïde ?
- Quels sont les médicaments du traitement de fond de la polyarthrite rhumatoïde ?
- Quel est le coût des différentes alternatives thérapeutiques ?
- Quelle a été l’évolution de la prescription remboursée en ville et à l’hôpital entre 2005 et 2012 ?
2. Quels sont les nouvelles données scientifiques qui devraient chambouler le traitement de fond de la polyarthrite rhumatoïde et remettre
en cause la place trop belle accordée aux biothérapies onéreuses ?
- L’étude américaine publiée en ligne le 11 juin 2013
- L’étude TEAR publiée un an plus tôt par la même équipe
- L’étude suédoise publiée en ligne le 1er juillet 2013
- Les publications antérieures de l’étude suédoise « Swefot »
- Les autres travaux antérieurs
- Les recommandations internationales
3. En quoi les autorités sanitaires se sont-elles laissées abuser par les firmes ?
4. Conclusions et recommandations
- L’ASMR des biothérapies devrait être rétrogradée, et les spécialités concernées, radiées de la liste en sus pour cette indication
- Les recommandations pour la pratique clinique devraient aussi évoluer
- Les libellés des indications AMM dans la PR devraient être reprécisés
- Le prix exorbitant des biothérapies devrait être renégocié à la baisse par le CEPS
- La promotion auprès des rhumatologues de la prescription de la trithérapie conventionnelle devrait être organisée par les pouvoirs publics
5. Bibliographie
6. Annexes - Détail du calcul des coûts annuels de traitement
********************
Suite à la publication « online » le 11 juin 2013 dans le New England Journal of Medicine 1-5 des résultats d’un premier essai thérapeutique randomisé mené aux USA par le Veterans Affairs, puis d’un second publié aussi online le 1er juillet dans le JAMA Internal Medicine 6, 7 et conduit par des chercheurs suédois, le progrès thérapeutique un peu vite accordé aux biothérapies dans la polyarthrite rhumatoïde devra être singulièrement revu à la baisse…
1. Quelques rappels préliminaires sur la polyarthrite rhumatoïde, ses traitements actuels et leurs coûts Retour
Qu’est-ce que la polyarthrite rhumatoïde ?
La polyarthrite rhumatoïde (rheumatoid arthritis en anglais) constitue le rhumatisme inflammatoire chronique le plus fréquent et le plus sévère. La PR évolue par poussées, et sans une prise en charge efficace, elle conduit au handicap. Il n’y a pas de traitement curatif, mais la maladie est de mieux en mieux contrôlée. Selon la Cnamts, près de 190.000 patients au 31 décembre 2011 étaient en affection de longue durée « polyarthrite rhumatoïde évolutive grave » (ALD N°22).
L’objectif thérapeutique principal dans la PR est de contrôler au mieux l’activité de la maladie, et si possible d’induire une rémission. Il s’agit de réduire la douleur, de prévenir et contrôler les destructions articulaires, de prévenir la perte de fonction dans les activités quotidiennes et au travail et d’optimiser la qualité de vie 8.
Quels sont les médicaments du traitement de fond de la polyarthrite rhumatoïde ?
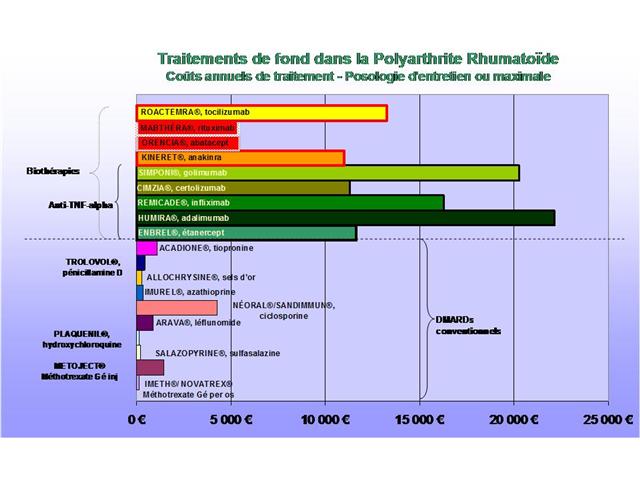
Les 2 tableaux ci-après permettent d’individualiser les médicaments dits conventionnels (« DMARDs »), des biothérapies onéreuses. Ils reprennent et actualisent les médicaments considérés par la Haute Autorité de Santé comme utilisables en traitement de fond de la PR 9.
Tableau 1 - Traitement de fond de la polyarthrite rhumatoïde - DMARDs conventionnels
Spécialité | DCI | Code ATC | Poso max ou entretien (PR) en mg/j | rythme d’admin | Autres indications AMM |
IMETH®/
NOVATREX®/
Méthotrexate Gé per os | méthotrexate formes orales | L04AX03 | 25 | hebdomadaire | PS, RP |
LEDERTREXATE®/
METOJECT®/
Méthotrexate Gé inj | méthotrexate formes injectables | L01BA01 | 25 | hebdomadaire | PS, RP |
SALAZOPYRINE® | sulfasalazine | A07EC01 | 2.000 | quotidien | RH, MC |
PLAQUENIL® | hydroxychloroquine | P01BA02 | 200 à 400 (=>400) | quotidien | LE |
ARAVA® | léflunomide | L04AA13 | 10 à 20 (=> 20) | quotidien | RP |
NÉORAL®/SANDIMMUN® | ciclosporine | L04AD01 | 5mg/kg (=>300) | quotidien | Nombreuses |
IMUREL® | azathioprine | L04AX01 | 150 (poso max) | quotidien | Nombreuses |
ALLOCHRYSINE® | sels d’or | M01CB05 | 1 amp | hebdomadaire | RIC |
TROLOVOL® | pénicillamine D | M01CC01 | 600 à 900 (=>600) | quotidien | Maladie de Wilson |
ACADIONE® | tiopronine | Z | 1.000 à 1.500 | quotidien | Lithiase cystine |
ENDOXAN® | cyclophosphamide | L01AA01 | 500 à 4.000 mg/m2/cure | 1 cure toutes les 3 ou 4 semaines | Nombreuses en Onco-hématologie |
PR = polyarthrite rhumatoïde ; PS = psoriasis ; RH = rectocolite hémorragique ; RP = Rhumatisme psoriasique ; MC = Maladie de Crohn ; LE = lupus érythémateux ;
SA = Spondylarthrite ankylosante ; RIC = Rhumatisme inflammatoire chronique ; PJC = Polyarthrite juvénile chronique
Nota : Le cyclophosphamide, très peu utilisé dans la polyarthrite rhumatoïde, absent des recommandations internationales (EULAR, ACR, AHRQ, NICE),
et possédant de très nombreuses indications notamment en onco-hématologie, n’a pas été retenu pour l’étude de l’évolution de la prescription.
Tableau 2 - Traitement de fond de la polyarthrite rhumatoïde - Biothérapies onéreuses
Spécialité | DCI | Code ATC | Poso max ou entretien (PR) en mg/j | rythme d’admin | Autres indications AMM |
ENBREL® | étanercept | L04AB01 | 25 | 1 à 2x/sem | RP, SA, PS |
REMICADE® (réserve hospitalière) | infliximab | L04AB02 | 3mg/kg (=> 200) | sem 1, 3, 7, puis 1sem/8 (1/8) | MC, SA, RP, RH, PS |
HUMIRA® | adalimumab | L04AB04 | 40 | 0,5 à 1x/sem (hebdo) | RP, SA, MC, PS, RH |
CIMZIA® | certolizumab | L04AB05 | 200mg 1 sem/2 | 400 mg semaines 0, 2, 4 ; puis 200 mg une semaine sur deux |
|
SIMPONI® | golimumab | L04AB06 | 50mg/admin | mensuel | RP, SA |
KINERET® | anakinra | L04AC03 | 100 | quotidien | aucune |
ORENCIA® (réserve hospitalière) | abatacept | L04AA24 | 500 | sem 1, 3, 5, puis 1sem/4 |
|
MABTHÉRA® (réserve hospitalière) | rituximab | L01XC02 | 1.000 | sem 1 et 3 | Onco-hématologie |
ROACTEMRA® (réserve hospitalière) | tocilizumab | L04AC07 | 4mg/kg à 8mg/kg (=> 600) | 1 sem/4 | PJC |
XELJANZ® (autorisé par la FDA aux USA, mais pas encore en France, dossier au demeurant bien mal engagé 10) | tofacitinib | L04AA29 (source : OMS, page 119) ici | 10 ou 20 mg/j | en 2 prises par jours |
|
PR = polyarthrite rhumatoïde ; PS = psoriasis ; RH = rectocolite hémorragique ; RP = Rhumatisme psoriasique ; MC = Maladie de Crohn ; LE = lupus érythémateux ;
SA = Spondylarthrite ankylosante ; RIC = Rhumatisme inflammatoire chronique ; PJC = Polyarthrite juvénile chronique
Schématiquement, il est possible de considérer que :
- Les premiers médicaments conventionnels à avoir démontré leur capacité à agir sur l’activité de la maladie et à réduire la progression des lésions articulaires ont été qualifiés de « DMARDs » (pour « disease-modifying antirheumatic drugs ») par les rhumatologues dans les pays anglo-saxons,
- Leur chef de file, utilisé seul en première intention dans le traitement de fond de la polyarthrite rhumatoïde active, est, et demeure, le méthotrexate. Il est admis qu’environ 30% des patients atteints d’une PR active au stade précoce vont bien répondre au méthotrexate en monothérapie (rémission ou activité faible de la maladie),
- Cependant, d’autres DMARDs, ont été ou sont encore utilisés avec plus ou moins de succès dans la PR, seuls ou en association : La sulfasalazine, l’hydroxychloroquine, le léflunomide, la ciclosporine…
- Puis sont apparus successivement au début des années 2000, 5 médicaments de biothérapie, appartenant à la classe des anti-TNF-alpha (inhibiteur du facteur de nécrose tumorale), utilisés en deuxième intention en association en méthotrexate, lorsque celui-ci ne permet pas ou plus de contrôler la maladie. Dans l’ordre chronologique d’obtention des autorisations européennes de mise sur le marché : L’infliximab, l’étanercept, l’adalimumab, le certolizumab pegol, et le golimumab.
- L’anakinra, inhibiteur de l’interleukine introduit sur le marché français en 2003 est également un traitement de deuxième intention, utilisé en cas d’échec du méthotrexate seul.
- Enfin, 3 autres biothérapies réservées à l’hôpital, constituent une alternative de 3ème intention en cas d’échec de l’association des 6 biothérapies précédentes au méthotrexate. Il s’agit du rituximab, de l’abatacept, et du tocilizumab…
- Pour être complet, le tofacitinib (XELJANZ®, Pfizer), inhibiteur des Janus Kinases (JAK), déjà autorisé par la FDA aux USA, pourrait prochainement être commercialisé en France, et possède déjà sa page sur Wikipédia…
Quel est le coût des différentes alternatives thérapeutiques ?
Selon une étude publiée par la Cnamts le 8 août 2013 11, les dépenses en ville d’antirhumatismaux spécifiques traitant notamment la polyarthrite rhumatoïde en 2011 (La Cnamts n’a pas encore analysée les dépenses 2012…), s’élevaient à 609,4 Millions d’euros. Trois biothérapies de la classe des anti-TNF-alpha (HUMIRA®, ENBREL®, CIMZIA®) représentaient 91% de ce montant, alors que le méthotrexate totalisait seulement 6%, et que trois autres anciens médicaments encore utilisés en traitement de fond, PLAQUENIL®, ARAVA® et KINERET®, représentaient 3% de la dépense totale...
Mais là où cela se corse, c’est que d’autres médicaments utilisés dans les mêmes indications sont réservés à l’usage hospitalier et ne sont donc pas comptabilisés par l’assurance maladie dans son étude. La caisse nationale n’analysant pas encore avec finesse les dépenses du champ hospitalier, se bornait à signaler dans son étude la très forte hausse de leurs dépenses en 2011 (16% pour REMICADE®, 17% pour ORENCIA® et 72% pour ROACTEMRA®), données du PMSI que la caisse nationale a obtenues auprès de l’ATIH (Agence Technique de l'Information sur l'Hospitalisation).
Les données de l’ATIH n’étant pas encore accessibles au pecum vulgaris, nous avons demandé et remercions vivement cette agence de nous avoir communiqué les données en sa possession. A savoir les volumes et les dépenses afférentes, détaillés par présentations pharmaceutiques pour les médicaments onéreux inscrits sur la liste remboursée en sus des prestations d’hospitalisation, c’est à dire en dehors de la tarification à l’activité (T2A), sur le secteur d’activité MCO (médecine, chirurgie, obstétrique). Concrètement, il s’agit des 5 anti-TNF-alpha, REMICADE®, ENBREL®, HUMIRA®, CIMZIA® et SIMPONI®, et de 3 autres biothérapies, MABTHÉRA®, ORENCIA®, et ROACTEMRA®.
En revanche, l’ANSM, Agence du médicament, qui possède pourtant ces informations qu’elle recueille chaque année directement auprès des firmes pharmaceutiques, ne les diffuse pas, et a refusé de nous les fournir ; La seule information à notre disposition au travers des analyses publiées par l’agence 12, 13 concerne le classement des médicaments les plus vendus à l’hôpital. En l’occurrence, REMICADE® occupait la 4ème place en 2011, puis la 3ème en 2012, et MABTHERA®, qui possède une indication dans la polyarthrite rhumatoïde la 6ème en 2011 puis la 7ème en 2012 (Pour mémoire, HUMIRA® et ENBREL® pointaient respectivement aux 6ème et 7ème places du classement des médicaments pour leurs chiffres d’affaires 2011 en ville, puis aux 4ème et 7ème du classement 2012).
Il nous manque donc les données chiffrées des médicaments hospitaliers non inscrits sur la liste en sus.
Nous ne connaîtrons donc pas le montant exact de dépenses pour ces médicaments. Ainsi, l’usager du système de santé, l’assuré social, le patient ne peut, ne doit pas savoir à quoi sont employées ses laborieuses cotisations.
Heureusement, avec l’aide précieuse de l’ATIH nous avons pu approcher le chiffre exact pris en charge par l’assurance maladie (En effet, les médicaments non listés en sus, sont financés principalement par les recettes de la T2A).
Quelle a été l’évolution de la prescription remboursée en ville et à l’hôpital des médicaments du traitement de fond de la polyarthrite rhumatoïde entre 2005 et 2012 ?
Les graphiques suivants, sont donc tirés d’une analyse ayant regroupé les données de remboursement en ville entre 2001-2012 (Source : MEDIC’AM) avec celles issues de l’hôpital pour ces 8 molécules inscrites sur la liste en sus, entre 2005 et 2012 pour l’hospitalisation publique (établissements anciennement sous dotation globale) et entre avril 2009 et 2012 pour l’hospitalisation privée (Source : ATIH, données PMSI MCO).
REMICADE®, HUMIRA® et ENBREL® sont les principaux responsables de l’explosion des dépenses en ville et à l’hôpital dans la polyarthrite rhumatoïde. 730 millions d’euros en 2012, 3,8 milliards d’euros cumulés sur la période 2005-2012…
Cliquer sur l’image ci-dessous pour télécharger les graphiques sous forme d’un diaporama animé
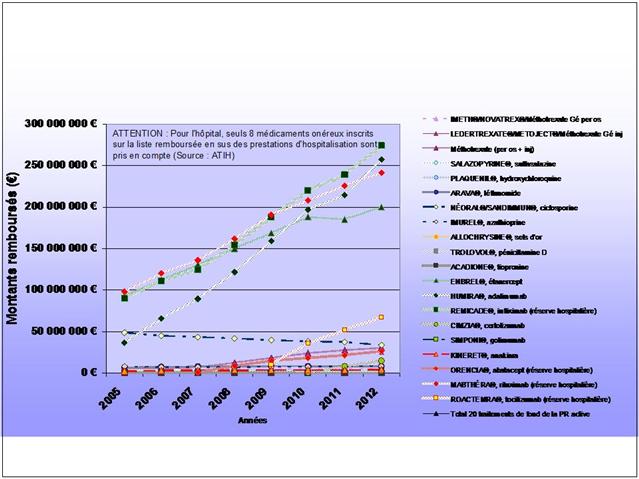
ATTENTION : Données incomplètes, car les médicaments hospitaliers n’appartenant pas à la liste remboursée en sus n’ont pas été comptabilisés
(L’ANSM ayant refusé de nous transmettre les données en sa possession)
L’augmentation (modique en comparaison) des dépenses de méthotrexate, est le fruit d’un recours de plus en plus fréquent à la voie injectable, plus onéreuse.
A noter également le démarrage tonitruant de ROACTEMRA®, CIMZIA® et SIMPONI®, trois biothérapies récemment mises sur le marché, augurant d’une croissance des dépenses qui ne faiblira pas dans les prochaines années…
Cliquer sur l’image ci-dessous pour télécharger les graphiques sous forme d’un diaporama animé
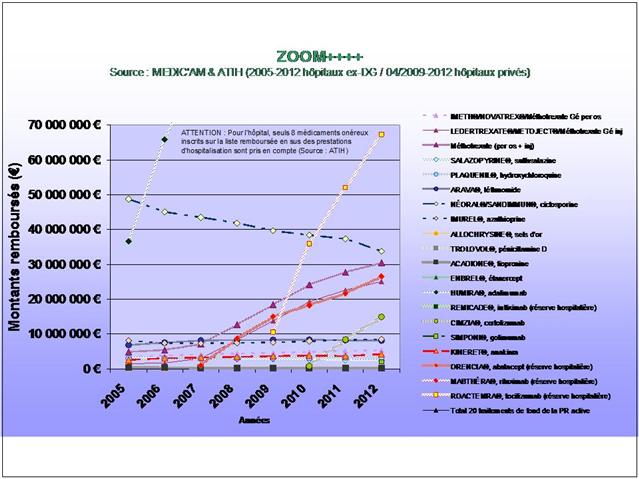
En pourcentage des boites remboursées, il apparait clairement que la consommation de méthotrexate est stable depuis 2009, alors que l’utilisation de SALAZOPYRINE® et de PLAQUENIL®, les deux autres médicaments de l’association triple non inférieure aux biothérapies, ne cesse de décliner… (Etude conduite sur la ville uniquement, ne disposant pas des données hospitalières de l’ANSM)
Cliquer sur l’image ci-dessous pour télécharger les graphiques sous forme d’un diaporama animé
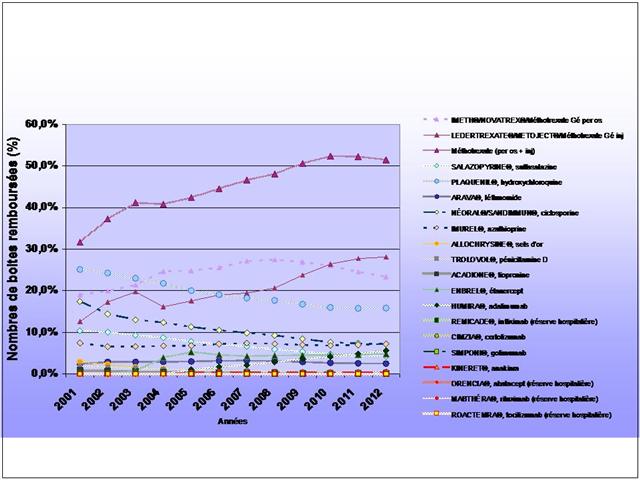
Les différences de coût annuel de traitement entre médicaments conventionnels et biothérapies sont considérables…
Cliquer sur l’image ci-dessous pour télécharger les graphiques sous forme d’un diaporama animé
2. Quels sont les nouvelles données scientifiques qui devraient chambouler le traitement de fond de la polyarthrite rhumatoïde et remettre en cause la place trop belle accordée aux biothérapies onéreuses ? Retour
2.1. L’étude américaine publiée en ligne le 11 juin 2013 1-5 :
Dans un essai contrôlé et randomisé mené en double aveugle, 353 patients souffrant d’une PR active en échec au traitement par méthotrexate seul, ont été tirés au sort entre juillet 2007 et décembre 2010 pour recevoir soit une trithérapie conventionnelle de DMARDs : méthotrexate + sulfasalazine + hydroxychloroquine, soit l’association méthotrexate + étanercept (ENBREL®) pendant 48 semaines. Les patients qui n’avaient pas obtenu d’amélioration clinique à 24 semaines étaient basculés sur l’autre traitement (en double aveugle) ; Le critère principal de jugement était une amélioration du score d’activité clinique de la maladie portant sur 28 articulations (DAS28 14) à 48 semaines. Cette étude multicentrique, a été conduite aux USA dans 16 hôpitaux du Veterans Affairs (qui a financé ce travail) et 12 sites du réseau RAIN (Rheumatoid Arthritis Investigational Network), ainsi que dans 8 centres médicaux canadiens.
Résultats : Une amélioration clinique (graphique A ci-dessous) a été observée pour les deux groupes à 24 semaines (p=0,001 en comparaison aux valeurs initiales). La trithérapie n’est pas inférieure à l’association étanercept + méthotrexate (p=0,002)
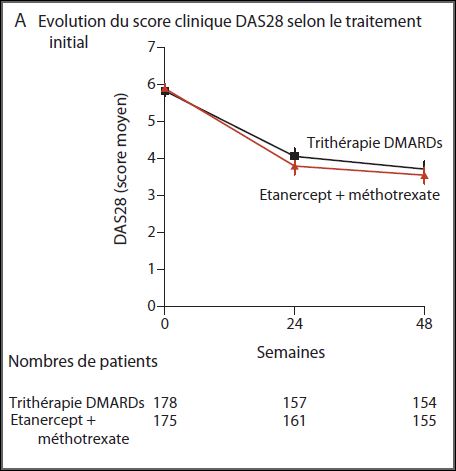
Dans chaque groupe, 27% des patients ont été basculés sur l’autre traitement avec une amélioration (p<0,001) sans différence significative entre les deux groupes (p=0,08). La modification du DAS28 entre l’inclusion dans l’essai et la semaine 48 est similaire dans les deux groupes (-2,1 avec la trithérapie, -2,3 avec l’étanercept, p=0,26). Aucune différence significative n’a été rapportée sur les critères secondaires de jugement, dont la progression radiographique, la douleur, la qualité de vie, et la fréquence des effets secondaires majeurs.
Un point d’importance : L’amélioration clinique (graphique B ci-dessous) observée chez les patients basculés sous trithérapie après un échec du traitement par étanercept est comparable à celle obtenue chez les patients placés sous biothérapie après échec de l’association triple (p<0,001 dans les deux cas) et sans différence significative entre les deux groupes (p=0,08). Nous nous souviendrons de cette observation lorsque plus loin nous remettrons en cause la stratégie actuellement privilégiée en cas d’échec avec un anti-TNF-alpha, qui consiste à essayer un autre anti-TNF-alpha ou à recourir à une autre biothérapie…
Des troubles gastro-intestinaux ont été plus fréquents avec l’association triple, tandis que les infections et les atteintes de la peau ou des tissus sous-cutanés sont plus fréquemment associées à l’association méthotrexate + anti-TNF-alpha. Parmi les 12 arrêts de traitement sous trithérapie, 7 étaient dus à un trouble gastro-intestinal, alors que 4 des 5 arrêts sous étanercept étaient liés à une infection. Bien que la fréquence des effets secondaires graves ait été identique dans les 2 groupes, davantage d’infections sévères ont été constatées sous étanercept. Parmi les douze infections sévères avec anti-TNF-alpha, une pneumonie a entrainé le décès du patient, une aspergillose pulmonaire et une sinusite fongique récurrente ont été observées avec guérison des patients. Les 4 infections sévères sous trithérapie ont régressé sans séquelles.
Le tableau ci-après présente le coût des traitements en France pour 24 semaines aux posologies employées dans l’essai américain
Traitement / posologie | Méthotrexate 15mg/sem. | Méthotrexate 25mg/sem. | SALAZOPYRINE®
1 g/j x 6 semaines, puis 2g/j | PLAQUENIL®
400 mg/j | ENBREL®
50mg/semaine | Coût total 24 semaines |
Trithérapie conventionnelle | 377,28 € TTC | 628,80 € TTC | 82,73 € TTC | 59,70 € TTC |
| 520 à 771 € TTC |
Biothérapie | 377,28 € TTC | 628,80 € TTC |
|
| 5.736,06 € TTC | 6.113 à 6.365 € TTC |
Le différentiel de coût pour 24 semaines est donc : 5.593,63 € TTC
Soit un différentiel de coût annuel de traitement égal à : 12.120 € TTC (sans compter les frais infirmiers)
Rares sont les médias à avoir relayé cette information à ce jour… Citons néanmoins, Medscape International 15 et Medscape France 16 qui titraient au conditionnel, mais ce n’est déjà pas si mal...
2.2. L’étude TEAR publiée un an plus tôt par la même équipe américaine 17
En septembre 2012, Larry MORELAND de l’université de Pittsburgh, en Pennsylvanie, et James O’DELL en second auteur, publiaient dans Arthritis & Rheumatism, la revue officielle de l’ACR (American College of Rheumatology) les résultats de l’étude multicentrique TEAR (Treatment of Early Aggressive Rheumatoid Arthritis) qui préfiguraient ceux de l’étude de juin 2013. Cet essai randomisé en double aveugle, conduit chez 755 patients atteints de polyarthrite rhumatoïde active (au moins 4 articulations douloureuses et 4 articulations enflées sur 28), à un stade précoce de la maladie (inclusion en moyenne 3,6 mois après le diagnostic), avec un suivi de deux ans devait répondre à deux questions :
- L’intensification immédiate du traitement donne-t-elle de meilleurs résultats que l’intensification après échec d’une monothérapie au méthotrexate (DAS28 ≥ 3,2 après 24 semaines) ?
- L’association étanercept + méthotrexate est-elle supérieure à l’association triple de DMARDs (« méthotrexate + sulfasalazine + hydroxychloroquine ») ?
Dans ce but, les patients ont été répartis au hasard dans 4 bras :
- traitement immédiat par étanercept + méthotrexate (groupe IE)
- traitement immédiat par association triple (groupe IT)
- traitement intensifié par étanercept + méthotrexate après échec à la 24ème semaine de la monothérapie de méthotrexate (groupe SE)
- traitement intensifié par trithérapie conventionnelle après échec à la 24ème semaine de la monothérapie de méthotrexate (groupe ST)
Le critère principal de jugement de l’efficacité du traitement était l’évolution du score d’activité DAS28 entre les semaines 48 et 102.
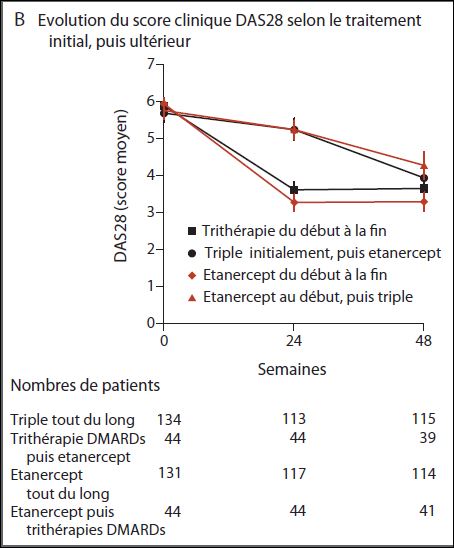
Le graphique ci-après présente l’évolution de l’activité de la maladie mesurée par le score DAS28 tout au long des 2 ans de suivi pour les 4 groupes de patients.
Cliquer sur l’image pour télécharger l’étude TEAR (en accès libre)
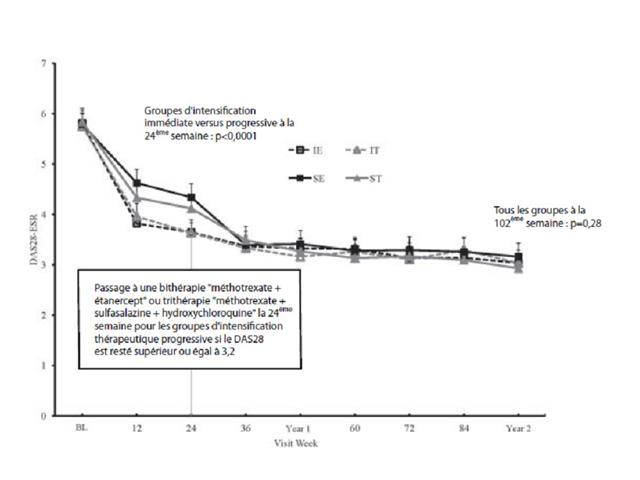
A la 24ème semaine :
- Parmi les patients des deux bras ayant reçu du méthotrexate seul (groupes SE et ST), 28% sont en rémission,
- Les patients ayant bénéficié d’un traitement intensif d’emblé, présentaient une plus forte réduction de l’activité de la maladie (3,6 versus 4,2 ; p < 0,0001), sans différence entre les différents traitements médicamenteux.
Cette différence disparaissait entre les semaines 48 et 102, quelque soit le traitement.
Aucune différence significative n’est observée sur le DAS28 entre les patients ayant reçu la trithérapie de DMARDs conventionnels et ceux traités par l’association étanercept + méthotrexate.
Pas de différence significative n’ont plus sur la proportion des patients dans chaque groupe en rémission (IE = 56,6%, IT = 59,1%, SE = 52,9%, ST = 56,5%, p=0,93), quelque soit le moment d’intensification du traitement, immédiat ou après échec de la monothérapie initiale (p=0.36) ou le traitement reçu, trithérapie ou étanercept + méthotrexate (p=0.43).
Aucune différence n’était observée à l’inclusion et pendant l’essai en termes de corticothérapie. La tolérance était comparable dans les deux groupes (même si la tendance n’est pas favorable à l’étanercept, avec deux fois plus d’événements indésirables graves, d’infections, les différences ne franchissent pas le seuil de significativité)
Les données radiographiques à la 102ème semaine montrent une modeste différence, statistiquement significative (p=0,047) dans la progression moyenne des dommages articulaires en faveur de l’étanercept. Néanmoins, la progression du score de Sharp, supérieure d’un seul point avec la trithérapie (0,64 versus 1,69), est considérée sans effet de signification clinique en termes d’invalidité selon les auteurs de l’étude.
Les auteurs jugent donc l’efficacité clinique de la trithérapie équivalente à celle obtenue avec l’association méthotrexate + étanercept
L’étude a également permis d’établir que si les patients ne répondent pas à la monothérapie initiale de méthotrexate, dès la 12ème semaine il est opportun d’intensifier le traitement 18.
2.3. L’étude suédoise publiée en ligne le 1er juillet 2013 6,7 :
En prolongement aux résultats déjà publiés de l’essai « Swefot » (Cf. infra), ce travail se proposait de mesurer objectivement l’effet comparé d’un traitement par association infliximab (REMICADE®) + méthotrexate versus trithérapie méthotrexate + sulfasalazine + hydroxychloroquine dans la polyarthrite rhumatoïde au stade précoce, sur l’incapacité au travail (nombres de jours en arrêt de travail et pension d’invalidité), en exploitant le registre de la sécurité sociale suédoise.
Le graphique ci-dessous présente le nombre de jours de travail perdus chez les patients inclus dans l’essai Swefot et dans un groupe témoin exempt de polyarthrite rhumatoïde pendant toute la durée de l’étude.
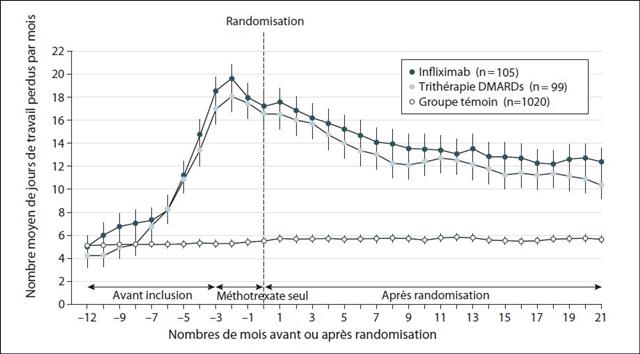
Les principaux résultats sont :
- En intention de traiter, la diminution du nombre de jours de travail perdus au 21ème mois était de -4,9 j/mois avec l’infliximab + mtx et de -6,2 j/mois pour la trithérapie (sans différence statistiquement significative),
- Entre l’inclusion et le 21ème mois, la proportion de patients sans perte de travail a augmenté de 27% à 42% dans le groupe infliximab + mtx (p<0,001) et de 32% à 47% dans le groupe trithérapie conventionnelle (p<0,001), sans différence entre les deux groupes (p=0,42),
- Simultanément, la proportion des patients en arrêt total de travail a baissé de 33% à 24% (p<0,001) et de 41% à 20% (p<0.001) respectivement, également sans différence entre les deux groupes (p=0,54) ;
La conclusion de ce travail est sans appel : « le traitement par biothérapie n’est pas supérieur au traitement conventionnel en termes de perte de jours de travail »
2.4. Les publications antérieures de l’étude suédoise « Swefot »
Les résultats cliniques de l’étude précédente avaient fait l’objet auparavant de deux publications successives. Un premier article présentant les résultats à un an de suivi, publié dans le Lancet en août 2009 19, puis dans un second les résultats après 24 mois de suivi dans le Lancet en mars 2012 20.
Dans cet essai randomisé, mais non conduit en double aveugle contrairement aux travaux de l’équipe américaine, 255 patients atteints d’une polyarthrite rhumatoïde active à un stade précoce (durée de moins d’un an) pris en charge dans 15 unités de rhumatologie en Suède entre décembre 2002 et décembre 2006, et qui après 3 à 4 mois d’instauration initiale d’un traitement par méthotrexate oral à la dose 20 mg/semaine, présentaient un DAS28 supérieur à 3,2, ont été tirés au sort pour recevoir en plus du méthotrexate soit de l’infliximab (3mg/kg, les semaines 0, 2 et 6, puis ultérieurement toutes les 8 semaines), soit 2 g de sulfasalazine en 2 prises, et 400 mg d’hydroxychloroquine (mêmes posologies que dans les essais américains). Le critère principal de jugement de l’efficacité clinique était le nombre de patients « bon-répondeurs » tel que défini par l’EULAR. A savoir, une baisse du score d’activité DAS28 de 1,2 point au moins et un DAS28 inférieur ou égal à 3,2.
Alors qu’une différence statistiquement significative était observée sur le critère de jugement principal en faveur de l’infliximab après 12 mois de traitement (50/128 soient 39% sous infliximab, versus 32/130, soient 25% pour la trithérapie, p=0,016), cette différence n’était plus significative après 18 mois (49/128, soient 38% versus 38/130, soient 29%), et après 24 mois (49/128, soient 38% versus 40/130, soient 31%, p=0,204). A 18 et 24 mois, aucune différence significative n’est également observée sur les autres critères de jugement d’efficacité (ACR20, ACR50, ACR70, Critères de réponse modérée à bonne définis par l’EULAR).
Une progression plus soutenue du score radiologique de Sharp est aussi constatée avec la trithérapie. Mais les auteurs n’écartent pas l’hypothèse d’une destruction articulaire beaucoup plus importante pendant la période initiale de traitement avec le méthotrexate seul qui aurait été préjudiciable aux patients sous trithérapie, laquelle pensent-ils demande un peu plus de temps pour être pleinement efficace que la biothérapie.
L’absence de double aveugle dans l’essai Swefot a été critiqué par l’équipe américaine, mais aussi par les suédois qui reconnaissent eux-mêmes l’existence de ce biais : « Une des limites de notre étude concerne la connaissance par les patients et les cliniciens des traitements alloués, du fait de la voie d’administration injectable pour l’infliximab et orale pour les médicaments de la trithérapie conventionnelle. Il est possible que les patients aient pu être plus fréquemment désireux d’arrêter le traitement par trithérapie conventionnelle au profit de la biothérapie, et que les médecins aient pu être influencés dans leurs évaluations du fait de ce biais ».
Quoiqu’il en soit, la conclusion de l’étude à 24 mois publiée en 2012 est sans équivoque : « Un traitement biologique (biothérapie) est une option valable pour les patients en échec d’un traitement initial par méthotrexate seul. Cependant, l’amélioration clinique à 12 mois et les meilleurs résultats radiologiques après 24 mois, doivent être mis en balance avec l’absence de différence clinique convaincante à 24 mois et les coûts très supérieurs. Ainsi, pour de nombreux patients en échec au méthotrexate seul, l’ajout des DMARDs conventionnels est une option appropriée ».
2.5. Les autres travaux antérieurs :
En examinant d’un peu plus près la bibliographie fournie avec les résultats de l’étude américaine 1, quelle n’est pas notre surprise de tomber sur un premier travail marquant, publié en 1996 par O’DELL et al. 21. Nous apprenons alors que la supériorité de l’association triple de DMARDs sur le méthotrexate seul dans la polyarthrite rhumatoïde active était déjà connue 17 ans auparavant…
Nous allions découvrir en « tirant sur la pelote de laine » que la ténacité de James R. O’DELL force vraiment l’admiration…
La supériorité de l’association triple découverte dès 1996 par O’DELL et al.21
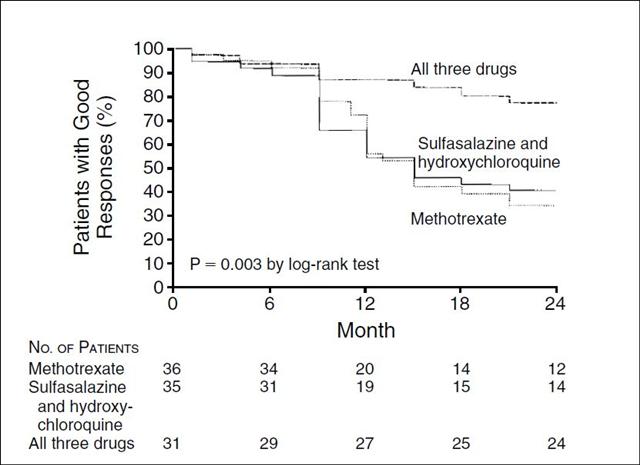
Cliquer sur l’image ci-dessus pour télécharger l’étude « pivot 22»
Une seconde étude 23 provenant du même groupe, publiée en 2002, avec également O’DELL comme premier auteur, confirme la nette supériorité après 2 années de suivi de l’association triple sur les associations binaires méthotrexate + sulfasalazine et méthotrexate + hydrochloroquine, ainsi que son excellente tolérance, puisque les arrêts de traitement sont comparables dans chaque groupe. Ci-dessous le graphique synthétisant les principaux résultats de ce travail en termes d’efficacité clinique :
Cliquer sur l’image ci-dessous pour télécharger la seconde étude publiée par le groupe de James R. O’DELL23
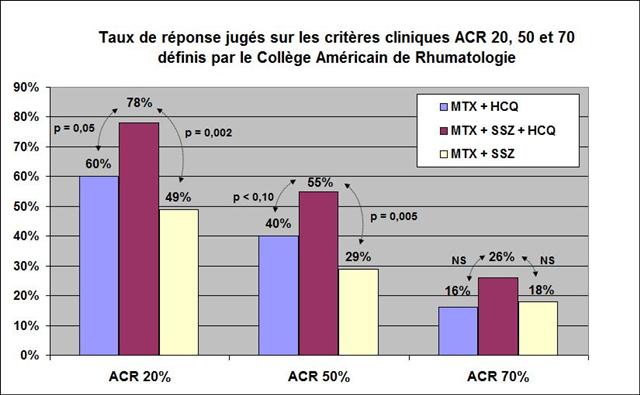
ACR 20% signifie qu’une amélioration de 20% a été obtenue grâce au traitement sur les nombres d’articulations douloureuses, les nombres de synovites, et sur au moins 3 des 5 items suivants : évaluation de la douleur du patient (échelle visuelle analogique), appréciation globale par le patient, par le praticien, auto questionnaire évaluant le handicap fonctionnel, marqueur biologique de l’inflammation. MTX = méthotrexate ; HCQ = hydrochloroquine ; SSZ = sulfasalazine. Les différences sont significatives pour un certain nombre d’items pris séparément, comme par exemple le nombre d’articulations douloureuses, la durée de raideur matinale, la vitesse de sédimentation (mesure de l’inflammation).
Cette seconde étude avait été conçue pour répondre aux questions soulevées par la première, et notamment celle de savoir si la triple thérapie était supérieure à chacune des deux bithérapies.
Il y a lieu de noter que la réponse ACR 20% obtenue avec la triple association chez 78% des patients, était parfaitement comparable aux 75% de répondeurs atteints avec l’étanercept (ENBREL®), dans une étude prise en compte la même année 2002 par la commission de la transparence (cf. infra) pour accorder à cette biothérapie une ASMR III par rapport au méthotrexate seul (progrès certes « modeste », mais qui lui garantissait à la fois le remboursement et aussi l’inscription ultérieurement sur la liste tant convoitée des médicaments onéreux remboursés en dehors de la tarification à l’activité, mais tout de même, faut-il le rappeler, à partir de nos cotisations…)
Les auteurs soulignaient dès 2002 la faiblesse des essais réalisés par les firmes, notamment en vue de l’enregistrement par la FDA des biothérapies aux USA (étanercept et infliximab), alors que ces stratégies n’avaient pas été comparées aux thérapeutiques (les plus) efficaces… (Cf. infra, les firmes ont constamment établi l’efficacité de leurs biothérapies sur la base de comparaisons au placebo ou au mieux au méthotrexate seul)
Ils rapportaient aussi les travaux publiés dans l’intervalle depuis leur « étude pivot » sur la triple association par deux autres groupes indépendants d’investigateurs, l’un finlandais, l’autre turque.
L’étude finlandaise, baptisée « FIN-RACo » (pour Finnish Rheumatoid Arthritis Combination Therapy trial) avait été publiée, s’il vous plait, dans la prestigieuse revue The Lancet en 1999 24. Cette étude multicentrique randomisée chez 199 patients présentant une polyarthrite rhumatoïde à un stade précoce, a comparé la triple association à une monothérapie débutée par la sulfasalazine, substituée par la suite par du méthotrexate chez 51 des 98 patients. L’obtention d’une rémission clinique à deux ans (critère principal de jugement), est 2 fois plus fréquente avec l’association triple (odds ratio 2,7 ; p = 0,003). La proportion de patients atteignant un ACR 50% après un et deux ans de traitement est respectivement de 75% et 71% pour l’association des trois molécules, contre 60% et 58% avec les monothérapies (p = 0,028 et 0,058). Les auteurs soulignent aussi dans une analyse publiée postérieurement 25, que les complications vertébrales de la polyarthrite rhumatoïde sont retardées avec la triple association. Les résultats du suivi à long terme (onze années après leur inclusion dans l’essai) des patients de l’étude finlandaise ont été publiés en 2010 26. Ils confirment la supériorité de cette stratégie initiale de traitement sur les monothérapies.
Cliquer sur l’image ci-dessous pour télécharger l’étude de suivi après onze années
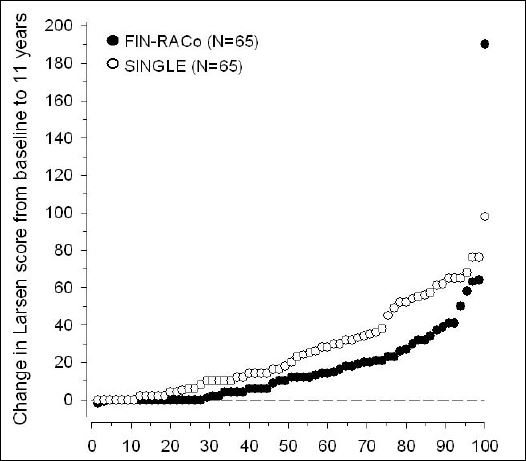
Pourcentage cumulé de l’augmentation du score de Larsen (calculé à partir des radiographies des mains et des pieds
obtenues à l’inclusion dans l’essai et 11 ans plus tard pour 130 patients initialement randomisés pour recevoir un traitement
par l’association triple ou une monothérapie). D’après Rantalaiho et al26.
L’étude turque, également publiée en 1999 27, dans une revue certes moins prestigieuse, ce qui ne nous a pas empêché de la retrouver pour vous, puisque PubMed ne permet que d’accéder à son résumé (ici). Ce travail mené chez 180 patients avec un suivi de 2 ans, confirme la supériorité de l’association triple sur les 3 monothérapies et les 2 bithérapies à base de méthotrexate, quelque soient les critères de jugement cliniques, biologiques et radiologiques (raideur matinale, doses requises d’AINS, nombre et proportion d’articulations douloureuses ou enflées, évaluation globale par le patient, par le praticien, Protéine C Réactive, vitesse de sédimentation, pourcentage de patient en rémission selon les critères de l’ACR, pourcentage de patients sans progression radiologique). Par exemple, les pourcentages de patients ayant atteints l’ACR 50% ont été respectivement de 31,5%, 44,6%, et 60,3% pour les monothérapies, bithérapies et la trithérapie (p=0.007 entre monothérapies et bithérapies, monothérapies et trithérapie et entre bithérapies et trithérapie).
Une recherche avancée dans PubMed avec les mots clés « rheumatoid arthritis ; methotrexate ; sulfasalazine ; hydroxychloroquine » :
Cliquer sur l’image ci-dessous pour lancer la recherche dans PubMed
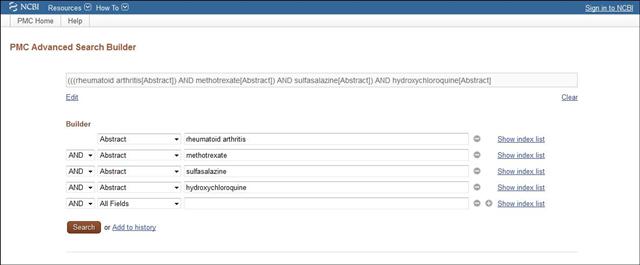
Une brève recherche bibliographique complémentaire effectuée par nos soins le 29/07/2013 dans PubMed (cliquer ici) retrouvait 234 résumés et citations, ainsi que 15 articles complets disponibles sur PubMed Central.
En se limitant à cette dernière sélection, il est alors possible d’établir que :
L’association triple (méthotrexate, sulfasalazine et hydrochloroquine), avait été reconnue supérieure au méthotrexate seul, car apportant une amélioration de 30% du rapport efficacité/tolérance, dans un article canadien proposant une revue générale et une méta-analyse de 19 essais randomisés, publié en ligne le 3 décembre 2008 28 et dont les auteurs avaient retenu justement l’essai précité de O’DELL et al., publié en 1996 21.
2.6. Les recommandations internationales
Elles seraient toutes à revoir pour prendre en compte les nouvelles données :
Les recommandations du Collège Américain de Rhumatologie (ACR) :
- Prise en charge médicamenteuse de la polyarthrite rhumatoïde, actualisation 2012 des recommandations 2008, publiées en mai 2012 29 (La recherche bibliographique s’est arrêtée au 26 février 2010 ! Même si la trithérapie est citée, noyée dans les innombrables associations possibles, elle ne fait l’objet d’aucune recommandation spécifique),
- Mesure de l’activité de la maladie dans la PR, publiées en mai 2012 30
La revue d’efficacité comparative des médicaments dans la PR réalisée par l’AHRQ (Agency for Healthcare Research and Quality, équivalente à notre Haute Autorité de Santé, à ceci près qu’elle n’est pas habilitée à produire elle-même des recommandations pour la pratique clinique…), publiée en avril 2012 31 (Un document de 1.073 pages ! La recherche bibliographique a été réalisée sur la période 1980 - février 2011. Elle conclue en l’absence de différence importante d’efficacité entre les différents DMARDs (méthotrexate, sulfasalazine, leflunomide), et pour les biothérapies entre abatacept et infliximab. Néanmoins, l’association de plusieurs DMARDs est reconnue comme plus efficace que le méthotrexate en monothérapie… Selon l’agence américaine, le nombre limité d’études comparatives ne permet pas de recommander un traitement plutôt qu’un autre…
La dernière recommandation du NICE (National Institute for Health and Care Excellence), Royaume Uni, publiée en février 2009 32. Un peu moins copieux avec ses 275 pages, ce texte reconnait que pour les symptômes, la qualité de vie, les chances d’obtenir une rémission, et le ralentissement de la destruction articulaire, « des associations variées de DMARDs » semblent supérieures au méthotrexate en monothérapie. Cependant, la trithérapie n’est pas citée. A l’époque, une place de choix avait été réservée aux biothérapies par le NICE.
Les recommandations de l’EULAR, association européenne de lutte contre le rhumatisme :
Les nouvelles recommandations de l’EULAR annoncées à grand fracas le 3 juillet 2013 33, ne sont toujours pas en ligne deux mois plus tard, tant l’embarras doit être grand (rappelons que le travail suédois a été publié le 1er juillet) : http://www.eular.org/index.cfm?framePage=/recommendations_management.cfm
Les précédentes dataient de 2010 34. Selon le récent communiqué de presse 33, elles soutiendraient même l’autorisation par l’agence européenne du médicament de biothérapie de Pfizer, le tofacitinib dont nous avons vu l’accueil glacial réservé par l’agence française…
Les recommandations françaises 2007 de la HAS (Polyarthrite rhumatoïde - Diagnostic et prise en charge initiale et Traitements de fond) ont été suspendues en raison de la mauvaise gestion des conflits d’intérêts des experts suite à une action intentée et « gagnée » par l’association FORMINDEP (pour une formation et une information médicales indépendantes de toute autre intérêt que celui de la santé des personnes) devant le Conseil d’Etat… La HAS planche actuellement pour les réactualiser, espérons qu’elle profite de cette opportunité pour intégrer à la fois l’efficience comme critère supplémentaire et les nouvelles données issues de la science. Ce qu’elle a bien réussi à faire avec les nouvelles recommandations portant sur le contrôle glycémique dans le diabète de type 2 publiées en début d’année 2013…
3. En quoi les autorités sanitaires se sont-elles laissées abuser par les firmes ? Retour
La commission de la transparence, mais aussi de nombreuses autres agences sanitaires dans le monde, ont accepté sans sourcilier de prendre en compte les études fournies par les firmes, comparant leurs biothérapies onéreuses au méthotrexate seul, voire au placebo, alors même que la nette supériorité de la triple association méthotrexate, sulfasalazine, hydroxychloroquine sur le méthotrexate seul était établie depuis 1996 21…
Le lecteur pourra lire chacun des avis de la commission de la transparence portant sur la totalité des biothérapies indiquées dans la PR (REMICADE® 35-37 , ENBREL® 38-40 , HUMIRA® 41-44, CIMZIA® 45, SIMPONI® 46, KINERET® 47, 48, MABTHÉRA® 49, ORENCIA® 50-52, ROACTEMRA® 53), pour constater que le comparateur dans chaque essai thérapeutique randomisé est systématiquement le méthotrexate en monothérapie, voire un placebo (sauf une étude pour ENBREL® où le comparateur était la sulfasalazine seule 40)…
Alors que depuis 17 ans le comparateur qui s’imposait était la trithérapie méthotrexate + sulfasalazine + hydroxychloroquine, pourquoi avoir eu autant de sollicitude à l’égard des firmes ?
4. Conclusions et recommandations : Retour
Pour clore cette revue d’efficacité clinique des médicaments indiqués dans le traitement de fond de la polyarthrite rhumatoïde, voici quelles sont nos préconisations.
L’ASMR des biothérapies devrait être rétrogradée, et les spécialités concernées, radiées de la liste en sus pour cette indication (Voir : ici)
Ces nouvelles données acquises de la science doivent faire reconsidérer l’ASMR de niveau III (progrès modeste) accordé par la commission de la transparence aux « anti-TNF-α » dans la polyarthrite rhumatoïde. En effet, si l’on substituait au comparateur « méthotrexate seul » imposé opportunément par les firmes, l’association « méthotrexate + hydroxychloroquine + sulfasalazine », alors le progrès deviendrait nul…
Idem pour les biothérapies autres que les anti-TNF-alpha. Par exemple, l’ASMR de niveau II (progrès important) octroyé au MABTHÉRA® par la commission de la transparence 49, sur la base des résultats de l’étude REFLEX dans laquelle il était comparé au méthotrexate en monothérapie chez 520 patients ayant eu une réponse inadéquate à un ou plusieurs anti-TNF-alpha pendant 24 semaines. Dans la mesure où l’étude américaine publiée en juin 2013 montrait également une amélioration clinique significative avec la trithérapie chez les patients en échec au traitement par étanercept, et en l’absence d’étude réalisée avec le MABTHÉRA® versus la trithérapie, il est difficile d’apprécier la pertinence du niveau d’ASMR qui lui a été accordé…
Les recommandations pour la pratique clinique devraient aussi évoluer :
Si l’instauration initiale du traitement de fond de la polyarthrite rhumatoïde active au stade précoce peut encore faire appel au méthotrexate en monothérapie (à la dose de 25 mg/sem.), il semble que dès la 12ème semaine, la trithérapie conventionnelle puisse être proposée en 2ème intention aux patients non répondeurs (DAS28 > 3,2). Les biothérapies ne devant être envisagées qu’en 3ème (anti-TNF-alpha) et 4ème (autres biothérapies) intention chez les patients qui ne répondent plus ou toujours pas au traitement.
Les libellés des indications AMM dans la PR devraient être reprécisés
Pour les anti-TNF-alpha :
Pour HUMIRA® le libellé d’indication dans la polyarthrite rhumatoïde est le suivant : « Ce médicament, en association au méthotrexate, est indiqué pour le traitement de la polyarthrite rhumatoïde modérément à sévèrement active de l'adulte lorsque la réponse aux traitements de fond, y compris le méthotrexate, est inadéquate »
Pour ENBREL® : « Ce médicament en association au méthotrexate est indiqué pour le traitement de la polyarthrite rhumatoïde modérément à sévèrement active de l'adulte en cas de réponse inadéquate aux traitements de fond, y compris le méthotrexate »
Pour REMICADE® : « Ce médicament, en association avec le méthotrexate, est indiqué pour la réduction des signes et symptômes mais aussi l'amélioration des capacités fonctionnelles chez les patients adultes ayant une maladie active lorsque la réponse aux traitements de fond antirhumatismaux (DMARDs), dont le méthotrexate, a été inappropriée »
Pour CIMZIA® : « Ce médicament, en association au méthotrexate (MTX), est indiqué dans le traitement de la polyarthrite rhumatoïde (PR) active, modérée à sévère, de l'adulte, lorsque la réponse aux traitements de fond (DMARDs), y compris le méthotrexate, est inadéquate »
Pour SIMPONI® : « le traitement de la polyarthrite rhumatoïde active, modérée à sévère chez les adultes, lorsque la réponse aux traitements de fond antirhumatismaux (DMARD), y compris le MTX, a été inadéquate »
Pour les autres biothérapies :
Pour KINERET® : « KINERET est indiqué dans le traitement des signes et symptômes de la polyarthrite rhumatoïde en association avec le méthotrexate, chez les patients dont la réponse au méthotrexate seul n’est pas satisfaisante »
Pour MABTHERA® : « PR active, sévère, chez les patients adultes qui ont présenté une réponse inadéquate ou une intolérance aux traitements de fond, dont au moins un anti-TNF (inhibiteur du facteur de nécrose tumorale) »
Pour ORENCIA® : « Ce médicament, en association avec le méthotrexate, est indiqué dans le traitement de la polyarthrite rhumatoïde active modérée à sévère chez les patients adultes ayant eu une réponse inadéquate à un traitement antérieur par un ou plusieurs traitements de fond (DMARDs) incluant le méthotrexate (MTX) ou un inhibiteur du facteur de nécrose tumorale (TNF) »
Pour ROACTEMRA® : « Ce médicament, en association au méthotrexate (MTX), est indiqué pour le traitement de la polyarthrite rhumatoïde (PR) active, modérée à sévère, chez les patients adultes qui ont présenté soit une réponse inadéquate, soit une intolérance à un précédent traitement par un ou plusieurs traitements de fond (DMARDs) ou par un ou plusieurs antagonistes du facteur de nécrose tumorale (anti-TNF) »
Il conviendrait donc à présent de remplacer « méthotrexate », par « association méthotrexate, sulfasalazine, hydroxychloroquine » pour les anti-TNF-alpha.
Le prix exorbitant des biothérapies devrait être renégocié à la baisse par le CEPS
Les prix astronomiques qui ont été accordés aux firmes pour, en définitive, une amélioration nulle du service médical rendu par rapport à la trithérapie conventionnelle, devraient être renégociés par l’Etat français…
La promotion auprès des rhumatologues de la prescription de la trithérapie conventionnelle devrait être organisée par les pouvoirs publics
Les nouvelles données devraient être présentées aux rhumatologues en ville comme à l’hôpital, et une promotion de la prescription de la trithérapie conventionnelle auprès de ces praticiens devrait être réalisée en y mettant les moyens adéquats, vus les enjeux financiers, puisque les laboratoires Pfizer et Sanofi-Aventis qui commercialisent SALAZOPYRINE® (AMM en 1986) et PLAQUENIL® (AMM en 1962, source BDM IT) ne font et ne feront aucun effort pour promouvoir leurs vielles molécules qui rapportent « peanuts »
Une mission de plus à confier aux DAM (délégués de l’assurance maladie) et aux praticiens conseils des caisses ?
Remarque importante : Nous avons sollicité en vain pour l’instant l’Agence Nationale de Sécurité des Médicaments pour obtenir les données importantes dont elle dispose, et qui seules permettraient d’avoir une compréhension complète de l’évolution de la prescription des médicaments de traitement de fond de la polyarthrite rhumatoïde dans leur ensemble (mais aussi, pour de nombreuses autres classes thérapeutiques). Devant son manque de coopération et l’opacité dans laquelle manifestement elle préfère laisser les citoyens, usagers, patients, enfreignant la Loi du 17 juillet 1978, nous saisirons vraisemblablement la Commission d’accès aux documents administratifs (CADA) dans les délais légaux.
5. Bibliographie Retour
[1] Therapies for Active Rheumatoid Arthritis after Methotrexate Failure. James R. O’Dell et al. N Engl J Med 2013. DOI: 10.1056/NEJMoa1303006 (publié « online » le 11 juin 2013)
[2] Making Rational Treatment Decisions in Rheumatoid Arthritis When Methotrexate Fails. Joan M. Bathon and Donald J. McMahon. Editorial. N Engl J Med 2013. DOI: 10.1056/NEJMe1306381 (publié « online » le 11 juin 2013)
[3] Additifs à l’étude publiés en annexes (18 pages) : http://www.nejm.org/doi/suppl/10.1056/NEJMoa1303006/suppl_file/nejmoa1303006_appendix.pdf
[4] Déclaration des liens d’intérêts (66 pages) : http://www.nejm.org/doi/suppl/10.1056/NEJMoa1303006/suppl_file/nejmoa1303006_disclosures.pdf
[5] Protocole de l’étude (201 pages) : http://www.nejm.org/doi/suppl/10.1056/NEJMoa1303006/suppl_file/nejmoa1303006_protocol.pdf
[6] Biological vs Conventional Combination Treatment and Work Loss in Early Rheumatoid Arthritis - A Randomized Trial. Jonas K. Eriksson et al. JAMA Intern Med. doi:10.1001/jamainternmed.2013.7801 Published online July 1, 2013.
[7] Not Better but Quite Good Effects on Work Loss of Combination Treatment for Rheumatoid Arthritis With and Without Biological Agents. Invited Commentary. Edward Yelin. JAMA Intern Med Published online July 1, 2013.
[8] Polyarthrite rhumatoïde évolutive grave - Guide ALD - HAS, 04/2008 : http://www.has-sante.fr/portail/upload/docs/application/pdf/gm_polyarthrite_web.pdf
[9] Polyarthrite rhumatoïde évolutive grave - Actes et prestations ALD - HAS, actualisation 11/2012 : http://www.has-sante.fr/portail/upload/docs/application/pdf/lap_polyarthrite_web.pdf
[10] Extrait du compte-rendu de la réunion du 16 mai 2013 de la Commission d’évaluation initiale du rapport entre les bénéfices et les risques des produits de santé de l’ANSM (CR accessible ici) : « La dernière molécule est le Xeljanz (tofacitinib), indiquée pour la polyarthrite rhumatoïde. La molécule a été approuvée par la FDA en novembre 2012. Il s’agit d’un inhibiteur des voies JAK pas spécifiques. La posologie recommandée est de 5 mg ou 10 mg deux fois par jour. L’impact est important sur le système immunitaire (cellules T) et le système hématologique. Lors du premier dossier, il y a eu 21 objections majeures, portant principalement sur la qualité, l’efficacité et la sécurité d’emploi. Les problèmes de qualité ont été levés. En revanche, l’efficacité et le rapport bénéfice/risque ont été considérés comme insuffisants par le CHMP à l’unanimité. Xeljanz a, d'abord, été indiqué en deuxième ligne, c'est-à-dire chez des patients sous méthotrexate avant anti-TNF, mais les études n’étaient pas convaincantes. Une indication de troisième ligne a alors été proposée pour laquelle le laboratoire ne disposait d’aucune étude. La sécurité d’emploi pose des problèmes majeurs : augmentation des infections graves pulmonaires et opportunistes, lymphopénie, perforations digestives, atteintes hépatiques, augmentation du bilan lipidique, risque de cancer. De plus, les essais d’efficacité ont été effectués avec les deux doses, la dose de 2x5 mg préférée du fait des problèmes de sécurité diminuant le bénéfice observé. En outre, il n’y a pas de comparaison directe Xeljanz vs anti-TNF. Le vote du CHMP a ainsi été, à l’unanimité, négatif. La firme a toutefois fait appel de cette décision ».
[11] Points de repère n° 41 - juin 2013 - Une stabilité des dépenses du médicament de ville en 2011. Cnamts, 08/2013 : http://www.ameli.fr/fileadmin/user_upload/documents/Points_de_repere_n__41_Medicament_2011.pdf
[12] Analyse des ventes de médicaments en France en 2011. ANSM, 10/2012 : http://ansm.sante.fr/var/ansm_site/storage/original/application/0e689f733291d5ddbb09f0cccf93e438.pdf
[13] Analyse des ventes de médicaments en France en 2012. ANSM, 07/2013 : http://ansm.sante.fr/var/ansm_site/storage/original/application/20b465641b95468471d154b6006eb489.pdf
[14] Définition emprunté à l’article « Les critères d’évaluation de la polyarthrite rhumatoïde », I. BOUADDI et al. Rev Mar Rhum 2012;19:19-23 (en accès libre ici) : Le score DAS (Disease Activity Score) repose sur une formule mathématique complexe mais facilement utilisable en pratique courante avec l’aide de calculatrices ou sur l’ordinateur en combinant :
• Le nombre d’articulations douloureuses à la pression,
• Le nombre d’articulations gonflées,
• La vitesse de sédimentation globulaire à la première heure (VS)
• L’état général ou l’activité globale de la maladie évaluée par le patient sur une échelle visuelle analogique de 100 mm ;
Le DAS28 est actuellement le score le plus fréquemment utilisé pour l’évaluation de l’activité de la PR, que ce soit dans les études cliniques ou en pratique courante. Il intéresse 28 articulations. Les seuils suivants permettent de définir l’activité de la maladie :
• Activité élevée si DAS28 >5,1 ;
• Activité modérée si DAS28 >3,2 et ≤5,1 ;
• Activité faible si DAS28 ≤3,2 ;
• Rémission si DAS28 est <2,6.
[15] Triple Therapy as Good as Biologics for Rheumatoid Arthritis. Alice Goodman. Medscape.com 17/06/2013 : http://www.medscape.com/viewarticle/806430
[16] « PR : une trithérapie conventionnelle ferait jeu égal avec les biothérapies » Dr Isabelle CATALA. Medscape France 02/07/2013 : http://www.medscape.fr/rhumatologie/articles/1557789/
[17] A Randomized Comparative Effectiveness Study of Oral Triple Therapy Versus Etanercept Plus Methotrexate in Early Aggressive Rheumatoid Arthritis - The Treatment of Early Aggressive Rheumatoid Arthritis Trial (TEAR Trial). L. Moreland et al. ARTHRITIS & RHEUMATISM Vol. 64, No. 9, September 2012, pp 2824–2835 DOI 10.1002/art.34498: http://onlinelibrary.wiley.com/doi/10.1002/art.34498/pdf (accès libre)
[18] Clinical Response within 12 Weeks as a Predictor of Future Low Disease Activity in Early RA Patients: Results from the TEAR Trial. J.R. Curtis et al. J Rheumatol. Author manuscript; available in PMC 2013 June 27. Published in final edited form as: J Rheumatol. 2013 May; 40(5): 572–578. Published online 2013 April 15. doi: 10.3899/jrheum.120715 : http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3694569/pdf/nihms479364.pdf (accès libre)
[19] Addition of infliximab compared with addition of sulfasalazine and hydroxychloroquine to methotrexate in patients with early rheumatoid arthritis (Swefot trial): 1-year results of a randomised trial. R Van Vollenhoven et al. Lancet 2009;374:459-66: http://www.thelancet.com/journals/lancet/article/PIIS0140-6736%2809%2960944-2/abstract
[20] Conventional combination treatment versus biological treatment in methotrexate-refractory early rheumatoid arthritis: 2 year follow-up of the randomised, non-blinded, parallel-group Swefot trial. R Van Vollenhoven et al. Lancet 2012;379:1712-20: http://www.thelancet.com/journals/lancet/article/PIIS0140-6736%2812%2960027-0/fulltext#article_upsell
[21] Treatment of rheumatoid arthritis with methotrexate alone, sulfasalazine and hydroxychloroquine, or a combination of all three medications. O’DELL et al. N Engl J Med 1996;334:1287-91 : http://www.nejm.org/doi/pdf/10.1056/NEJM199605163342002 (accès libre)
[22] Etude pivot = Caractérise un essai clinique capital pour le développement d'un médicament (source : ici)
[23] Treatment of Rheumatoid Arthritis With Methotrexate and Hydroxychloroquine, Methotrexate and Sulfasalazine, or a Combination of the Three Medications. Results of a Two-Year, Randomized, Double-Blind, Placebo-Controlled Trial. O’DELL et al. ARTHRITIS & RHEUMATISM. Vol. 46, No. 5, May 2002, pp 1164–1170 : http://onlinelibrary.wiley.com/doi/10.1002/art.10228/pdf (accès libre)
[24] Comparison of combination therapy with single-drug therapy in early rheumatoid arthritis: a randomised trial. Timo Möttönen et al. Lancet 1999;353:1568–73 : http://www.thelancet.com/journals/lancet/article/PIIS0140-6736%2898%2908513-4/abstract
[25] Combination drug therapy retards the development of rheumatoid atlantoaxial subluxations. MH Neva et al. Arthritis Rheum 2000;43:2397–401 : http://onlinelibrary.wiley.com/doi/10.1002/1529-0131%28200011%2943:11%3C2397::AID-ANR4%3E3.0.CO;2-V/pdf (accès libre)
[26] Early combination disease-modifying antirheumatic drug therapy and tight disease control improve long-term radiologic outcome in patients with early rheumatoid arthritis: the 11-year results of the Finnish Rheumatoid Arthritis Combination Therapy trial. V. Rantalaiho et al. Arthritis Research & Therapy 2010, 12:R122 : http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2911916/pdf/ar3060.pdf (accès libre)
[27] Combination therapy versus monotherapy for the treatment of patients with rheumatoid arthritis. M. Çalgüneri et al. Clin. Exp Rheumatol. 1999 Nov-Dec;17(6):699-704 : http://www.clinexprheumatol.org/article.asp?a=1958
[28] Efficacy and toxicity of methotrexate (MTX) monotherapy versus MTX combination therapy with non-biological disease-modifying antirheumatic drugs in rheumatoid arthritis: a systematic review and meta-analysis. W Katchamart et al. Ann Rheum Dis 2009;68:1105–1112 ; Published online 03/12/2008 : http://ard.bmj.com/content/68/7/1105.full.pdf+html (accès libre)
[29] 2012 Update of the 2008 American College of Rheumatology Recommendations for the Use of Disease-Modifying Antirheumatic Drugs and Biologic Agents in the Treatment of Rheumatoid Arthritis. J. Singh et al. Arthritis Care & Research. Vol. 64, No. 5, May 2012, pp 625–639 DOI 10.1002/acr.21641: http://onlinelibrary.wiley.com/doi/10.1002/acr.21641/pdf ; Annexes (accès libre)
[30] Rheumatoid Arthritis Disease Activity Measures: AmericanCollege of Rheumatology Recommendations for Use in Clinical Practice. J. Anderson et al. Arthritis Care & Research Vol. 64, No. 5, May 2012, pp 640–647 DOI 10.1002/acr.21649: http://onlinelibrary.wiley.com/doi/10.1002/acr.21649/pdf (accès libre)
[31] Drug Therapy for Rheumatoid Arthritis in Adults: An Update. Comparative Effectiveness Reviews, No. 55. Agency for Healthcare Research and Quality (US); 04/2012 : http://www.ncbi.nlm.nih.gov/pubmedhealth/n/cer55/pdf/ (accès libre)
[32] Rheumatoid Arthritis - National clinical guideline for management and treatment in adults. The National Collaborating Centre for Chronic Conditions (Funded to produce guidelines for the NHS by NICE). Published by the RoyalCollege of Physicians. 02/2009 : http://www.ncbi.nlm.nih.gov/pubmedhealth/n/nicecg79/pdf/ (accès libre)
[33] EULAR issues updated rheumatoid arthritis (RA) management recommendations. Press Release. EULAR, 3 July 2013: http://www.eular.org/myUploadData/files/EULAR_RA_recommendations_FINAL.pdf (accès libre)
[34] EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Josef Smolen et al. Ann Rheum Dis 2010;69:964–975. doi: 10.1136/ard.2009.126532. Published Online First 5 May 2010: http://ard.bmj.com/content/69/6/964.full.pdf+html (accès libre)
[35] REMICADE®, avis de la commission de la transparence (motif : Inscription au remboursement), HAS, 08/11/2000 : http://www.has-sante.fr/portail/upload/docs/application/pdf/ct010389.pdf
[36] REMICADE®, avis de la commission de la transparence (motif : Modification des conditions d’inscription dans la polyarthrite rhumatoïde notamment), HAS, 01/09/2004 : http://www.has-sante.fr/portail/upload/docs/application/pdf/ct031623.pdf
[37] REMICADE®, avis de la commission de la transparence (motif : Nouvelle indication dans la polyarthrite rhumatoïde chez les naïfs de méthotrexate, notamment), HAS, 26/04/2006 : http://www.has-sante.fr/portail/upload/docs/application/pdf/ct032588.pdf
[38] ENBREL®, avis de la commission de la transparence (motif : Inscription au remboursement), HAS, 02/10/2002 : http://www.has-sante.fr/portail/upload/docs/application/pdf/ct021184.pdf
[39] ENBREL®, avis de la commission de la transparence (motif : dépôt de nouvelles données dans l’indication « Polyarthrite rhumatoïde »), HAS, 16/07/2008 : http://www.has-sante.fr/portail/upload/docs/application/pdf/2008-08/ct-5041_enbrel.pdf
[40] ENBREL®, avis de la commission de la transparence (motif : renouvellement de l’inscription au remboursement), HAS, 04/02/2009 : http://www.has-sante.fr/portail/upload/docs/application/pdf/2008-11/enbrel_-_ct-5041.pdf
[41] HUMIRA®, avis de la commission de la transparence (motif : Inscription au remboursement), HAS, 16/06/2004 : http://www.has-sante.fr/portail/upload/docs/application/pdf/ct031580.pdf
[42] HUMIRA®, avis de la commission de la transparence (motif : Nouveau libellé d’indication), HAS, 15/09/2004 : http://www.has-sante.fr/portail/upload/docs/application/pdf/ct031648.pdf
[43] HUMIRA®, avis de la commission de la transparence (motif : Nouvelles indications, notamment dans la polyarthrite rhumatoïde chez le patient naïf de méthotrexate), HAS, 02/11/2005 : http://www.has-sante.fr/portail/upload/docs/application/pdf/ct032293.pdf
[44] HUMIRA®, avis de la commission de la transparence (motif : Renouvellement de l’inscription au remboursement), HAS, 05/05/2010 : http://www.has-sante.fr/portail/upload/docs/application/pdf/2011-05/humira_-_ct7304.pdf
[45] CIMZIA®, avis de la commission de la transparence (motif : Inscription Sécurité Sociale et Collectivités), HAS, 10/03/2010 : http://www.has-sante.fr/portail/jcms/c_938150/fr/cimzia-ct7358
[46] SIMPONI®, avis de la commission de la transparence (motif : Inscription Sécurité Sociale et Collectivités), HAS, 01/02/2012 : http://www.has-sante.fr/portail/jcms/c_1218486/fr/simponi-01022012-avis-ct11419
[47] KINERET®, avis de la commission de la transparence (motif : Inscription Collectivité), HAS, 10/07/2002 : http://www.has-sante.fr/portail/upload/docs/application/pdf/ct021116.pdf
[48] KINERET®, avis de la commission de la transparence (motif : renouvellement de l'inscription sur la liste des spécialités remboursables aux assurés sociaux), HAS, 06/02/2008 : http://www.has-sante.fr/portail/upload/docs/application/pdf/ct-5203_kineret_.pdf
[49] MABTHÉRA®, avis de la commission de la transparence (motif : Inscription Collectivités dans l’extension d'indication « traitement de la polyarthrite rhumatoïde chez les patients ayant eu une réponse inadéquate à un ou plusieurs traitements de fond conventionnels incluant le MTX» et ajout des pédiatres comme prescripteurs), HAS, 13/12/2006 : http://www.has-sante.fr/portail/upload/docs/application/pdf/mabthera.pdf
[50] ORENCIA®, avis de la commission de la transparence (motif : Inscription Collectivité), HAS, 18/07/2007 : http://www.has-sante.fr/portail/upload/docs/application/pdf/ct-5592_orencia_.pdf
[51] ORENCIA®, avis de la commission de la transparence (motif : Inscription remboursement, sortie de réserve hospitalière), HAS, 08/07/2009 : http://www.has-sante.fr/portail/upload/docs/application/pdf/2009-07/orencia_-_ct-6601.pdf
[52] ORENCIA®, avis de la commission de la transparence (motif : Inscription Collectivités dans l’extension d'indication « traitement de la polyarthrite rhumatoïde chez les patients ayant eu une réponse inadéquate à un ou plusieurs traitements de fond conventionnels incluant le MTX» et ajout des pédiatres comme prescripteurs), HAS, 14/03/2012 : http://www.has-sante.fr/portail/upload/docs/application/pdf/2012-04/orencia_14032012_avis_ct10284.pdf
[53] ROACTEMRA®, avis de la commission de la transparence (motif : Inscription Collectivités), HAS, 09/09/2009 : http://www.has-sante.fr/portail/upload/docs/application/pdf/2009-10/roactemra_-_ct-6352.pdf
6. Annexes - Détail du calcul des coûts annuels de traitement
Retour
Sources : Posologie dans Thériaque®, coûts des médicaments donnés par la BdM IT (base des médicaments et informations tarifaires) de la Cnamts pour les DMARDs conventionnels, donnés par le fichier des médicaments onéreux tenu à jour par l’ATIH pour les spécialités inscrites sur la liste en sus. Les posologies d’entretien ou maximales ont été prises en compte dans le calcul.
- MÉTHOTREXATE voie orale : IMETH® 10 mg 10 comprimés sécables : 10,48 € TTC ; Posologie = 25mg par semaine >>> 2,5 cpr x 52/10 = 13 boites = 136,24 € TTC
- MÉTHOTREXATE voie injectable : METOJECT 10 MG/ML 1 Boite de 1, 2,5 ml en seringue préremplie + aiguille d'injection, solution injectable = 27,65 € TTC depuis le 1er janvier 2012 >>> 1.437,80 € TTC
- SALAZOPYRINE® 500 MG 1 Boite de 100, Comprimes enrobes gastro-resistants = 14,07 € TTC depuis le 1er janvier 2012. Posologie : 4 cpr /j >>> 4x365/100 = 14,6 boites / an = 205,42 € TTC
- PLAQUENIL® 200 mg boite 30 comprimés : 5,33 € TTC depuis le 1er janvier 2012 ; Posologie 200 à 400 mg/j >>> 2 comprimés par jour >>> 365 x 2 / 30 = 24,33 boites / an = 129,70 € TTC
- ARAVA® 20 MG Boite de 30, comprimes pellicules : 71,98 € TTC ; Posologie 20 mg /j >>> 365/30 = 12,167 boites / an = 875,76 € TTC
- Cyclosporine : NEORAL 100 MG 1 Boite de 60, capsules molles = 6.000 mg par boite= 232,93 € TTC depuis le 1er janvier 2012 >>> 3x365/60 = 18,25 boites = 4.250,97 € TTC (A 216,46 € TTC la boite de 50 capsules, SANDIMMUN® est plus cher)
- IMUREL 50 MG Boite de 100, comprimes pellicules : 29,81 € TTC la boite ; Posologie 150mg/j >>> 3 x 365 / 100 = 10,95 boites = 326,42 € TTC
- ALLOCHRYSINE® 25, 50 ou 100 mg 1 Ampoule de 2 ml + 8 ml de diluant en ampoule, solution injectable IM : 4,17 à 5,33 € TTC par ampoule ; Posologie 25, 50 ou 100 mg par semaine >>> 52 ampoules = 277,16 € TTC
- TROLOVOL 300 MG 1 Boite de 30, comprimes pellicules : 17,55 € TTC ; Posologie = 600 mg /j >>> 2 x 365 / 30 = 24,333 boites/an = 427,05 € TTC
- ACADIONE® 250 MG 1 Boite de 120, comprimes enrobes : 58,18 € TTC ; Posologie 1.000 à 1.500 mg/j >>> 4 à 6 cpr/j >>> 6 x 365 / 120 = 18,25 boites/an = 1.061,79 € TTC
- ENBREL® 50mg = 223,602 € TTC le flacon, soient 894,41 € TTC les 4 flacons depuis le 24/04/2013
50mg/sem >>> 52 flacons/an = 11.627 € TTC
- HUMIRA® 40mg = 425,762 € TTC le flacon à compter du 01/08/2013
40mg/sem ou toutes les 2 semaines >>> 26 à 52 flacons/an = 11.070 à 22.140 € TTC
- REMICADE® 100mg = 520,169 € TTC le flacon depuis le 01/10/2010, 492,806 € TTC depuis le 01/06/2011 >>> 1 an de traitement = pour 70 kg
En cas de réponse : 3mg/kg >> 210 mg arrondis à 200 mg = 2 flacons les semaines 1, 3, 7, 15, 23, 31, 39, 47 = 16 flacons = 7.885 € TTC
En cas de non réponse, 2 schémas
- 4,5 à 7,5mg/kg toutes les 8 semaines >>> 315 à 525 mg, soient 3 à 5 flacons toutes les 8 semaines = 20 à 33 flacons = 9.856 à 16.263 € TTC
- 3mg/kg toutes les 4 semaines >>> 210 mg, soient 2 flacons toutes les 4 semaines = 26 flacons =
12.813 € TTC
- CIMZIA® 200 mg = 390,022 € TTC, la seringue injectable depuis le 30/11/2010 >>> Coût de traitement la 1ère année : 3 premières injections à 400 mg, puis 23 injections à 200mg, soient 29 seringues = 11.311 € TTC
- SIMPONI® 50mg = 845,388 € TTC la seringue ou le stylo injectables depuis le 28/09/2012 >>> 1 an de traitement = 12 (poso usuelle = 50 mg/mois ; poso maximale pour les patients de plus de 100 kg qui n’obtiennent pas de réponse clinique satisfaisante après 3 ou 4 doses = 100 mg/mois) administrations mensuelles d’une dose, soient 12 à 24 seringues ou stylos = 10.145 € TTC à 20.289 € TTC
- MABTHÉRA® 500 mg= 1.346, 035 € TTC le flacon de 500mg ; Posologie usuelle : 1.000 mg à deux semaines d’intervalle + éventuel nouveau cycle à la 24ème semaine >>> 2 x 2 flacons = 5.384 € TTC (hors prémédications qui doivent être systématiques : corticoïdes + analgésique/antipyrétique (ex : paracétamol) + antihistaminique (ex : diphénhydramine)
- ROACTEMRA® 20MG/ML INJ FL 10ML = 340,034 € TTC le flacon de 10ml depuis le 1er avril 2013
8mg/kg >>> 600mg 1 semaine sur 4 >>> 3 flacons x 13 = 13.261 € TTC
- ORENCIA® 250MG PDR INJ FL = 373,849 € TTC depuis le 11 janvier 2013. Poso initiale = 500 mg/admin une semaine sur 2 pendant les 6 premières semaines ; poso d’entretien = 500mg /admin. toutes les 4 semaines >>> 14,5 administrations par an = 5.421 € TTC
- KINERET 100MG/0,67ML SOL INJ SER = 844.58 € TTC la boite de 28 seringues depuis le 1er janvier 2012 ; Posologie : injection quotidienne >>> 13 boites/an = 10.980 € TTC
12/04/2013 - « Les DAM, si on les utilise à tort, ils deviendront moins fort ! » - Hypertension artérielle : La « non qualité » de la prescription, un « cancer » qui s’est généralisé à l’ensemble des cinq classes recommandées entre 2001 et 2011
5ème (et dernier) Épisode - Antihypertenseurs : Les pouvoirs publics prendront-ils les décisions qui s’imposent ? Proposons-leur une feuille de route…
Une version imprimable de l’article complet repaginé au format pdf est téléchargeable ici
L’Assurance Maladie devrait se damner d’avoir remboursé autant (jusqu’à 1,9 milliards d’euros en 2008) pour des prescriptions aussi peu conformes aux données acquises de la science, et dont le seul rationnel semble avoir été l’effort promotionnel consenti par les firmes pharmaceutiques.
Les médicaments prescrits pour traiter l’immense majorité des françaises et des français hypertendus ne sont pas ceux pour lesquels nous disposons des meilleures preuves d’efficacité clinique !
L’étude de l’évolution de la prescription entre 2001 et 2011 à l’intérieur des 5 classes médicamenteuses recommandées dans l’hypertension, au travers de l’analyse des fichiers détaillés de remboursement de l’assurance maladie, nous amène à faire ce constat douloureux tant pour les diurétiques thiazidiques et apparentés, que pour les bêta-bloquants, les inhibiteurs calciques, et bien entendu, pour les inhibiteurs de l’enzyme de conversion (IEC) et les sartans…
Lancements de « me-too », de nouveaux dosages ou de nouvelles associations fixes, tous les coups des firmes auront été permis, avec la crédulité des médecins et la complicité des pouvoirs publics, pour devancer ou contourner l’arrivée des génériques dans l’hypertension artérielle lors de la dernière décennie…
Dans ce triste panorama, la visite des délégués de l’assurance sur le médicament, comme les incitations financières, contrats d’amélioration des performances individuelles (CAPI) puis paiement à la performance (P4P), n’auront pas été plus efficaces qu’un cataplasme sur une jambe de bois.
Quasi exsangue après une telle succession de baisses de prix drastiques, dans un communiqué de presse du 5 mars, le GEMME, association de 14 fabricants de génériques, dénonce enfin sans langue de bois la politique purement comptable du générique et l’immobilisme des pouvoirs publics pour agir une bonne fois pour toute sur la prescription des médecins ! Son analyse de début d’année était également très juste : « On ne peut que constater l’absence de résultat tangible des mesures mises en œuvre pour modifier les habitudes de prescription » (voir son communiqué de presse du 22/01/2013). D’où le retard considérable de la part du générique en France qui s'élève à seulement 26,7% des boites de médicaments remboursables, contre 50% en Allemagne et au Royaume Uni. Les médicaments de l’hypertension artérielle illustrent parfaitement ce laisser-faire de l'Etat français.
Au total, le constat fait par l'Institut PUPPEM est accablant :
- Une dérive collective de la prescription qui touche les 5 classes d’antihypertenseurs
- Les médicaments les mieux évalués à l’intérieur des cinq classes recommandées dans l’HTA sont loin d’être les plus prescrits
- Bien au contraire, les anciennes molécules sans soutien efficace des pouvoirs publics, sont délaissées par les prescripteurs au profit de fausses innovations sous l’effet de leur promotion massive par les firmes qui les commercialisent,
- Ni la visite des DAM, ni les échanges confraternels, ni les incitations financières n’auront eu raison des médecins
L’Institut PUPPEM vous invite à suivre la grande saga des antihypertenseurs au travers d’une série en 5 épisodes.
Une première cette année, car nous nous sommes livrés à l’analyse de l’évolution des prescriptions à l’intérieur des 5 classes recommandées dans l’HTA (et non pas seulement, des IEC et sartans)
PLAN GÉNÉRAL DE L’ARTICLE « LA GRANDE SAGA DES ANTIHYPERTENSEURS »
1. La dérive collective de la prescription à l’intérieur des 5 classes d’antihypertenseurs
2. La visite des DAM, les échanges confraternels, les incitations financières sont inopérants
3. Les recommandations disponibles sont biaisées par d’immenses conflits d’intérêts
4. Sortir du désordre orchestré par les firmes : Une feuille de route destinée aux pouvoirs publics
1. Le constat accablant d’une dérive collective de la prescription qui touche les 5 classes d’antihypertenseurs Retour au plan de l’article
Cliquer sur les liens ci-dessous pour revoir les 4 épisodes précédents de notre « grande saga des antihypertenseurs » :
1. Les Diurétiques thiazidiques et apparentés
2. Les bêta-bloquants !
3. Les inhibiteurs calciques
4. Les IEC, les sartans, et l’aliskiren
De tous ceci il ressort que les médicaments les mieux évalués à l’intérieur des cinq classes recommandées dans l’HTA sont loin d’être les plus prescrits
2. Ni la visite des DAM, ni les échanges confraternels, ni les incitations financières n’auront eu raison des médecins Retour au plan de l’article
2.1. La visite des DAM portant sur les médicaments de l’hypertension artérielle
Nous ne pouvons pas dire que la CNAMTS soit d’une grande transparence sur le sujet. Rien n’a filtré, que se soit sur le nombre de visites réalisées, leur fréquence chez le même médecin, et encore moins sur le contenu de ces éventuelles visites. Aucun bilan n’est disponible. Même Google ne trouve rien. Essayez la requête ici et vous constaterez que pratiquement rien ne remonte, sinon quelques-uns de nos articles. Le rapport annuel d’activité 2011 de la caisse nationale, encore accessible sur le site « L’assurance maladie recrute », mentionne tout juste 400.000 visites réalisées par les DAM cette année-là (et 64.000 échanges confraternels réalisés par des praticiens-conseils - No comment…), sans préciser le détail par thématique abordée. Déjà qu’ils ne sont pas bien nombreux, un millier face aux quelques 15 à 20.000 VM des labos. Alors si en plus leur productivité est 3 à 5 fois inférieure (moins de 2 visites par jour en moyenne par DAM, au-lieu de 6 au minimum pour les VM) ; Surtout, Google nous remonte en deuxième page la lettre d’information des professionnels de santé N°24 datant de juin 2009 de la CPAM des Landes (ici), qui nous présente le programme des DAM :
Extrait de la lettre d’information aux professionnels de santé adressée par la caisse des Landes - Cliquer sur l’image pour l’ouvrir

Avouez que vous n’enviez pas vraiment les DAM. 400 visites dans l’année, 10 thématiques différentes à porter chez les médecins généralistes (dont les IEC/sartans), mais ce n’est pas tout. Il faut aussi aller voir les pharmaciens pour qu’ils substituent des génériques, et les infirmiers pour leur présenter leur convention et des recommandations portant sur les pansements… Bon, ce n’est pas sérieux quoi !
Pas de visite des DAM, ou des visites si peu fréquentes, pas d’effet sur la prescription.
Pourtant l’efficacité de la visite médicale, qui n’est plus à démontrer, a été mesurée récemment par un thésard en Médecine générale, pour les IEC et sartans. La Cnamts ferait bien d’en prendre de la graine :
Eric FAVEREAU, du journal Libération, dans un article de juillet 2012 « Du poids du visiteur médical sur l’ordonnance » (ici) s’appuie sur la thèse d’un médecin breton, Etienne FOISSET, qui a étudié la relation entre les prescriptions observées chez 179 généralistes tirés au sort et la fréquence à laquelle ils reçoivent les visiteurs médicaux. La prescription des IEC et sartans, rapporte le journaliste, constitue l’un des exemples les plus frappants.
Le tableau ci-dessous, extrait de la thèse d’Etienne FOISSET, montre l’excellente corrélation entre la fréquence de réception des visiteurs médicaux et la part que le médecin accorde aux sartans par rapport aux IEC dans ses prescriptions...
Cliquer sur l’image pour télécharger la thèse de Médecine d’Etienne FOISSET
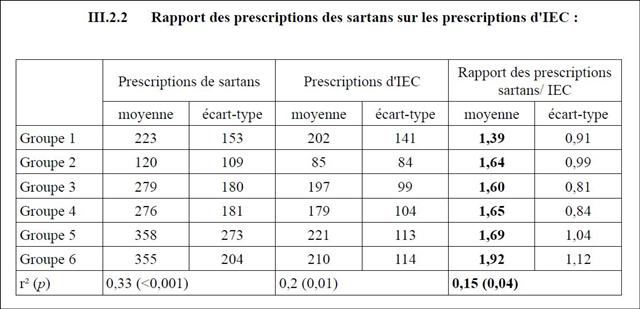
Les généralistes bretons ont été stratifiés selon le nombre de visiteurs reçus par demi-journée d’activité : groupe 1 = fréquence 0 ; groupe 2 = 0 à 0,19 ; groupe 3 = 0,20 à 0,39, groupe 4 = 0,40 à 0,59, groupe 5 = 0,60 à 0,99, groupe 6 = supérieure à 1 ;
A quand une thèse de médecine portant sur la corrélation entre la fréquence de la visite des DAM sur les antihypertenseurs et la prescription de généralistes ?
Il est vrai que nous aurions du mal avec les DAM, car ne dépassant pas une visite par thème et par an chez le même médecin, il est impossible de sortir la moindre statistique…
2.2. Echanges confraternels portant sur les médicaments de l’hypertension artérielle
En fouillant un peu plus (Merci Google), nous tombons sur une présentation faite en mars 2012 (ici), par la Caisse centrale d’assurance maladie des Bouches du Rhône et la Direction régionale du service médical PACA-Corse, sur l’accompagnement des professionnels de santé pour atteindre les objectifs de maîtrise médicalisée des dépenses ; Ô immense bonheur, nos fouilles archéologiques ne viennent-elles pas d’exhumer au grand jour d'importants supports de communication, remontant à la période paléolithique de l'ère glaciaire et destinés à influencer les médecins néandertaliens dans leur façon de prescrire les antihypertenseurs (pages 52 à 55).
Extrait d’un support de communication utilisé par la CCAM des Bouches-du-Rhône
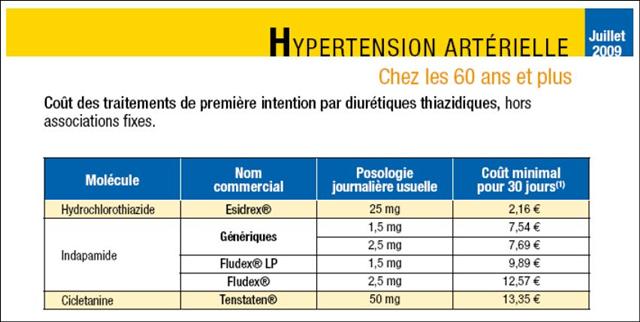
Dommage, ces documents qui n’ont vraiment rien de très sexy, sont datés de juillet 2009. En clair, circulez, il n’y a rien à voir. Bien que les antihypertenseurs flirtent avec les 2 milliards d’euros de remboursement annuel, il ne semble pas que l’assurance maladie ait mené de campagne sur ce thème en 2010, 2011, 2012…
2.3. Des incitations financières qui n’ont pas davantage donné de résultat
Le « P4P », paiement à la performance, est devenu à l’usage la « ROSP » pour « rémunération sur objectif de santé publique » (Voir « ROSPEZ malin » dans la Lettre UG ZAPPING N°69 du 21 janvier 2013 - Dr Claude BRONNER).
Dans le domaine de la prise en charge de l’hypertension artérielle, les objectifs 2012 dont l’atteinte conditionne ces jours-ci le versement de primes, étaient les suivants :
Thème / sous-thème | Indicateurs | Objectif
intermédiaire | Objectif
cible | Seuil minimal | Prime |
Le suivi des pathologies chroniques / Hypertension artérielle | Nombre de patients MT traités par antihypertenseurs dont la pression artérielle est ≤ à 140/90 mm Hg, rapporté à l’ensemble des patients MT traités par antihypertenseurs
|
50% |
≥ 60% |
20 patients |
280 € |
Efficience / Antihypertenseurs | Prescription (en nombre de boîtes) des antihypertenseurs dans le répertoire des génériques / l’ensemble des antihypertenseurs prescrits (en nombre de boîtes) |
64% |
≥ 65% |
130 boites |
385 € |
Efficience / IEC | Prescription (en nombre de boîtes) d’IEC/l’ensemble des IEC + sartans prescrits (en nombre de boîtes) |
45% |
≥ 65% |
50 boites |
385 €
|
Le hasard de l’actualité fait que la publication de notre article coïncide avec la mise en ligne hier par la Cnamts d’un dossier de presse « Rémunération sur objectifs de sante publique : une mobilisation des médecins et de l’assurance maladie en faveur de la qualité des soins ».
Nous y relevons :
« Optimisation des prescriptions / Efficience
Les résultats obtenus dans ce domaine par les médecins concernés sont plutôt satisfaisants. Le respect des recommandations de la Haute Autorité de Santé a ainsi progressé »
« … le recours aux IEC plutôt qu’aux sartans demeure à un taux presque inchangé de 39,6% »,
et « La progression (des génériques) est également notable pour les antihypertenseurs (13%) permettant de dépasser l’objectif cible fixé (65%). Ce phénomène est en partie lié en partie aux entrées dans le répertoire d’IPP, de statines et d’anti-hypertenseurs en 2012, mais ne se résume pas à ces facteurs ».
Décryptage :
La part des inhibiteurs d’enzyme de conversion (IEC) sur l’ensemble des prescriptions d’IEC et de sartans (en nombre de boites) est restée parfaitement stable, passant de 39,4% fin décembre 2011 à 39,6% (voir le tableau page 22 du dossier de presse). Ce qui signifie que les médecins n’ont absolument pas adhéré aux recommandations de la HAS contrairement à l’affirmation de la Cnamts qui voudrait nous faire prendre des « vessies pour des lanternes »…
Notons que le dossier de presse ne mentionne aucun résultat en rapport avec le 1er objectif du tableau ci-dessus, à savoir le contrôle tensionnel strict imposé par l’industrie du médicament à 140/90 mmHg, responsable de sur-prescriptions iatrogènes, notamment chez les personnes âgées (chutes +++) et inutiles chez les autres, puisque l’on sait aujourd’hui qu’à partir d’une baisse de 10 à 15 mmHg de la pression artérielle systolique, le maximum de bénéfice est obtenu en termes de morbi-mortalité (Prise en charge de l’hypertension artérielle en médecine générale - N° 1, 2 et 3. François GUEYFFIER. Médecine. Mars, avril et juin 2006, p118-22, p163-7 et p 258-60)…
50.584 médecins généralistes vont chacun percevoir en moyenne 4.982 Euros au titre de cette prime à la performance sur la réalisation des objectifs de l’année 2012… Un coût d’environ 250 millions d’euros pour la collectivité et qui manifestement n’aura produit aucune amélioration sur la qualité de prise en charge médicamenteuse des sujets hypertendus.
3. Des recommandations fortement biaisées par les conflits d’intérêts de leurs auteurs Retour au plan de l’article
Dans l’attente d’une nouvelle recommandation HAS sur la prise en charge du patient hypertendu, celle publiée en janvier 2013 par la SFHTA (Société Française de l’Hypertension Artérielle) est une caricature de ce qu’il ne faudrait plus jamais toléré dans notre pays.
Un article publié sur le site de l’association FORMINDEP « Pour une formation et une information médicales indépendantes de tout autre intérêt que celui de la santé des personnes », presque simultanément à celui-ci, fait la lumière sur la recommandation de la société savante :
« Faut-il suivre les dernières recommandations de la SFHTA sur la prise en charge de l’HTA de l’adulte et sur la mesure de la pression artérielle ? » :
4. Conclusion - Comment sortir du désordre orchestré par les firmes ? Une feuille de route à destination des pouvoirs publics Retour au plan de l’article
Il conviendrait de :
- Rendre immédiatement opérante la visite des DAM sur les antihypertenseurs, comme sur les autres médicaments, en lui fixant des objectifs et en la professionnalisant,
- Les principaux objectifs pour faire évoluer qualitativement la prescription, un enjeu à la fois sanitaire et médico-économique, sont le recul des sartans, de l’aliskiren, de la lercanidipine, du bisoprolol et du nébivolol, des associations fixes visant au contournement des génériques, au profit de médicaments mieux éprouvés et moins coûteux, les chefs de file des IEC (captopril, énalapril), l’amlodipine, …
- Inciter les fabricants de génériques et / ou autoriser l’AGEPS (Pharmacie Centrale des Hôpitaux de Paris) à produire et commercialiser de la chlortalidone à 12,5 et 25 mg, le diurétique apparenté aux thiazides pour lequel nous disposons du meilleur niveau de preuve d’efficacité sur la morbi-mortalité, que Novartis à arrêté de commercialiser (en France) pour des raisons mercantiles…
- Charger la HAS d’élaborer avec des experts indépendants et de publier rapidement maintenant une nouvelle recommandation en la matière. Elle pourra s’inspirer de ce qui a été fait par nos voisins britanniques il y a presque 2 ans déjà…
A lire aussi :
> Pour approfondir le sujet de la prise en charge de l’adulte hypertendu en médecine générale, nous vous proposons de lire la thèse de médecine extrêmement bien documentée, avec « cerise sur le gâteau », une enquête de pratiques réalisée chez 381 médecins généralistes du Val-d’Oise, de Charlotte FREISZ, téléchargeable ici, sur Voixmedicales.fr, le blog de l’expertise médicale généraliste indépendante.
A noter, les principaux enseignements de l’enquête menée en 2010-2011 par Charlotte FREISZ :
- Plus du tiers des médecins généralistes, ne privilégie qu’une seule classe d’antihypertenseurs en première intention, à savoir les sartans pour 71% et diurétiques thiazidiques dans moins de 20% !
- Sur l’ensemble des réponses (choix multiple possible) les scores obtenus en prescription de 1ère intention sont respectivement, 1. Sartans : 59% ; 2. IEC : 44% ; 3. Inhibiteurs calciques : 30% ; 4. Diurétiques : 28% ; 5. Bêta-bloquants : 15%
- Un 5ème seulement des MG du Val-d’Oise ont déclaré connaitre l’étude ALLHAT,
- Seulement 10% des MG ne reçoivent jamais de visiteurs médicaux,
- 53% des MG répondeurs ont déclaré recevoir la visite médicale plus d’une fois par semaine,
- Les médecins ayant déclaré prescrire un diurétique en 1ère intention sont plus fréquemment des lecteurs de la revue Prescrire et moins souvent des lecteurs du Quotidien du Médecin (56% vs 32%, p=0,0001). Ils ont moins souvent comme source d’information les visiteurs médicaux de l’industrie (37% vs 61%, p<0.0001).
> Pour comprendre l’urgence qu’il y a en France à agir pour améliorer la qualité de la prescription médicamenteuse :
Lire l’interview du Pr Bernard BÉGAUD, par Eric FAVEREAU, Libération 10/01/2013 : http://www.liberation.fr/societe/2013/01/10/sur-la-pilule-on-va-en-faire-trop-pour-ne-pas-en-avoir-fait-assez_873165
Morceaux choisis :
« Très rapidement, on aurait pu pointer l’évolution des ventes de ces nouvelles pilules, et s’en étonner… à la différence des autres pays européens, les pilules dites de 3e et 4e générations représentent la majorité des ventes et sont très souvent prescrites en première intention… Sans tenter de le corriger (le dérapage), on a laissé prendre la majorité du marché à des pilules qui sont faites pour une deuxième intention…. Mais ce fut la même chose avec le Mediator : on a noté qu’il était prescrit massivement hors autorisation de mise sur le marché, et on a laissé faire… Autre exemple : les psychotropes. On sait qu’il y a, en France, un abus de consommation et un mauvais usage. Trois rapports gouvernementaux l’ont noté ces dix dernières années et fait des propositions ; ils sont restés dans des tiroirs… Regardez les benzodiazépines : la moitié des utilisateurs en prennent pendant plusieurs années alors que ce devait être une prescription de quelques semaines. Nous sommes complètement en dehors des clous : si l’on ne fait rien, il est sûr qu’il y aura des problèmes… »
« Aujourd’hui, tout a changé : si l’on veut être efficace, il faut être proactif, aller au-devant des problèmes avant qu’ils ne deviennent crise, travailler sur ce qui risque de peser le plus, c’est-à-dire sur les médicaments les plus vendus, ou qui sont mal utilisés, ou mal prescrits. Car, là, les risques sont multipliés et deviennent intolérables, parce qu’il n’y a pas de bénéfice en face »
« Nous devrions en priorité lister les utilisations non conformes des médicaments »
« Si on le faisait, on éviterait des centaines de décès, mais aussi des milliards d’euros liés à la iatrogénèse, avec tous les préjudices provoqués par ces mauvaises utilisations. Ce nouveau paradigme n’arrive pas à s’imposer : on pouvait penser que le Mediator allait servir de déclencheur et on s’aperçoit que, pour l’instant, cela n’est toujours pas le cas »
Egalement, linterview du Pr B. BÉGAUD par Afsané SABOUHI au Nouvel Observateur, 12/01/2013 : http://pourquoi-docteur.nouvelobs.com/Pr-Bernard-Begaud--%C2%AB-La-prochaine-crise-du-medicament-est-deja-previsible-%C2%BB-1854.html
4ème Épisode - IEC, sartans, aliskiren : Que diable, par Satan, il faudrait un porte-voix à l’ANSM ! (En ligne le 05/04/2013) Retour au choix des classes d’antiHTA
Dix ans auront suffit aux sartans pour assoir leur règne sans partage sur les autres classes d’antihypertenseurs. Avec le quasi triplement du volume entre 2001 et 2011 (+177%, passant de 14,4 à 40,2 millions de boites remboursées), les sartans auront contribué à hauteur de 61% à l’augmentation globale des prescriptions d’antiHTA. En clair sur la période, six instaurations de traitement sur dix auront été faites dans cette classe…
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 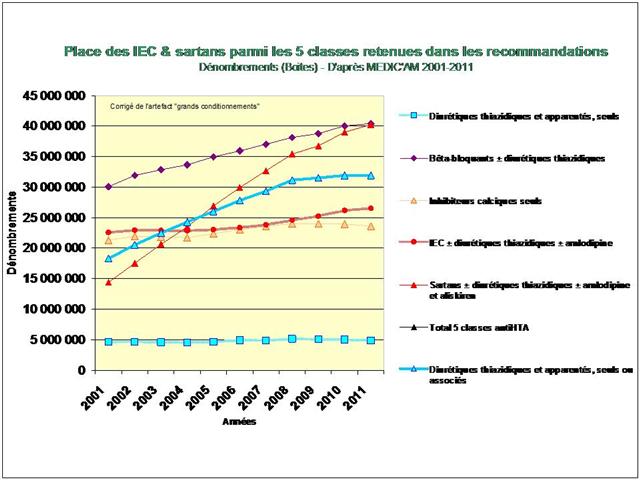
En 2011, les sartans (45,9%) et les IEC (21,7%) seuls ou associés à un diurétique thiazidique (indapamide pour le périndopril, hydrochlorothiazide pour tous les autres, cf. Diurétiques thiazidiques et apparentés) totalisaient 67,6% des remboursements pour antihypertenseurs par le régime général en métropole hors sections locales mutualistes.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 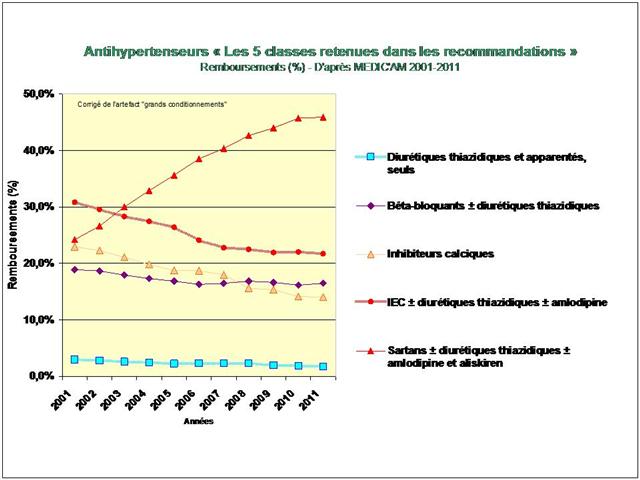
Après une stabilisation en 2008, une baisse des dépenses s’amorce en 2011 grâce aux médicaments qui ne sont plus promus
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 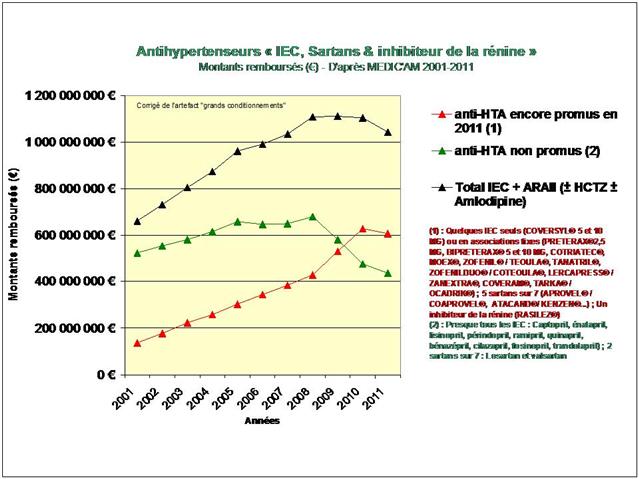
Les deux tableaux ci-après rassemblent les 12 principales dénominations communes d’IEC, les 7 sartans (encore appelés antagonistes des récepteurs de l’angiotensine II, ou ARAII), et l’aliskiren, unique représentant actuellement commercialisé en France appartenant à la nouvelle (sous-) classe des inhibiteurs directs de la rénine.
Tableau des 10 principaux inhibiteurs de l’enzyme de conversion (IEC)
DCI | Princeps | Firmes | Commercialisation ou AMM | Indications AMM |
Captopril | LOPRIL®/ÉCAZIDE®, CAPTÉA®/CAPTOLANE® | Bristol-Myers Squibb, Aventis | 1984 (génériqué en 1998) | HTA, ICC, IdM |
Énalapril | RÉNITEC®/CORÉNITEC® | MSD | 1985 (génériqué en 2000) | HTA, IC |
Lisinopril | ZESTRIL®/PRINIVIL®, PRINZIDE®/ZESTORETIC® | AstraZeneca / BMS | 1988 (génériqué en 2004) | HTA, IC, IdM, IRC |
Périndopril | COVERSYL®/PRÉTÉRAX®/
BIPRÉTÉRAX® | Servier | 1988 (génériqué en 2008) | HTA |
Ramipril | TRIATEC®/COTRIATEC® | Aventis | 1989 (génériqué en 2006 sauf COTRIATEC®) | HTA, IC, IDM… |
Quinapril | ACUITEL® / KOREC®, ACUILIX® / KORÉTIC® | Pfizer / Sanofi | 1990 (génériqué en 2006) | HTA, ICC |
Cilazapril | JUSTOR® | Chiési | 1992 | HTA, ICC |
Trandolapril | ODRIK® | Abott | 1993 | HTA, IdM |
Bénazépril | BRIEM® / CIBACÈNE®, BRIAZIDE® / CIBADREX® | Pierre Fabre, Meda Pharma | 1995 | HTA |
Fosinopril | FOZITEC® / FOZIRÉTIC® | Merck Lipha | 1995 | HTA , ICC |
Moexipril | MOEX® | Schwartz Pharma | 1998 | HTA |
Zofénopril | ZOFÉNIL® / ZOFÉNILDUO® | Ménarini | 2002 | HTA, IdM |
ICC = Insuffisance cardiaque congestive ; IC = Insuffisance cardiaque ; IdM = Infarctus du Myocarde ; IRC = Insuffisance rénale chronique - Source : Thériaque®
Tableau des 7 antagonistes des récepteurs de l’angiotensine II (ARAII) ou sartans, et de l’unique inhibiteur de la rénine commercialisé en France (Aliskiren)
DCI | Princeps | Firmes | Commercialisation ou AMM | Indications AMM |
Losartan | COZAAR® / HYZAAR®, FORTZAAR® | MSD | 1995 (génériqué en 2010) | HTA, IRC, ICC |
Irbésartan | APROVEL® / COAPROVEL® | Sanofi / Bristol-Myers Squibb | 1998 | HTA, IRC |
Éprosartan | TEVETEN® / COTEVETEN® | Solvay Pharma® | 1999 | HTA |
Valsartan | TAREG® / NISIS®, CO-TAREG® / NISISCO® | Novartis Pharma / Beaufour Ipsen, Aventis précédemment | 2000 (génériqué en 2011) | HTA, IdM |
Candésartan | ATACAND® / KENZEN®, HYTACAND® / COKENZEN® | AstraZeneca / Takéda | 2000 | HTA, IC |
Telmisartan | MICARDIS® / PRITOR®, MICARDISPLUS® / PRITORPLUS® | Boehringer Ingelheim / GSK | 2002 | HTA |
Olmésartan | OLMÉTEC ALTÉIS, CO-OLMÉTEC / ALTÉISDUO® | Daïchi Sankyo / Ménarini | 2004 | HTA |
Aliskiren | RASILEZ® / RASILEZ® HCT | Novartis |
| HTA |
ICC = Insuffisance cardiaque congestive ; IC = Insuffisance cardiaque ; IdM = Infarctus du Myocarde ; IRC = Insuffisance rénale chronique - Source : Thériaque®
Observons dans le détail l’évolution de la prescription
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 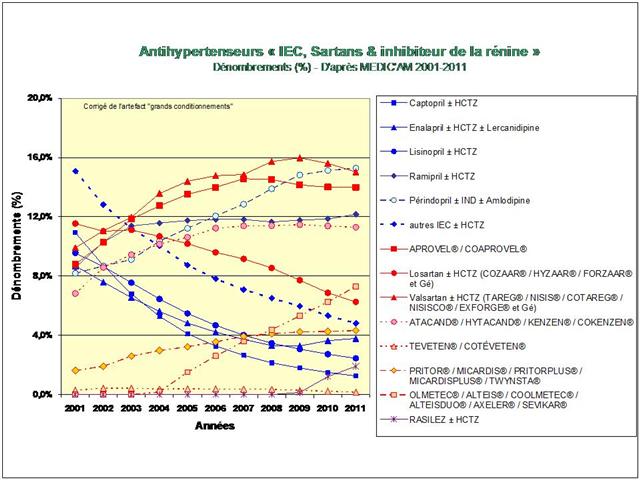
L'énalapril et le captopril sont tombés bien bas. Personne n'était là pour les défendre face aux fausses innovations largement promus par les firmes, pas même les DAM, et pourtant ils présentent les meilleurs rapports coût / bénéfice... Seuls Bouchara Recordati et Pierre Fabre ont pu légèrement doper leurs ventes en unissant l’énalapril à la lercanidipine (ZANEXTRA® / LERCAPRESS®), le mariage de la carpe et du lapin, ce qui a suffisamment relancé l’énalapril pour qu’il repasse devant le lisinopril (Cf. infra et aussi Les inhibiteurs calciques)
Le trio de tête reste inchangé :
1. Périndopril (COVERSYL®…et Gé), stratégie de contournement des génériques parfaitement réussie pour Servier : Lancement de nouveaux dosages non copiés, association fixe avec l’amlodipine (COVERSAM®),
2. Valsartan seul (TAREG®/NISIS®), associé à l’hydrochlorothiazide (COTAREG®/NISISCO®), ou à l’amlodipine (EXFORGE®),
3. Irbésartan (APROVEL®/COAPROVEL®),
Suivent, 1 IEC et 3 sartans :
4. Ramipril (TRIATEC®…et Gé, CO-TRIATEC® pas encore génériqué)
5. Candésartan (ATACAND®…)
6. Olmésartan (OLMETEC®…)
7. Losartan (COZAAR®… et Gé)
Même l’aliskiren (RASILEZ®), qui figure sur la liste noire de la revue Prescrire, a doublé le captopril et le telmisartan (PRITOR®…), malgré une étude décevante, a pris l’ascendant sur nos IEC chefs de file…
Observons quels sont les antihypertenseurs qui ont été affectés par des baisses de prix, sous l’effet des génériques et des négociations avec le comité économique des produits de santé (CEPS)
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 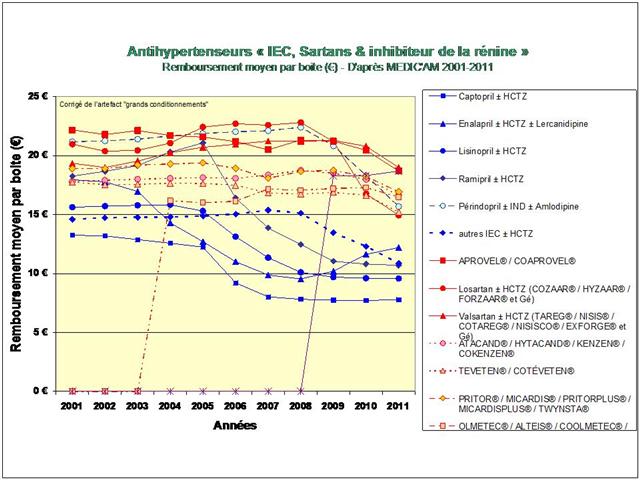
Les baisses de prix, estimées ici d’après le remboursement moyen par boite (équivalent conditionnement mensuel) affectent donc principalement les anciennes molécules, et ce d’autant plus qu’elles sont génériquées depuis longtemps : captopril (-41%, de 13,25€ à 7,79€), ramipril (-41%, de 18,25€ à 10,69€), lisinopril (-39%, de 15,62€ à 9,57€), losartan (-34%, de 22,80€, 14,94€), énalapril (-32%, de 17,95€ à 12,20€), périndopril (-26%, de 21,17€ à 15,68€), valsartan (-11%, de 21,29€ à 18,99€)…
Trois remarques à ce stade :
- Ces baisses de prix n’ont évidemment pas redonné aux médecins le goût de la prescription efficiente des molécules les moins coûteuses…
- Contrairement à nos voisins allemands, la politique de prix des médicaments menée en France préserve les fausses innovations coûteuses : Aliskiren, candésartan, telmisartan, olmésartan…, enrichie les labos dont la recherche est infructueuse, et appauvrie les usagers patients qui cotisent…
- L’énalapril qui était descendu sous les 10 € en 2008, ne doit sa remonté à 12,20 € en 2011 qu’aux 714.000 boites de LERCAPRESS® / ZANEXTRA® dans lesquelles il est associé à la lercanidipine (« mariage de la carpe et du lapin » ; Cf. infra et aussi Les inhibiteurs calciques). Si l’on exclu cette association du calcul, le remboursement par boite de l’énalapril s’est effondré à 7,10€ (-60%)
Les pharmaciens ont-ils bien substitué les princeps (médicaments de marque) par des génériques ?
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 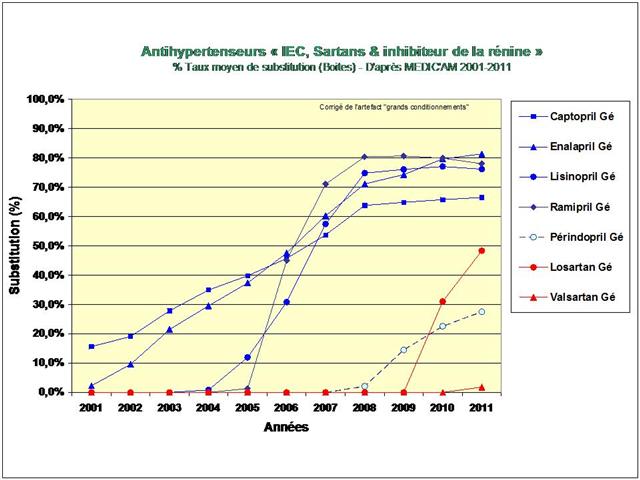
Les pharmaciens d’officine ont parfaitement joué le jeu de la maîtrise des dépenses en substituant au maximum les princeps des premiers IEC (entre 67 et 81%)
Le périndopril (COVERSYL®…) restait incroyablement peu substitué en 2011, et ce n’est pas la faute des pharmaciens, mais le fruit d’une stratégie de contournement des génériques particulièrement efficace de la part de Servier.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 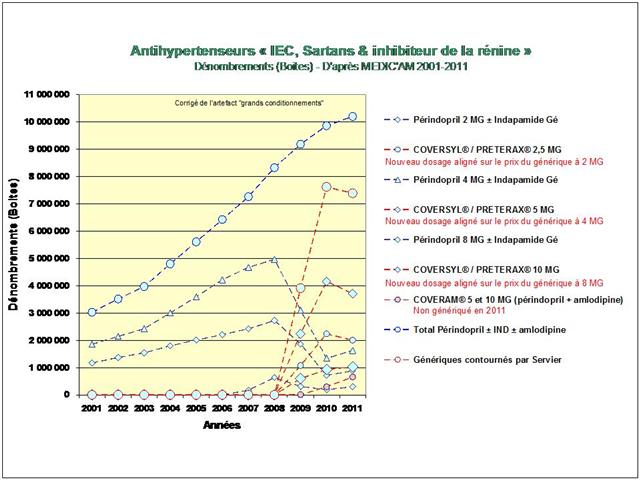
Servier, a su contourner les génériques, en mettant sur le marché 3 nouveaux dosages très voisins de ceux qu’il commercialisait déjà, ainsi qu’une association fixe avec l’amlodipine. La promotion avec les VM a fait le reste…
Dans une moindre mesure, Novartis sauve les meubles en associant l’amlodipine au valsartan dans EXFORGE®…
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 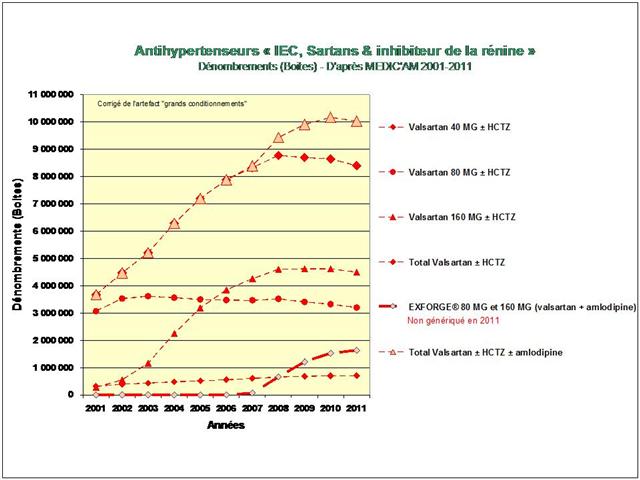
EXFORGE®, a permis au géant suisse de « sauver » 1,7 millions de boites de valsartan (équivalent boite 1 mois) et 38,5 millions d’euros en 2011…
Enfin, il suffit de jeter un œil aux coûts de traitement pour apprécier la marge d’économies réalisables si la prescription était plus efficiente
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 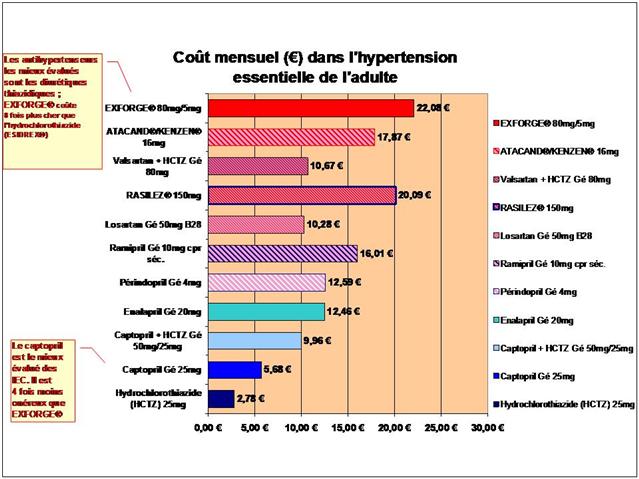
Alors, de quels arguments cliniques, fondés sur un bénéfice en termes de morbi-mortalité, dispose-t-on pour choisir entre IEC, sartans et aliskiren ?
Nous avons déjà beaucoup parlé ici même de ces 3 classes de médicaments dont le point commun est qu’ils agissent tous à un niveau ou à un autre sur le « système rénine - angiotensine ».
Nous renvoyons le lecteurs aux articles suivants, du plus récent (03/10/2012) au plus ancien (27/04/2007) : Les sartans ne sauvent pas de vies, contrairement aux IEC ; La plus grande « success story » de l’industrie du médicament… ; Les travaux embarrassants de Martin STRAUSS… ; La stratégie marketing des laboratoires pharmaceutiques sur les antiHTA ;
Que dire de plus ?
Ajoutons simplement qu'une nouvelle méta-analyse (la seconde à conclure ainsi), réalisée sur 26 études cliniques conduites chez 108.212 patients sans insuffisance cardiaque, publiée en janvier 2013, confirme le bénéfice des IEC sur la réduction de la mortalité globale contrairement aux sartans qui sont sans effet tangible sur ce critère ô combien primordial…
D’ailleurs, l’ANSM, notre agence du médicament (anciennement AFSSAPS) s’est pour l’occasion fendue d’un point d’information le 13 mars 2013 dans lequel elle affirme vigoureusement la place des IEC en première intention. Les sartans ne devant être prescrits qu’en cas d’intolérance aux IEC…
Qui a vu passer ce « point d’information » ? Qui en a tenu compte dans sa prescription ?
Alors, que diable, les DAM ne pourraient-ils pas se faire le porte-voix de l’ANSM ?
L’aliskiren seul (RASILEZ®) ou associé à l’hydrochlorothiazide (RASILEZ® HCT), et la triple association à doses fixes valsartan + amlodipine + hydrochlorothiazide (EXFORGE® HCT) font partie de ces médicaments dont la revue Prescrire recommande, compte-tenu de rapports bénéfices risques défavorables, l’arrêt de la prescription en attendant que les agences sanitaires les retirent du marché. Téléchargez l’article « Pour mieux soigner : des médicaments à écarter » en accès libre sur le site de la revue (ici).
A noter à contrario que le captopril, LOPRIL®, s’était vu décerné en 1983 la Pilule d’Or par la revue Prescrire… (Télécharger ici les 32 ans de palmarès Prescrire des médicaments)
Grâce à son association fixe avec la lercanidipine, inhibiteur calcique non évalué sur la morbi-mortalité, l’énalapril, l’un des meilleurs IEC, a pu repasser devant le lisinopril. Ainsi, le mariage de la carpe et du lapin, a donné naissance en 2011 à plus de 700.000 petites boites (en équivalents mensuels) et près de 14 millions d’euros de remboursements supplémentaires à l’assurance maladie pour LERCAPRESS® et ZANEXTRA®. « Ça c’est extra » (pardon pour ce jeu de mot un peu facile) pour Bouchara Recordati (et pour Pierre Fabre), non ?
3ème Épisode - Vent de panique chez les inhibiteurs calciques (En ligne le 29/03/2013) Retour au choix des classes d’antiHTA
Les inhibiteurs calciques (IC) n’arrivaient qu’en 4ème position en 2011 pour le nombre de boites remboursées (24 millions). Le volume de prescription des IC seuls a commencé à fléchir en 2009, et sur la décennie l’augmentation aura été modérée pour cette classe d’antihypertenseurs (+7%)
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives
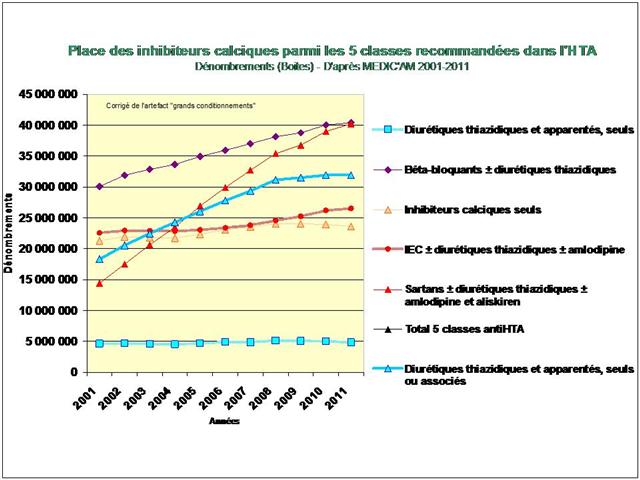
Cette « sagesse » relative par rapport aux autres classes, trouve une traduction dans l’évolution de la « part de marché » à l’intérieur des 5 classes d’antihypertenseurs, qui n’a cessé de s’effriter, passant de 23% à 14% entre 2001 et 2011.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives
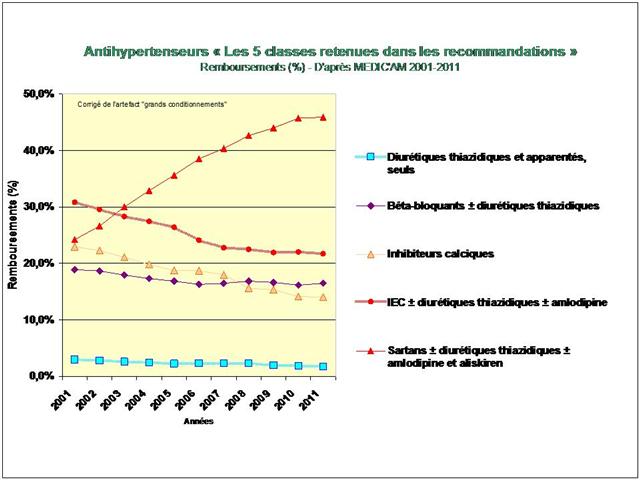
Le tableau ci-après présente les dix principaux représentants de cette classe dans l’ordre chronologique de leur introduction sur le marché français.
Tableau des principaux inhibiteurs calciques
DCI | Princeps | Firmes | Commercialisation ou AMM | Indications AMM |
Nifédipine | ADALATE® | Bayer | 1979 | HTA, Angor |
Nicadipine | LOXEN® | Novartis | 1986 | HTA |
Nitrendipine | BAYPRESS® | Bayer | 1987 | HTA |
Verapamil | ISOPTINE® | Abbott | 1989 (AMM) | HTA, Angor… |
Amlodipine | AMLOR® | Pfizer | 1990 | HTA, Angor |
Lacidipine | CALDINE® | Boehringer Ingelheim | 1990 | HTA |
Félodipine | FLODIL® | AstraZeneca | 1992 | HTA, Angor |
Isradipine | ICAZ® | Daiichi Sankyo | 1992 | HTA |
Lercanidipine | LERCAN® / ZANIDIP® | Pierre Fabre / Bouchara
Recordati | 1999 (AMM) | HTA |
Manidipine | IPERTEN® | Chiesi | 2002 (AMM), 2005 (coll.) | HTA |
La lercanidipine a réalisé un véritable « hold-up » sur l’ensemble de la classe, amlodipine incluse.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 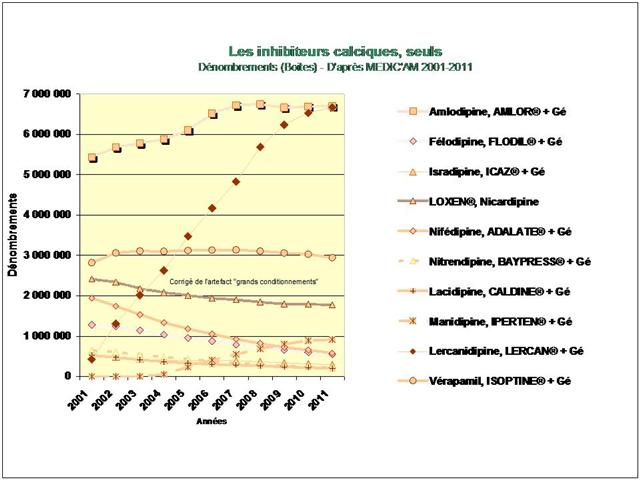
Mais pourquoi diable un tel succès ? Nous chercherons à comprendre un peu plus loin en examinant les données acquises de la science…
Mais à ce stade, il apparait que les firmes ont su échapper aux génériques en associant leurs vieux inhibiteurs calciques à d’autres molécules.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 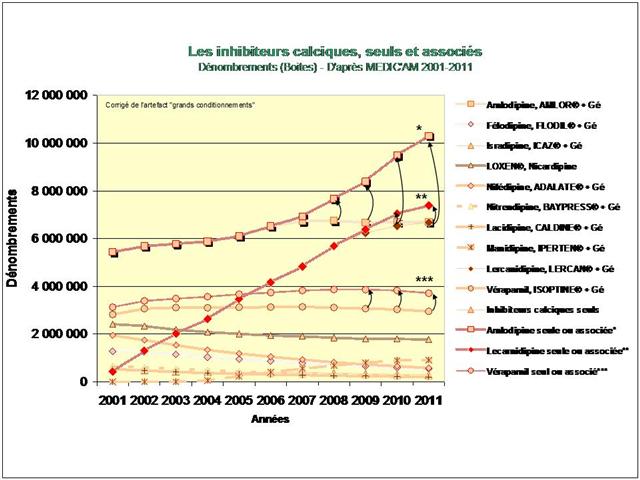
(*) Amlodipine + atorvastatine = CADUET®, + valsartan = EXFORGE®, + périndopril = COVERAM®, + olmesartan = SEVIKAR® / AXELER®, + telmisartan = TWYNSTA®
(**) Lercanidipine + énalapril = ZANEXTRA® / LERCAPRESS®
(***) Vérapamil + Trandolapril = TARKA® / OCADRIK®
Grâce au succès rencontré par les associations fixes à base d'amlodipine, mais aussi de lercanidipine et de vérapamil, les IC seuls et associés poursuivent leur croissance. Un moyen de redonner une "seconde jeunesse" à ces vieilles molécules, mais surtout une stratégie gagnante pour contourner les génériques des molécules associées : atorvastatine, valsartan, périndopril...
La générication d'AMLOR®, amlodipine, en 2007, coïncide avec le début d'une forte baisse des montants remboursés pour les inhibiteurs calciques non associés, qui avaient frôlé les 300 millions d'euros en 2006 et 2007. LERCAN®, également frappé par l'arrivée de génériques en 2010, voit aussi fortement baisser ses montants remboursés.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 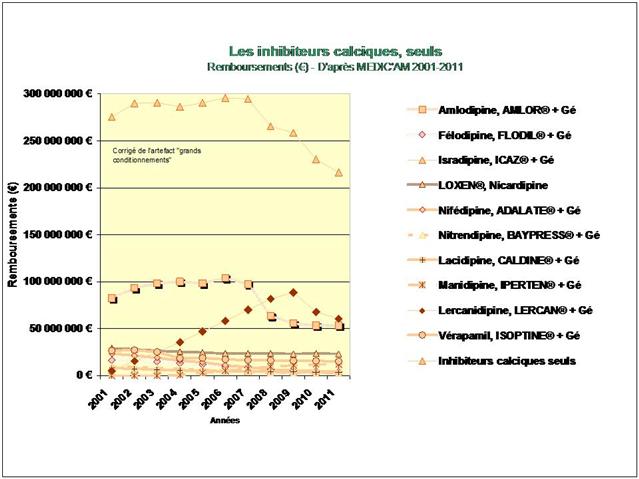
Ainsi, la lercanidipine, LERCAN® / ZANIDIP®, est-elle devenue l'inhibiteur calcique le plus remboursé en France, alors que la commission de la transparence ne lui avait accordé qu’une ASMR de niveau V (absence de progrès thérapeutique) en 2003, 2004 et 2011. Son ascension fulgurante laisse pantois lorsque l'on examine la faiblesse du dossier sur le plan clinique : Etudes réalisées sur une poignée de patients, publiées dans des revues de seconde zone, ou non publiée, absence d'effet documenté sur la morbi-mortalité...
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 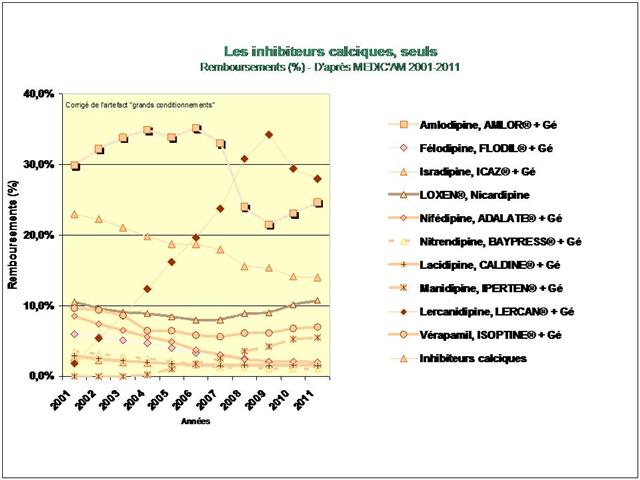
Des génériques étaient déjà disponibles en 2001 pour la nifédipine (ADALATE®, CHRONADALATE®), la nitrendipine (BAYPRESS®), toutes deux commercialisées par Bayer, et le vérapamil (ISOPTINE®). L’amlodipine (AMLOR®, Pfizer) et la félodipine (FLODIL®, AstraZeneca) sont génériquées depuis 2007, la lercanidipine (LERCAN®/ZANIDIP®° depuis 2010, la manidipine (IPERTEN®, ) depuis 2011 seulement. La nicardipine (LOXEN®, NOVARTIS) est génériquée depuis plusieurs années à l’hôpital, mais curieusement toujours pas en ville… L’isradipine, ICAZ®, et la lacidipine, CALDINE®, sont encore protégées par des brevets
Pierre FABRE Médicament, épaulé par un petit laboratoire italien, Bouchara Recordati, a eu tout le loisir de « cartoner » avec la lercanidipine, alors qu’il n’y avait plus de poids lourds de l’industrie en face pour promouvoir leurs inhibiteurs calciques. Pas plus qu’ils n’a rencontré l’Assurance Maladie sur le « chemin des DAM », lesquels n’étaient pas là pour freiner l’essor de l’usurpatrice lercanidipine…
Mais, tous les IC ont subi une maîtrise comptable brutale.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 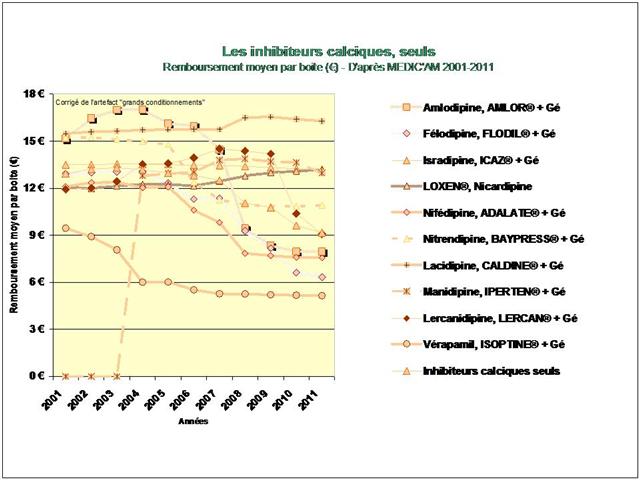
La baisse des dépenses trouve son explication dans la forte chute des prix moyens par boite des deux leaders de la classe :
- L'amlodipine présentait un prix moyen de 17 € par boite en 2004, à moins de 8 € en 2011, soit une chute de 53%
- Quant à la lercanidipine, elle passe de 14,19 € la boite, à 9,08 €, soit -36%
Néanmoins, les coûts annuels de traitement peuvent varier considérablement, comme en atteste le graphique ci-dessous.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives 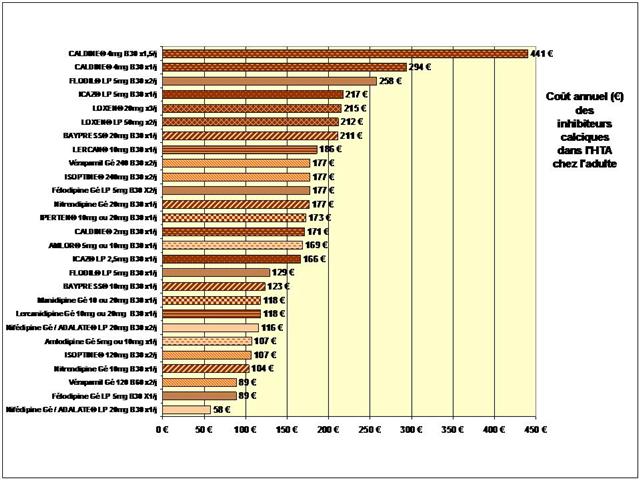
L’évolution de la prescription au sein de la classe des inhibiteurs calciques aurait-elle été guidée par une supériorité scientifiquement établie de la lercanidipine ?
L’amlodipine est l’inhibiteur calcique le mieux évalué sur le plan de la réduction des événements cardiovasculaires et des décès, avec notamment l’étude ALLHAT déjà mentionnée pour les diurétiques, mais aussi l’essai thérapeutique CAMELOT .
Sur la mauvaise qualité de prescription des médicaments dans notre pays, par manque d’information fiable des médecins, le cas très éclairant, pour ne pas dire « affligeant », de la lercanidipine, sur le point de devenir l’anticalcique le plus prescrit et le mieux remboursé en France :
La commission de la transparence a accordé au LERCAN® (Pierre FABRE Médicaments, et en co-marketing avec Bouchara Recordati qui commercialise la lercanidipine sous le nom de ZANIDIP®), une ASMR V (absence de progrès thérapeutique), les 03/11/1999 (Inscription au remboursement), 18/06/2003 (nouveau dosage à 20mg), 22/12/2004 (renouvellement de l’inscription), 23/01/2008 (réévaluation de l’ASMR à la demande du laboratoire), et 02/02/2011 (renouvellement de l’inscription).
Sans doute effarée par le manque de pertinence des 4 études présentées par le laboratoire lors de la demande de renouvellement en 2004, la commission après les avoir résumé dans son avis, avait « botté en touche », demandant à la commission d’AMM de l’AFSSAPS, quelles éventuelles (comprendre « hypothétiques ») modifications du RCP (résumé des caractéristiques du produit) pourraient résulter de ces études ?
La conclusion de l’avis du 23/01/2008 est particulièrement instructive :
« La demande du laboratoire de réévaluer l’ASMR de LERCAN® par rapport à AMLOR® repose sur les résultats de deux études cliniques randomisées , (2 des 4 études précitées, les deux autres concernaient respectivement 60 et 115 patients) ayant comparé la survenue des effets indésirables pour des posologies de 10-20 mg/j de lercanidipine à celle de 5-10 mg/j d’amlodipine chez des patients ayant une hypertension artérielle. Dans ces deux études, la lercanidipine a provoqué moins d’œdèmes périphériques que l’amlodipine après 2 mois de traitement dans une étude (92 patientes) et après en moyenne 12 mois et jusqu’à 2 ans dans la seconde étude (828 patients).
La réduction de la pression artérielle n’a pas été différente entre les groupes de patients. Cependant, la Commission souligne que, contrairement à la lercanidipine, l’amlodipine (AMLOR®) a démontré un effet positif sur la prévention des complications liées à l’hypertension artérielle. Le niveau de preuve documentant l’efficacité antihypertensive de l’amlodipine (AMLOR®) est donc plus élevé que celui de la lercanidipine (LERCAN®/ZANIDIP®) ».
La Commission de la transparence, elle, ne s’est pas laissée « bernée » par le labo, mais les médecins qui ne lisent pas ses avis et reçoivent dans leurs cabinet la visite médicale et/ou les revues financées par la publicité sur les médicaments, eux, oui…
D’ailleurs, quel dommage qu’il n’existe pas d’ASMR de niveau VI « Régression thérapeutique », car la lercanidipine et tous les autres anticalciques « me-too » qui n’ont pas prouvé au moins leur non infériorité par rapport au chef de file, l’amlodipine, sur la réduction des événements cardiovasculaires et des décès, y auraient évidemment droit ! Quel dommage tout court, que contrairement aux discours inauguraux dans l’affaire Médiator®, les promesses de l’ex-Ministre de la Santé, Xavier BERTRAND de ne mettre sur le marché que des médicaments évalués par rapport à des comparateurs lorsqu’ils existent, n’aient pas été tenues…
Quoi qu’il en soit, ne pas pouvoir discerner entre un médicament antihypertenseur qui évite des infarctus du myocarde, des accidents vasculaires cérébraux, des insuffisances cardiaques, des décès…, et un autre, qui ne fait que baisser la pression artérielle et entraînerait moins d’effets secondaires (œdèmes de la cheville), mais pour lequel nous ne disposons d’aucune données établies sur la morbi-mortalité, c’est tout de même vraiment fâcheux.
Une revue en 2005 (Claudio BORGHI, Université de Bologne en Italie, Vascular Health and Risk Management 2005:1(3) 173–182) a l’audace d’affirmer au chapitre des études cliniques que « Dans des études en double aveugle et en « cross-over » la lercanidipine à 10 ou 20 mg/jour a été aussi efficace que l’amlodipine à 10 mg/jour (De Giorgio et al., 1999 ; Pedrinelli et al., 2003) ». En fait, et vous l’aurez bien compris, il s’agit d’études conduites respectivement chez 20 et 22 patients, portant exclusivement sur l’efficacité tensionnelle…
A contrario, l’excellente plaquette mise à la disposition de tout un chacun par l’association de consommateurs américains Consumer Reports, pour choisir le meilleur inhibiteur calcique, actualisée en mars 2011, recommande l’amlodipine dans l’HTA (en second choix après un diurétique thiazidique) et dans l’angor. Elle ne cite même pas la lercanidipine.
Au total, l’amlodipine qui possède le meilleur niveau de preuve sur la morbi-mortalité de l’hypertendu, a perdu de sa superbe dès l’expiration de son brevet en 2007. L’arrêt de sa promotion active par Pfizer, a laissé le champ libre à la lercanidipine en position de devenir dès 2012 l’inhibiteur calcique le plus prescrit et remboursé. L’Etat français a laissé faire la substitution dans la prescription généraliste, aux profits d’intérêts commerciaux, de l’amlodipine, inhibiteur calcique le mieux évalué et le plus éprouvé, par la lercanidipine, plus coûteuse et à l’efficacité inconnue sur la morbi-mortalité dans l’HTA…
PS : Il est vrai qu’au plus haut sommet de l’Etat on ne rechigne jamais à donner un petit coup de pouce à nos fleurons industriels, comme par exemple en 2008 : « un prêté pour un rendu » ; Eh bien oui, le médicament revêt aussi une dimension économique…
2ème Épisode - La prescription débloque sur les bêta-bloquants ! (En ligne le 22/03/2013) Retour au choix des classes d’antiHTA
Commençons par observer quelle est la place des bêta-bloquants dans l’arsenal des antihypertenseurs.
Alors qu’ils possèdent bien d’autres indications que l’hypertension artérielle, comme par exemple l’angor (ou angine de poitrine), le post-infarctus du myocarde et l’insuffisance cardiaque chronique (ICC), les troubles du rythme, les bêta-bloquants ont été rejoints en 2011 par les sartans en termes de nombre de boites remboursées.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives sur les bêta-bloquants
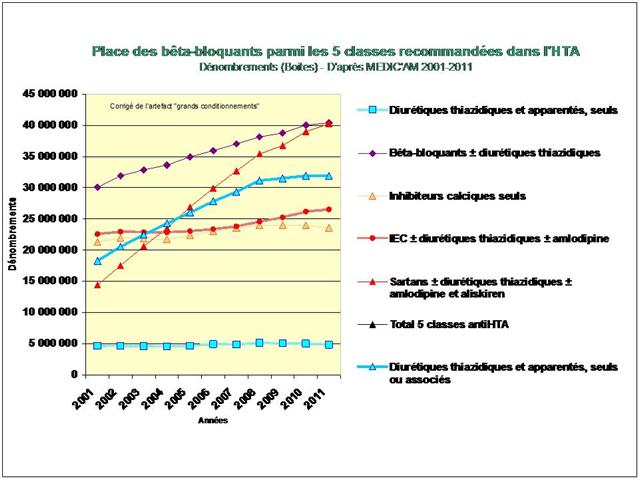
Ces médicaments anciens pour la plupart, sont en revanche moins coûteux et peu donc contributifs au déficit de la sécurité sociale, comme en témoigne leur 3ème place en matière de remboursements. Avec 250 millions d’euros en 2011, soit 18,5% de notre panier d’antihypertenseurs (>1,5 milliards €), ils arrivent loin derrière les sartans et les IEC.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives sur les bêta-bloquants
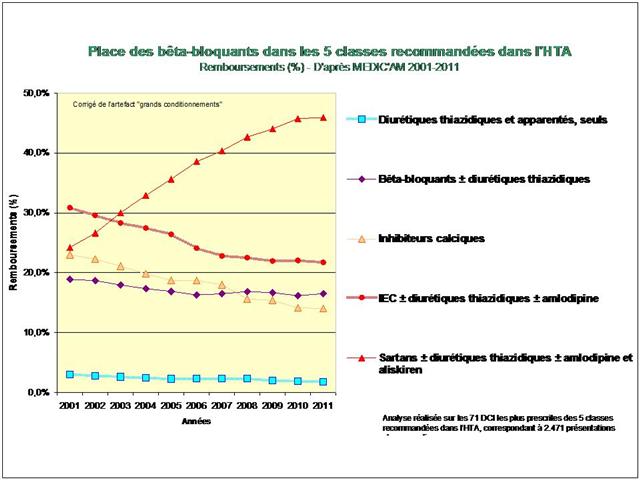
Le tableau ci-après permet de mieux situer les différents protagonistes à l’intérieur de cette classe.
Tableau des principaux bêtabloqueurs commercialisés en France
DCI | Princeps | Firmes | Commercialisation ou AMM | Indications AMM |
Propranolol | AVLOCARDYL® | AstraZeneca | 1967 | HTA, angor, post-IDM, troubles du rythme |
Sotalol | SOTALEX® | BMS | 1976 | Tachycardies |
Métoprolol | SELOKEN®, SELOZOK® | AstraZeneca | 1976 | HTA, angor, post-IDM, troubles du rythme, ICC |
Bêtaxolol | KERLONE® | Schwartz Pharma | 1983 (AMM) | HTA, angor |
Aténolol | TENORMINE® | AstraZeneca | 1985 | HTA, troubles du rythme |
Bisoprolol | DETENSIEL®, CARDENSIEL® | Merck Serono | 1986 | HTA, angor, ICC |
Acébutolol | SECTRAL® | Sanofi-Aventis | 1987 | HTA, angor, post-IDM, troubles du rythme |
Céliprolol | CELECTOL® | Sanofi-Aventis | 1988 | HTA, angor |
Nébivolol | TEMERIT® | Ménarini | 1996 | HTA, ICC |
Source : Thériaque
L’évolution de la prescription des bêta-bloquants sur la période 2001-2011 a-t-elle été homogène pour l’ensemble de la classe ou a contrario, y-a-t-il eu des « gagnants » et des « perdants » ?
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives sur les bêta-bloquants
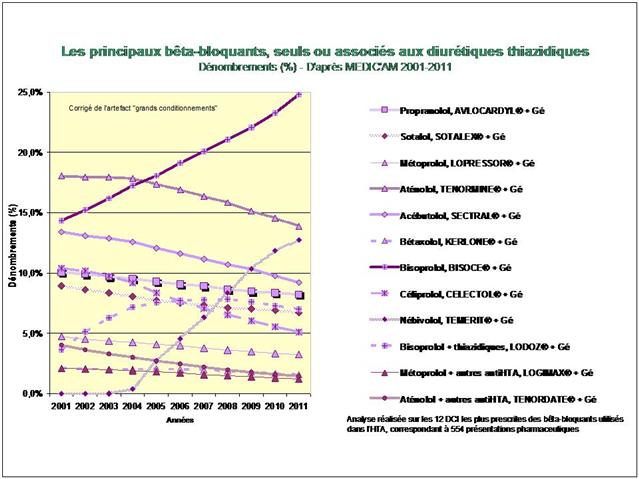
La réponse est que le bisoprolol et le nébivolol ont « tiré leur épingle du jeu » :
- Le bisoprolol, seul (CARDENSIEL® (Merck Serono) / BISOCE® (Mylan) ou associé au diurétique (LODOZ®, Merck Serono), a écrasé tous ses adversaires.
- Le nébivolol, TEMERIT® (Bouchara Recordati) / NEBILOX® (Negma), génériqué en 2010, est son unique dauphin à l'avoir suivi à distance.
- L’aténolol (14% des boites remboursées en 2011), leader en 2001, s’est fait dépasser par le bisoprolol (25%), et se trouve en passe d’être également doublé par le nébivolol (13%).
- Inutile de préciser que les autres bêtabloquants sont relégués encore plus loin : acébutolol (9%), propranolol (8%), sotalol (7%), céliprolol (5%), métoprolol (3%).
Parce que ces deux bêta-bloquants étaient les plus récents, plus coûteux, et qu’ils n’ont été génériqués que bien après les autres, la promotion les a propulsé en tête, et leur suprématie est encore plus marquée sur les montants remboursés.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives sur les bêta-bloquants
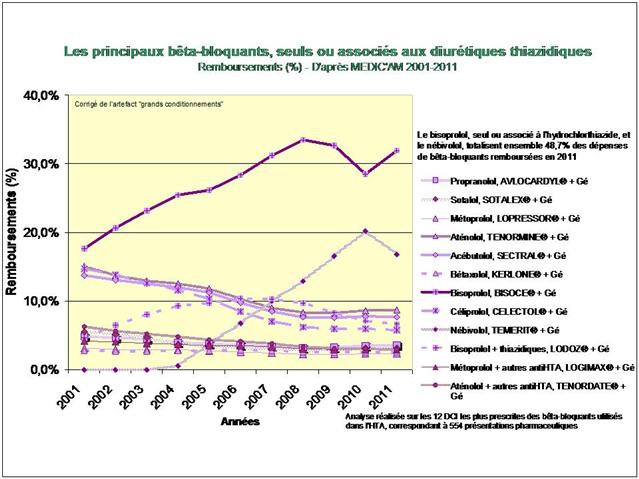
Bisoprolol et nébivolol totalisaient ensemble près de la moitié (48,7%) des remboursements de la classe en 2011, soient 120 millions d’euros.
La question qui se pose devant ce « carton plein » est de savoir si le bisoprolol et le nébivolol ont de bonnes raisons d’être passés devant tous les autres. Leur bénéfice clinique pour les patients est-il si supérieur à celui des autres ß-bloqueurs ?
Le bisoprolol seul, est ou a été commercialisé sous de multiples noms de spécialités. Chez Merck Serono : CARDENSIEL® (AMM dans l’insuffisance cardiaque chronique), DETENSIEL® (AMM dans l’HTA), chez Meda Pharma, laboratoire suédois, SOPROL® (AMM dans l’HTA et l’angor) et CARDIOCOR® (AMM dans l’IC). Idem pour le bisoprolol associé à l’hydrochlorothiazide, LODOZ® (AMM dans l’HTA) pour Merck Serono / WYTENS® pour Meda Pharma. Enfin, BISOCE® est le nom déposé du générique du bisoprolol chez Mylan, qui a racheté en 2007 Merck Génériques, filiale de l’Allemand Merck KGaA (à ne pas confondre avec l’américain Merck Sharp and Dohm, MSD-Chibret), c'est-à-dire en France, Merck Lipha Santé France, devenu Merck Serono... Tous ces laboratoires ont assuré une promotion active du bisoprolol pendant ces dix dernières années, avant la sortie de ses nombreux génériques.
L’examen des avis de la commission de la transparence pour les spécialités à base de bisoprolol possédant l’indication « Hypertension artérielle », à savoir DETENSIEL® (10/10/2007, 09/03/2011), LODOZ® (27/10/2004, 09/09/2009), WYTENS® (27/10/2004, 09/09/2009), n’apporte aucun élément en faveur d’une éventuelle supériorité du bisoprolol sur les bêta-bloquants plus anciens (pas d’ASMR définie). Dommage que nous ne puissions avoir accès aux avis antérieurs…
L’une des rares études publiées dans une grande revue médicale accréditant un bénéfice clinique du bisoprolol sur la prévention des décès et des infarctus du myocarde en péri-opératoire , émane d’une équipe hollandaise dont le chef de file, le Pr DON POLDERMANS, convaincu de malversations, a été licencié du centre hospitalo-universitaire Erasmus où il exerçait et a démissionné de la commission des recommandations pour la pratique clinique de l’ESC (Société Européenne de Cardiologie), ce qui jette un sérieux discrédit sur l’ensemble de ses travaux… Le blog Retraction Watch, qui comme son nom l’indique surveille les publications « rétractées » ou « désavouées », explique que la revue JACC (Journal of the American College of Cardiology) recommande la plus grande précaution concernant l’application en pratique clinique des conclusions des travaux de DON POLDERMANS, notamment sur le bisoprolol en chirurgie vasculaire… En France, un cardiologue blogueur a relayé l’affaire.
Le nébivolol seul, TEMERIT® (Ménarini France) / NEBILOX® (Laboratoire Exploitant = Negma ;Titulaire de l’AMM = « Ménarini International Opérations Luxembourg », cela ne s’invente pas…), ou associé à l’HCTZ, TEMERITDUO® / CONEBILOX®.
Le premier avis concernant le nébivolol est beaucoup plus lisible, puisque la commission lui a accordé une ASMR de niveau V le 06/09/2006, et qu’elle ajoute que « dans la prise en charge de l’HTA, le bêtabloquant TEMERIT® n’a pas été évalué dans des essais de morbimortalité ». Voilà qui est on ne peut plus clair…
Néanmoins, les choses se compliquent avec l’ASMR de niveau III (progrès modeste, mais progrès quand même ?) accordée un mois plus tard, le 04/10/2006, par la même commission pour une nouvelle indication « Traitement de l’insuffisance cardiaque chronique stable, légère et modérée, en association aux traitements conventionnels chez des patients âgés de 70 ans ou plus ». Ce petit coup de pouce au nébivolol peut néanmoins sembler incongru. En effet, après avoir pourtant pris la précaution de rappeler que les études randomisées dans l’insuffisance cardiaque menées avec le carvédilol, le bisoprolol et le métoprolol, permettaient de réduire de 24% la mortalité globale, la commission s’appuie sur l’étude, SENIORS , présentée par le laboratoire, dans laquelle le nébivolol comparé au placebo, a diminué de 14% l’occurrence d’un critère combiné additionnant les décès toutes causes aux hospitalisations pour événement cardiovasculaire, chez 2.128 patients, et elle fait remarquer que les autres bêtabloquants n’avaient jusque là pas fait l’objet d’études spécifiques dans l’insuffisance cardiaque chronique « stable, légère à modérée chez les 70 ans et plus » (moyenne 76 ans dans SENIORS).
Le dernier avis rendu à ce jour, le 29/04/2009, mérite le coup d’œil, une fois n’est pas coutume, il reprend tout l’historique des ASMR accordées au TEMERIT® depuis 1997. Ainsi, apprend-on qu’un progrès thérapeutique mineur (IV) par rapport aux autres bêta-bloquants lui avait été accordé initialement (22/01 et 05/02/1997) « en raison de ses bénéfices cliniques potentiels liés à son double mécanisme d’action », une époque que l’on espère révolue où la commission était très conciliante avec les laboratoires… ; Avantage confirmé le 17/11/1999 ; Mais, durcissement de la commission le 30/06/2004, qui observe que « les données cliniques examinées ne permettent pas de confirmer ce bénéfice. En conséquence, dans le traitement de l'hypertension artérielle essentielle, la spécialité TEMERIT® n'apporte pas d'amélioration du service médical rendu (ASMR V) par rapport aux autres bêtabloquants. Cet avis nous apprend également que le TEMERIT® est principalement prescrit dans l’HTA (HTA = 80% des 637.000 prescriptions annuelles estimées en août 2008 à partir du panel de médecins DOREMA / IMS-EPPM et 5% dans les cardiopathies ischémiques chroniques)
Les avis pour le NEBILOX®, sont strictement identiques, ce qui était attendu, puisqu’il s’agit exactement de la même molécule, co-promue par Negma (30/06/2004, 06/09/2006, 04/10/2006, 29/04/2009) et idem pour le CONEBILOX® (16/12/2009)
Seulement voilà, depuis 2009, plusieurs travaux viennent contredire une prétendue supériorité, fusse-t-elle minime, du nébivolol sur les autres bêtabloqueurs dans l’insuffisance cardiaque chronique.
Une méta-analyse publiée dans le British Medical Journal le 16 janvier 2013 , et en accès libre sur le site de la revue (ici), a compilé les données de 21 essais randomisés dans l’insuffisance cardiaque avec fraction d’éjection ventriculaire gauche réduite, et conclue à l’impossibilité de mettre en évidence la supériorité d’un bêtabloquant sur les autres en termes de mortalité à partir des données disponibles actuellement. Les auteurs recommandent néanmoins de préférer les 3 bêtabloquants les plus étudiés dans cette indication à savoir le bisoprolol, le métoprolol et le carvédilol.
Une autre étude récente, celle-ci observationnelle à partir d’une base de données canadienne , portant sur une cohorte de près de 27.000 insuffisants cardiaques suivis pendant 1,8 années, concluait de son coté que le carvédilol et le bisoprolol n’apportait pas un bénéfice supérieur à celui du métoprolol sur la survie, alors que l’acébutolol et l’aténolol étaient supérieur au métoprolol.
De tout ceci, il ne ressort pas d’argument pour préférer le bisoprolol ou le nébivolol aux autres bêtabloquants dans l’insuffisance cardiaque et encore moins dans l’hypertension artérielle…
En termes de prix et de coût annuel de traitement, le bisoprolol est déjà nettement plus onéreux que les anciens bêta-bloquants, le nébivolol l’est davantage encore, mais le champion toute catégorie reste le céliprolol.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives sur les bêta-bloquants
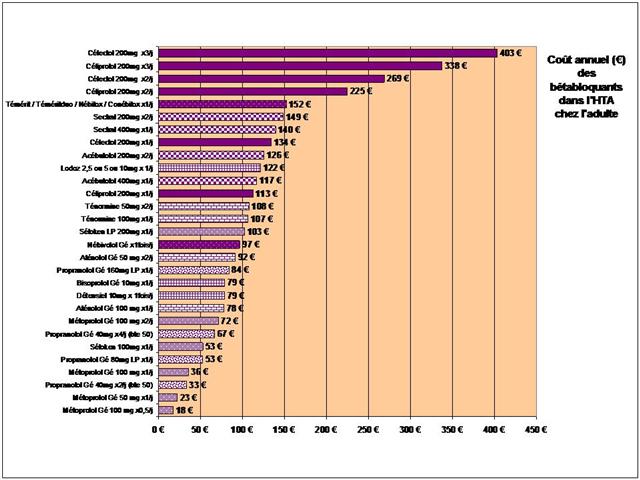
Car enfin, rien ne semble justifier le coût exorbitant du céliprolol, CELECTOL®, et ses génériques, heureusement assez peu usités, entre 113 € et 403 €/an selon la dose initiale de 200 mg/j avec un générique ou maximale à 600 mg/j avec le princeps. Si ce n’est qu’il est commercialisé par Sanofi-Aventis, notre fleuron national de l’industrie pharmaceutique. Son ASMR introuvable, n’a probablement jamais été définie par la commission de la transparence, les seuls avis téléchargeables en ligne sur le site de la HAS correspondant à des réinscriptions, sont en effet très succincts 10/10/2007 ou 19/10/2011. Celui de 2007 ne rappelle pas les conclusions des avis précédents (à noter 78% des prescriptions de CELECTOL® concernent l’HTA). Les avis antérieurs ne sont pas non plus accessibles dans les bases de données THÉRIAQUE® et THÉSORIMED®…
La seule étude présentée par le laboratoire et prise en compte sur l’ensemble de la période par la commission est un travail finlandais , dans lequel 112 patients présentant à la fois une hypertension et une hypercholestérolémie modérées ont été randomisés pour être traités par céliprolol et par simvastatine. Les résultats sont si peu brillants et la conclusion tellement édifiante que nous ne résistons pas à les reproduire ici, d’autant plus qu’ils se rapportaient à un score de risque cardiovasculaire global calculé selon la formule de Framingham (comme critère intermédiaire, on ne fait pas mieux…) : « Le score de risque a diminué de 26% à 19% avec la simvastatine et de 26% à 17% avec l’association simvastatine et céliprolol. L’administration de céliprolol seul a réduit le risque de 25% à 21%, ce qui n’était pas significativement différent du placebo. Nous pouvons conclure que les patients modérément hypertendus et hypercholestérolémiques bénéficient davantage d’un traitement hypolipémiant que d’un traitement antihypertenseur avec comme bêta-bloquant le céliproplol ». Inutile de préciser que ce type de travail n’a strictement aucun intérêt, et que c’est uniquement dans un double objectif anecdotique et pédagogique que nous en parlons ici…
Finalement cette brève revue aboutit à recommander dans l’HTA les trois mêmes anciens et peu onéreux ß-bloqueurs, l’aténolol, le métoprolol et le propranolol, que ceux proposés par Consumer Reports, la plus puissante association de consommateurs nord américaine . Consumer Report préconise également ces 3 molécules dans l’angor et le post-infarctus, et le métoprolol dans l’insuffisance cardiaque modérée.
Comment cette association de consommateurs en est elle venue à émettre ces recommandations ?
Un groupe de médecins et de chercheurs de l’Oregon Health & Science University Evidence based Practice Center a conduit une analyse complète pour le compte de l’association. Le document à l’attention des patients américains, téléchargeable en cliquant ici, comporte 25 références bibliographiques renvoyant vers les plus importantes études et analyses parmi les 114 retenues par cette équipe. Dans l’argumentaire, l’équipe souligne tout particulièrement l’analyse de PATSY et al. Publiée dans le JAMA en 2003 , ainsi que la revue systématique de la collaboration Cochrane sur ce thème publiée en 2009
.
Effect of bisoprolol on morbidity and mortality in patients undergoing vascular surgery. DON POLDERMANS et al. N Engl J Med 1999;341:1789-94.
Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). European Heart Journal (2005) 26, 215–225
1erÉpisode - Les Diurétiques thiazidiques et apparentés (En ligne le 15/03/2013 ; Dernière MAJ le 20/03/2013) Retour au choix des classes d’antiHTA
Commençons par observer quelle est la place occupée aujourd’hui par les diurétiques thiazidiques parmi les 5 classes d’antihypertenseurs recommandés.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives sur les diurétiques thiazidiques et apparentés
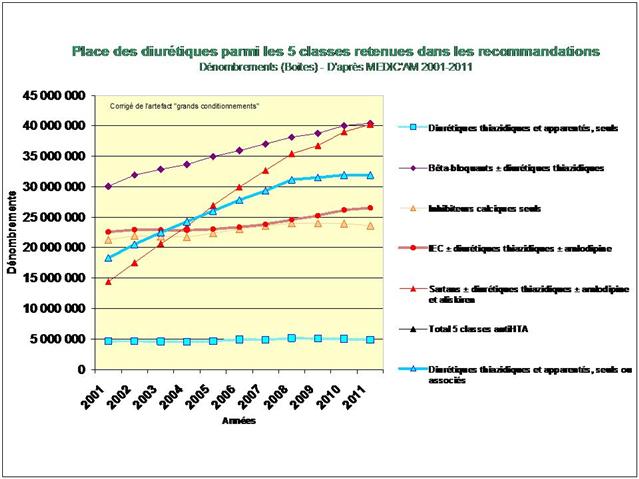
Les diurétiques seuls, en sachant qu’ils représentent une alternative thérapeutique de 1er choix pour débuter un traitement en monothérapie dans l’HTA, totalisaient (seulement) 4,8 millions de boites remboursées en 2011.
Bien que très souvent présent dans des associations fixes d’antihypertenseurs, les diurétiques seuls ou associés n’arrivent qu’en 3ème position en nombre total de boites remboursées, derrière les bêta-bloquants (qui, il est vrai, possèdent d’autres indications que celle de l’HTA) et les sartans.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives sur les diurétiques thiazidiques et apparentés
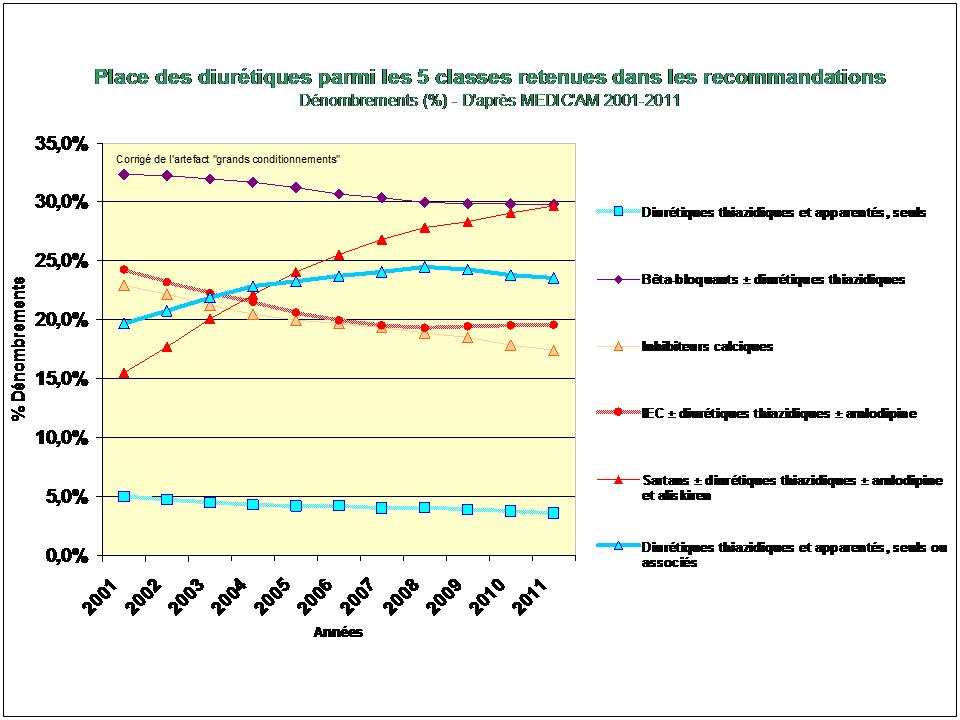
Maintenant, regardons d’un peu plus près.
Même si les dénominations communes internationales (DCI) sont ésotériques et peu faciles à mémoriser, ce n’est pas si complexe que cela n’y parait.
En effet, nous n’avions au départ que 4 principes actifs et deux familles : les thiazidiques « purs » et les thiazidiques « apparentés ».
Tableau des diurétiques thiazidiques purs
DCI | Princeps | Firmes | Commercialisation ou AMM | Indications AMM |
Hydrochlorothiazide | ESIDREX® | Novartis | 1986 (AMM) | HTA, Œdèmes |
Bendrofluméthiazide | NATURINE® NSFP | Léo | 1962 (AMM) 2004 (Arrêt) | HTA, Œdèmes |
Tableau des diurétiques thiazidiques apparentés
DCI | Princeps | Firmes | Commercialisation ou AMM | Indications AMM |
Chlortalidone | HYGROTON® NSFP | Novartis | 1977 (AMM) ; 2001 (Arrêt) | HTA, Œdèmes |
Indapamide | FLUDEX® | Servier | 1996 | HTA |
Première découverte, ces médicaments ne datent pas de la première jeunesse…
Deuxième découverte, 2 des 4 diurétiques sont désormais introuvables en France suite à leur arrêt de commercialisation décidé unilatéralement par les laboratoires qui les commercialisaient :
Novartis a arrêté en 2001 la commercialisation de la chlortalidone, une décision qui nous allons le voir est très préjudiciable à la santé des françaises et des français… A noter que la chlortalidone (parfois avec un « h » en anglais) reste commercialisée dans de nombreux pays, comme aux USA par Mylan et Pliva selon la base de données Drugs@FDA de la FDA, mais aussi au dosage de 15mg sous le nom commercial de THALITONE® par Monarch, comme au Royaume Uni sous le nom de marque HYGROTON® par Alliance Pharmaceuticals Ltd
Le laboratoire danois, Léo, a quant à lui stopper la commercialisation en France du bendroflumétiazide, ce qui à en croire nos voisins de l’autre coté de la Manche (Cf. infra) ne serait pas une grande perte pour la santé publique…
Attendu qu’en pratique l’indapamide n’existe en association fixe qu’avec le périndopril (PRÉTÉRAX® et BIPRÉTÉRAX®), l’hydrochlorothiazide est de très loin le diurétique le plus prescrit et remboursé en France.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives sur les diurétiques thiazidiques et apparentés
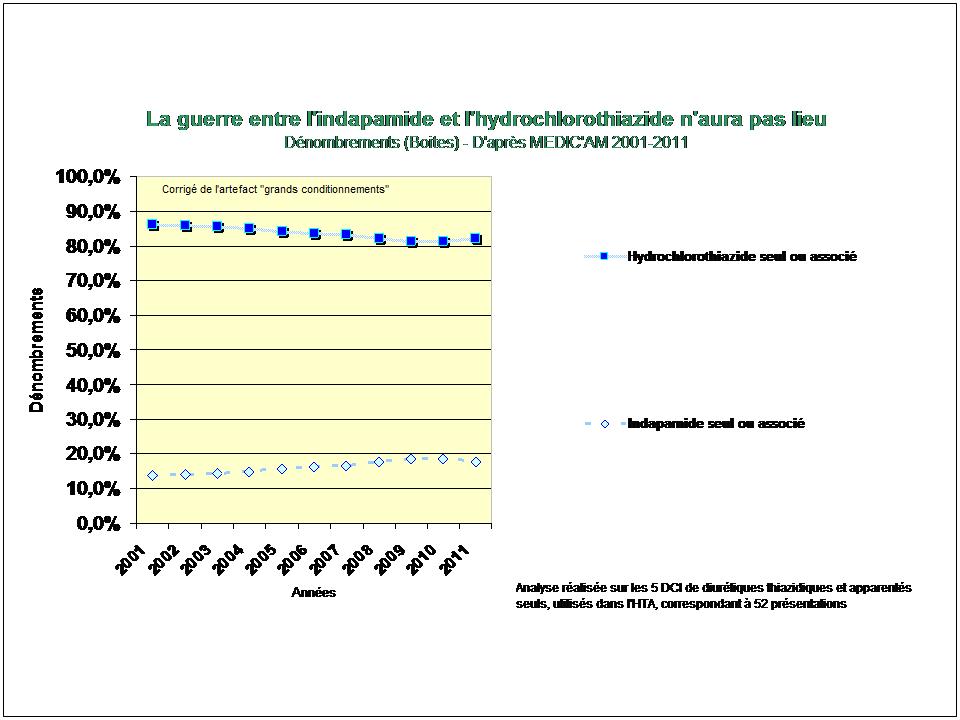
Parmi les diurétiques thiazidiques et apparentés non associés, l'indapamide, FLUDEX®, totalise le plus grand nombre de boites remboursées. Son volume de prescription a néanmoins baissé depuis sa générication fin 2008 ou il culminait avec près de 2,7 millions de boites, pour "retomber" à 2,4 millions de boites en 2011.
L'hydrochlorothiazide, ESIDREX®, qui n'a pas de génériques, totalise deux fois moins de boites que l'indapamide.
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives sur les diurétiques thiazidiques et apparentés
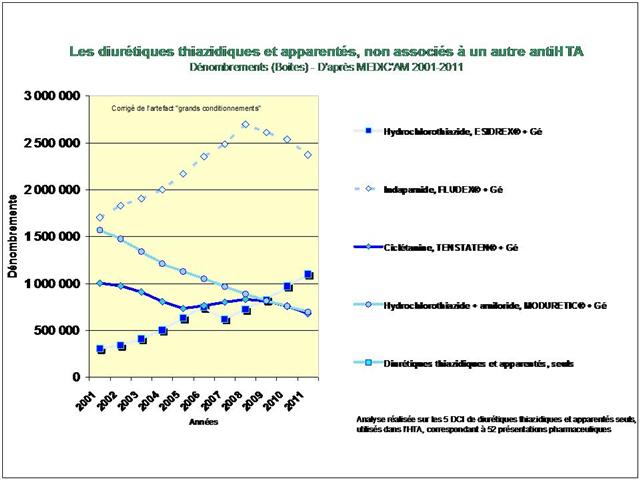
Après un pic à près de 40 millions d'euros atteints en 2008, puis la générication du FLUDEX®, indapamide, les diurétiques thiazidiques et apparentés seuls sont retombés à 27,5 millions de remboursement en 2011, ce qui ne pesait pas lourd (1,8%) dans les 1,5 milliards de montants remboursés par l'assurance maladie pour notre panier d'antihypertenseurs...
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives sur les diurétiques thiazidiques et apparentés
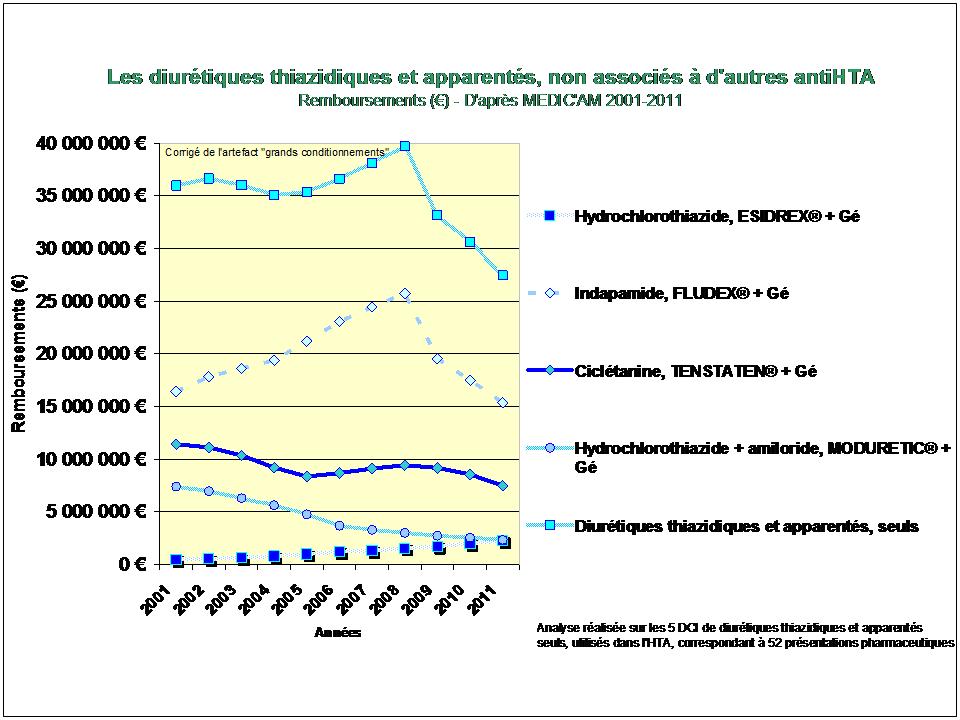
Il est vrai que les diurétiques thiazidiques seuls ne coûtent pas grand-chose comparés aux autres classes d’antihypertenseurs. 2€ la boite pour un mois de traitement avec l’hydrochlorothiazide. Songez que la chlortalidone si elle était encore commercialisée, serait à 1,40 € la boite de 30 comprimés, de quoi assurer deux mois de traitement !
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives sur les diurétiques thiazidiques et apparentés
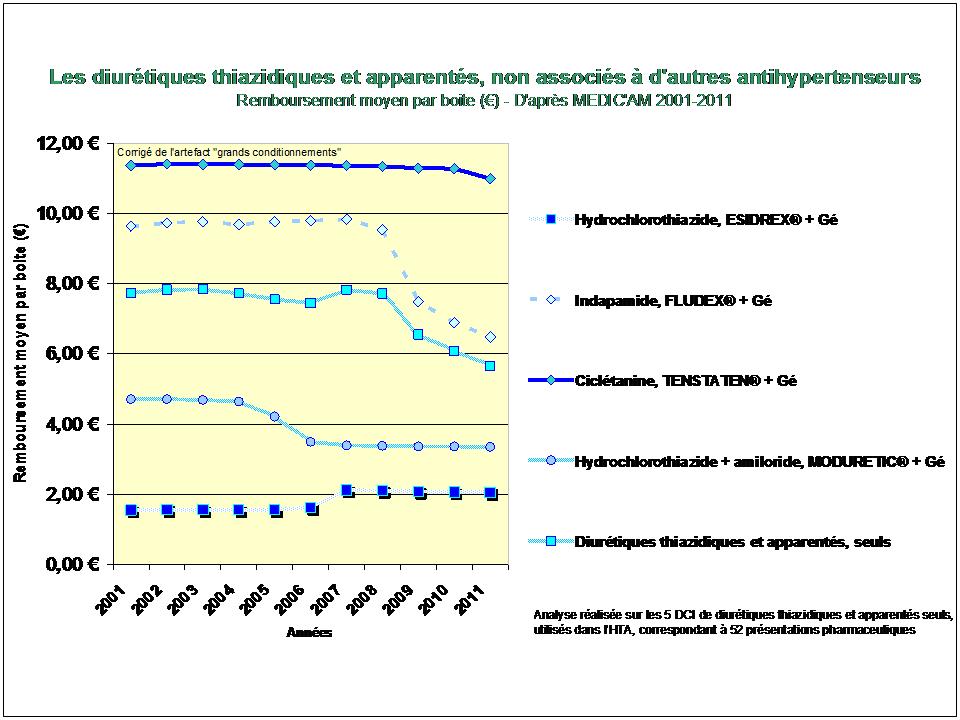
Des différences importantes sont néanmoins constatées dans les coûts annuels de traitements. De quoi vraiment regretter l’arrêt de commercialisation de l’HYGROTON®, chlortalidone, par Novartis : A raison d’un demi comprimé de 25mg par jour, elle ne coûterait que 9 € par an. Le FLUDEX®, indapamide, auquel les anglais accorderaient davantage de crédit qu’aux thiazidiques purs, en raison des bons résultats sur la morbi-mortalité de l’étude HYVET, est par contre 10 à 15 fois plus onéreux…
Cliquer sur l’image ci-dessous pour télécharger la présentation diapositives sur les diurétiques thiazidiques et apparentés
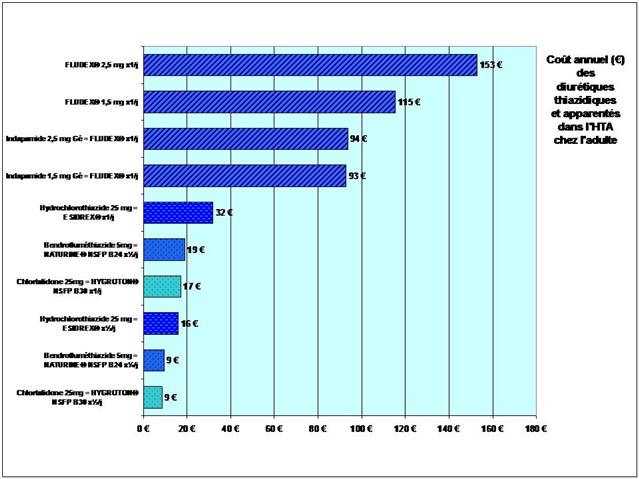
Examinons maintenant les données issues de la science pour savoir si tous les diurétiques thiazidiques se valent (effet de classe ?) ou non….
Une énorme surprise nous attend :
Le NICE (équivalent de notre Haute Autorité de Santé) recommande à présent (nouvelles recommandation de prise en charge du patient hypertendu adulte, datant d’août 2011) de choisir comme diurétique la chlortalidone (CTD) ou l’indapamide (IND) de préférence à l’hydrochlorothiazide (HCTZ) ou au bendroflumethiazide
Le NICE a motivé son choix par les constatations suivantes (voir pages 258-260 du texte long des recommandations) :
- Le diurétique thiazidique le plus utilisé au Royaume Uni est le bendroflumethiazide (BFZ), ce qui est « quelque peu inhabituel », car rares sont les autres pays à l’employer préférentiellement (Par exemple, en France l’hydrochlorothiazide est de très loin le plus utilisé),
- Même si l’effet principal des diurétiques thiazidiques (HCTZ et BFZ) et des « apparentés » (CTD et IND), est identique (inhibition de la réabsorption tubulaire distale du chlorure de sodium au niveau des néphrons du rein), leurs actions diffèrent sur d’autres enzymes présentes dans le rein, par exemple au niveau de l’inhibition de l’anhydrase carbonique, mais aussi leurs effets sur l’agrégation plaquettaire, et sur la régulation de l’angiogénèse, sans que l’on connaisse véritablement les conséquences de ces différences sur l’action antihypertensive et sur la morbi-mortalité,
- Le NICE a considéré important d’examiner les fondements de l’utilisation des diurétiques thiazidiques purs comparée aux thiazidiques apparentés
- Il n’existe pas d’étude comparative directe portant sur des critères de morbi-mortalité,
- les rares études comparatives ont porté sur l’effet hypotenseur comme critère principal. Ces études étaient de courte durée et comportaient des effectifs trop peu importants pour produire des résultats robustes,
- Par ailleurs, la variabilité des doses employées lors de ces études rend difficile toute conclusion quant à l’efficacité relative des différents thiazidiques sur l’abaissement de la pression artérielle,
- L’absence d’étude clinique portant sur des critères de morbi-mortalité avec le BFZ à faible dose (2,5 mg), les seules études disponibles, très anciennes, avait été faite à la dose de 10 mg,
- Le groupe de travail a également pris acte de la rareté des travaux démontrant un bénéfice sur des critères de morbi-mortalité d’un traitement de première intention avec l’hydrochlothiazide à faible dose, l’autre diurétique thiazidique le plus couramment utilisé au monde,
- Le groupe de travail a alors poursuivi sa revue des études cliniques conduites avec les thiazidiques apparentés, et observé que ces études étaient plus récentes et avaient employées plus constamment des doses faibles (chlortalidone 12,5 ou 25 mg, et indapamide 1,5 ou 2,5 mg), comparables à celles utilisées actuellement,
En conclusion de cette revue, le Nice observe que contrairement aux thiazidiques apparentés pour lesquels il existe des preuves de leur bénéfice clinique à dose faible, établies sur des critères de morbi-mortalité, il ne lui est pas possible de recommander l’utilisation du bendroflumethiazide ou de l’hydrochlorothiazide.
Une revue générale publiée dans Hypertension en janvier 2004, rappelait que bien qu’un certain nombre d’essais cliniques menés avec l’hydrochlorothiazide aient été concluants sur la morbi-mortalité, ceux ayant rapporté des résultats négatifs ou neutres ont souvent été conduit avec ce même diurétique thiazidique, alors que les études ayant obtenu les résultats cliniques les plus favorables ont été faites avec la chlortalidone. C’est le cas de tous les plus grands essais thérapeutiques : ALLHAT , HDFP, MRFIT, SHEP
Il est intéressant de noter que dans l’essai MRFIT5, le protocole initial prévoyait en première ligne d’un traitement antihypertenseur, soit l’hydrochlorothiazide, soit la chlortalidone, l’un ou l’autre à la dose de à 50 ou 100 mg par jour (pour arriver à l’objectif tensionnel de 90 mm Hg de tension diastolique. Suite à l’observation faite par le comité de pilotage de l’étude d’une évolution défavorable de la mortalité dans le groupe traité, pour les 9 cliniques prescrivant préférentiellement l’hydrochlorothiazide, contrairement au 6 cliniques utilisant la chlortalidone, pour lesquels la mortalité évoluait plus favorablement que dans le groupe de contrôle, il a été décidé de choisir en première intention la chlortalidone à la posologie unique de 50 mg/j…
Plus récemment, une analyse rétrospective de la cohorte observationnelle MRFIT a confirmé une réduction significativement plus importante par rapport au placebo de la fréquence des événements cardiovasculaires avec la chlortalidone par rapport à l’hydrochlorothiazide (-49% contre -35%).
Mais c’est à une équipe londonienne que nous devons l’analyse de l’effet dose réponse sur la pression artérielle des 3 thiazidiques les plus utilisés au monde, chlortalidone, hydrochlorothiazide et bendrofluméthiazide, dans une étude publiée l’an dernier . Reprenant des données parfois anciennes de plus de 30 ans (1978), ils montrent que les doses permettant de produire un abaissement de 10 mmHg de la pression artérielle systolique sont respectivement de 8,6 mg, 26,4 mg et 1,4 mg. Il apparait donc clairement qu’aux doses faibles usuelles, utilisées dans l’hypertension, à savoir 12,5 mg pour la chlortalidone et 25 mg pour l’hydrochlorothiazide, la première est beaucoup plus puissante. Ajoutons que l’action de la chlortalidone est également plus prolongée, du fait d’une demi-vie d’élimination plus longue.
D’autres équipes n’hésitent pas à invoqué certaines propriétés pharmacologiques différentes de la chlortalidone .
Le JAMA a publié en novembre 2011, le suivi à 22 ans de l’étude SHEP. Les auteurs en concluent que la mortalité à 22 ans des patients du groupe traité (par chlortalidone pendant 4,5 années), avait été réduite significativement par rapport au groupe placebo. Chaque mois de traitement pris, allongeant d’une journée la survie sans décès d’origine cardiovasculaire…
La chlortalidone n’est étrangement plus commercialisée en France, en dehors de 2 associations fixes avec de bêta-bloquants encore commercialisée (chlortalidone 12,5 mg et aténolol 50 mg dans TENORETIC®, AstraZeneca ; chlortalidone 25 mg et métoprolol 200 mg dans LOGROTON®, Daiichi Sankyo, réservées en seconde intention (bithérapie en cas d’échec d’une monothérapie). Novartis a commercialisé jusqu’en janvier 2001 la chlortalidone à 25 mg, sous le nom d’ HYGROTON® qui disposait d’une indication dans l’HTA en monothérapie à la posologie d’un demi ou d’un comprimé par jour. La boite de 30 comprimés (pour un ou deux mois de traitement) coutait alors seulement 1,40 €… (Voir également l’article « Les diurétiques thiazidiques, encore et toujours dans l’hypertension artérielle ! » du Pr Jean-Luc MONTASTRUC dans le BIP31 N°1, 2003)
Dans l’étude HYVET, 3845 patients âgés de plus de 80 ans et présentant une pression systolique supérieure à 160 mm Hg, recrutés principalement en Europe de l’Est (56% en Bulgarie, Roumanie et Russie), et en Chine (39%), ce qui en rend difficile la transposabilité des résultats à la population française, ont été randomisés pour recevoir en première ligne de l’indapamide à 1,5 mg, puis si nécessaire du périndopril, d’abord à la dose de 2 mg, puis au besoin de 4 mg, ou les placebo équivalents. L’étude a été interrompue avant son terme, lors de la seconde analyse intermédiaire, suite à l’observation d’une diminution significative de la mortalité toutes causes dans le groupe traité. Deux ans après l’inclusion dans le protocole, 25,8% des patients traités recevaient uniquement de l’indapamide 1,5 mg, 23,9% l’indapamide et 2 mg de périndopril, et 49,5% l’indapamide et le périndopril à 4 mg. Avec une baisse moyenne de 15 mm Hg de la pression systolique assise dans le groupe traité, une réduction de 39% des décès par AVC et de 21% de la mortalité globale ont été observées.
Le bendrofluméthiazide (BFZ) n’est commercialisé en France qu’en association avec la réserpine dans TENSIONORME®, Lisapharm ou associé au méprobamate (anxiolytique et sédatif) et à l’acétate de médroxyprogestérone (progestatif), dans PRECYCLAN®, Lisapharm, indiqué dans le syndrome prémenstruel.
CONCLUSION :
Messieurs les génériqueurs de l’association GEMME, rendez-vous utile et faîtes en même temps une superbe opération de communication : Mettez-nous s’il vous plait sur le marché de la chlortalidone !
23/02/2013 - « Les DAM, si on les utilise à tord, ils deviendront moins fort ! » - Focus sur la dérive collective de la prescription hypolipémiante en France entre 2001 et 2011.
En résumé :
- Le milliard d’euro a été dépassé dès 2010,
- Les volumes de prescription n’ont jamais fléchi,
- Les baisses de prix ont été conséquentes, mesures purement comptables,
- Les pharmaciens d’officines ont joué le jeu en substituant,
- Les médecins sous influence des firmes ont reporté massivement leurs prescriptions sur de fausses innovations plus coûteuses,
- L’assurance maladie a laissé faire…, car la visite des DAM est restée inopérante et les CAPI n'ont rien donné non plus !
- Pourtant la qualité de la prescription pourrait être considérablement améliorée et à moindre coût,
- A condition de rendre opérante la visite des DAM sur le médicament,
- Une décision politique !
- Les recommandations actuelles pour la prise en charge des patients dyslipidémiques sont biaisées par les conflits d’intérêts des experts qui les ont élaborées,
- Pourtant une approche thérapeutique non dogmatique serait possible y compris en prévention primaire.
Remarque importante : L’article « Les dernières recommandations européennes, américaines et françaises sur la prise en charge des dyslipidémies sont farcies d’intérêts et fortement biaisées - Les patients - usagers sont-ils les dindons de la farce ? » est publié simultanément sur le site du FORMINDEP (Association pour une formation et une information médicales indépendantes de tout autre intérêt que celui de la santé des personnes) : http://www.formindep.org/Les-dernieres-recommandations.html
Introduction
La prescription à la dérive des hypolipémiants en France offre un spectacle désolant, tant en termes d’enjeu de santé publique que d’efficience médico-économique. L’Assurance maladie devrait se damner devant tant d’argent public aussi mal employé.
Mais, commençons par définir le périmètre de notre étude :
Notre base de travail est constituée des fichiers détaillés MEDIC’AM de remboursements par le régime général de l’Assurance maladie, hors sections locales mutualistes de métropole, que nous avons agrégés dans une base de données relationnelles Microsoft Access®, avec les données portant sur la période 2001-2011.
L’ensemble de la famille des hypolipémiants (classe ATC "C10") représentait en 2011 près de 62 millions de boites et plus d’un milliard soixante dix millions d’euros remboursés. En tout, ce sont 685 spécialités hypolipémiantes qui ont été remboursées par l’assurance maladie obligatoire entre 2001 et 2011.
Le « panier » d’hypolipémiants, seuls ou en association (PRAVADUAL®, CADUET®, INEGY®) dont nous suivons depuis dix ans déjà l’évolution de la prescription en médecine ambulatoire, comprend :
- 5 statines : simvastatine, pravastatine, fluvastatine, atorvastatine et rosuvastatine,
- 2 fibrates : gemfibrozil, et fénofibrate,
- 1 inhibiteur de l’absorption intestinale du cholestérol : ézétimibe,
Soient 38 dénominations communes internationales (DCI, sous forme de princeps et / ou de génériques, le cas échéant), seules ou associées, avec leurs différents dosages. Au total, pas moins de 634 spécialités pharmaceutiques avec AMM appartiennent à ce panier, qui représente 96,6 % du montant total remboursé en 2011 pour quelques 685 spécialités hypolipémiantes…
Sont hors panier, 51 spécialités, regroupant 8 DCI : la cérivastatine (CHOLSTAT®/STALTOR®), une statine ayant fait l’objet d’un retrait mondial du marché, l’été 2002, suite à des rhabdomyolyses sévères ayant entraîné plusieurs dizaines de décès, 3 fibrates (clofibrate, bézafibrate, ciprofibrate), une résine échangeuse d’ions (cholestyramine), l’acide nicotinique et le tiadénol, enfin les « oméga-3 ».
1. Analyse de l’évolution de la prescription et recherche d’un hypothétique impact de la visite des DAM et / ou des primes à la performance…
Le milliard d’euros de remboursement a été dépassé dès 2010
Résultat, la baisse des dépenses entre 2005 et 2007 a fait long feu. Le milliard était dépassé dès 2010.
Cliquer sur l’image pour télécharger le diaporama
Les volumes de prescription n’ont jamais fléchi
Le nombre de boites d’hypolipémiants remboursées n’a cessé de croître au même rythme soutenu pendant toute la période. L’épidémie, ou plutôt la pandémie dyslipidémique, ne semble pas terminée dans notre pays.
En revanche, la prescription des statines de 1er choix, simvastatine et pravastatine, les seules à avoir démontré, et cela dans 5 essais thérapeutiques randomisés, qu’elles permettaient de réduire la mortalité toutes causes, subissent une lente mais inéluctable érosion de leur prescription depuis la perte de leurs brevets (en mai 2005 pour la simvastatine, en juillet 2006 pour la pravastatine) ; On cherche en vain l’empreinte des DAM ou l’effet d’un éventuel intéressement financier des médecins…
Cliquer sur l’image pour télécharger le diaporama
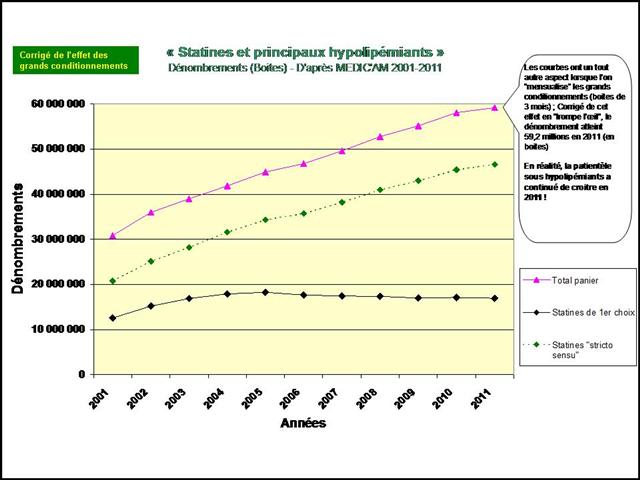
Pourtant les baisses de prix ont été conséquentes
Cliquer sur l’image pour télécharger le diaporama
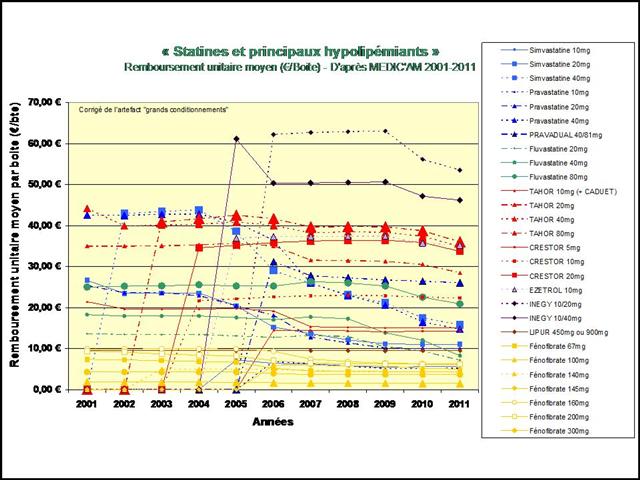
Pourtant les pharmaciens n’ont pas boudé la substitution
Les pharmaciens d’officine ont parfaitement joué le jeu de la maîtrise des dépenses en substituant au maximum les princeps de la simvastatine (88%) et de la pravastatine (83%) par des génériques. Un peu moins sur le fénofibrate (75%) et la fluvastatine (44%) pour lesquels les enjeux financiers sont moins importants.
Cliquer sur l’image pour télécharger le diaporama
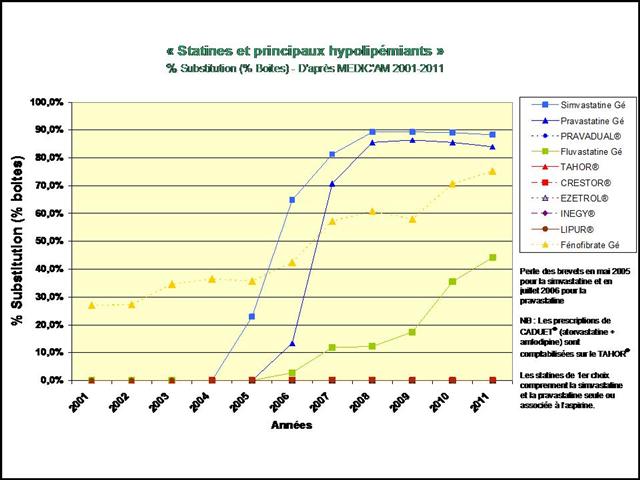
Mais, les médecins sous influence ont reporté leurs prescriptions
Cliquer sur l’image pour télécharger le diaporama
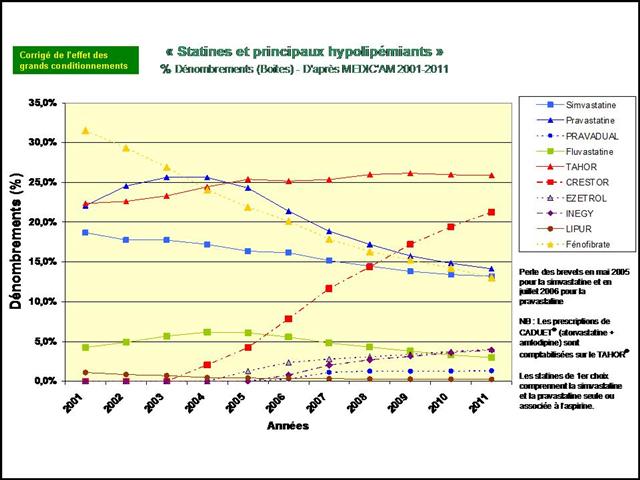
Si les dépenses n’ont pas davantage fléchi, c’est que les médecins ont massivement reporté leurs prescriptions sur les fausses innovations coûteuses promues par les firmes. L’analyse graphique de l’évolution par dénomination commune, confirme en effet le plongeon des statines qui auraient pourtant dû en toute logique conserver la faveur des prescripteurs. Celles-ci sont remplacées dans le cœur des médecins par le miroir aux alouettes que constituent les champions de la baisse du LDL-cholestérol, la victoire de la « biologie » sur la « clinique ».
Á savoir, deux « superstatines » :
- l’atorvastatine ; TAHOR®, et la rosuvastatine, CRESTOR®,
Et un super héros, inhibiteur de l’absorption intestinale de l’ennemi public numéro, le cholestérol, j’ai nommé :
- l’ézétimibe, seul dans la spécialité EZETROL®, ou associé à la simvastatine dans INEGY®
Même constat et toujours aucune trace des DAM et autres dispositifs incitatifs pour les médecins, lorsque l’analyse détaille les évolutions par dosage
Cliquer sur l’image pour télécharger le diaporama
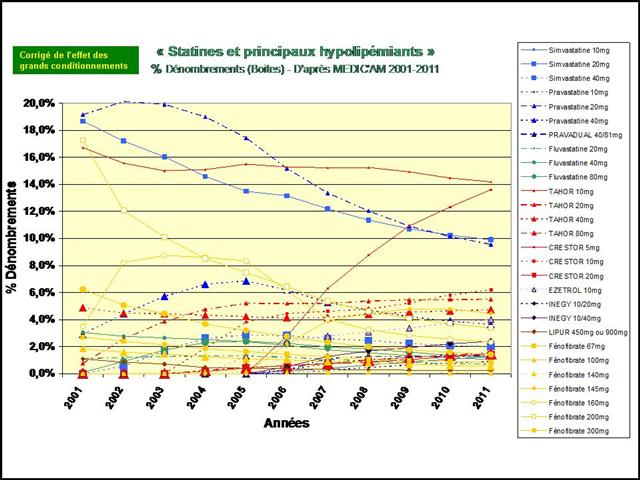
TAHOR® n’a été génériqué que dans le courant de l’année 2012, et nous surveillerons donc avec intérêt, dans quelques mois (ou années) les courbes 2012, dès que la Cnamts aura la bonté de publier son prochain fichier détaillé des remboursements de médicaments, le déjà très attendu « MEDIC’AM 2008-2012 »…
CRESTOR®, dernière statine survivante (non génériquée), mais toujours aussi massivement promue, même s’il n’y a plus personne en face pour contrer l’argumentation d’AstraZeneca, ne restera plus longtemps « challenger » du TAHOR®. Son dosage le plus faible, à 5 mg, qui n’a toujours pas fait l’objet de la moindre étude clinique randomisée publiée, était à deux doigts de dépasser dès 2011 le TAHOR® 10mg (l’effet biologique sur le LDL-cholestérol étant sensiblement le même pour ces deux spécialités). Pfizer aurait-il levé le pied un an avant la perte du brevet de son meilleur « blockbuster » de toute l’histoire industrielle de la pharmacie ;
Euh, rosuvastatine dernière survivante ? Rien n’est moins sur. Car la firme japonaise Kowa Pharmaceutical, associée au géant américain Lilly, commercialise déjà aux USA sous le nom de marque LIVALO®, la septième statine, la pitavastatine. Mais qu’attendent-ils donc pour inonder l’Europe, et singulièrement la France ? Promis, juré, les DAM leur laisseront une « paix royale »…
Quant au « super héros », l’ézétimibe, dont les ventes sont soutenues par le géant pharmaceutique, Merck Sharp and Dohm (MSD pour faire vite) à peine remis de sa boulimie (il avait, on s’en souvient, absorbé l’américain Schering Plough, tout juste plus petit que lui), sa lente mais constante progression n’est-elle pas abasourdissante ? Les 3 spécialités qui en renferment, totalisaient plus de 200 millions d’euros de remboursements en 2011, alors même qu’aucune étude clinique publiée n'a apporté la preuve d'un bénéfice en termes de mortalité globale ou cardiovasculaire avec cet hypolipémiant, qu’il soit associé ou non à la simvastatine. Sans compter qu’il subsiste un sérieux doute sur sa propension à favoriser certains cancers, comme cela avait été observé dans l'étude SEAS !
La CNAMTS, pour lever cet insupportable doute, devrait bien s'inspirer de l'étude de cohorte observationnelle qu’elle a conduite sur la pioglitazone1, aussitôt retirée du marché dès qu’il fut évident qu’elle provoquait des cancers de la vessie !
Les CAPI non plus n’ont rien donné.
En dépit des primes proposées, les médecins « Capistes » ont même réussi à réduire la part des statines prescrites dans le répertoire des génériques ! (Selon le dossier de presse de la Cnamts portant sur les 5.355 premiers médecins signataires des CAPI)
Cliquer sur l’image pour télécharger le diaporama
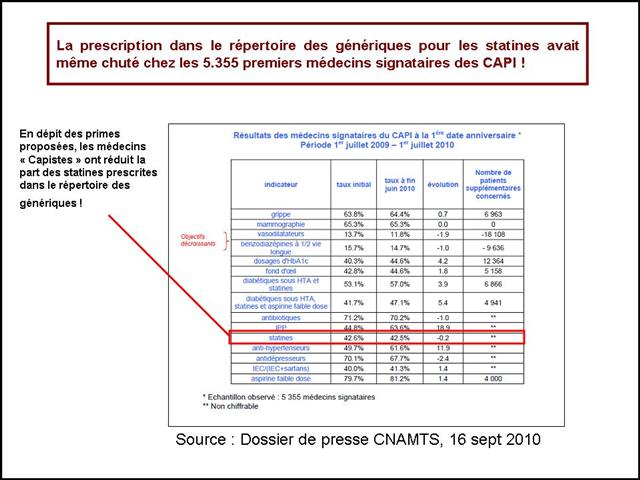
Pourtant, la qualité de la prescription pourrait être améliorée considérablement et pour un moindre coût
A condition de rendre opérante la visite des DAM, une décision politique !
En effet, en d’autres temps et à titre expérimental, des DAM avaient montré qu’il était possible de convaincre les médecins de modifier leur prescription dans une toute autre direction. Ci-dessous, l’impact indiscutable obtenu par la caisse de Montpellier en 2006-2007.
Cliquer sur l’image pour télécharger le diaporama
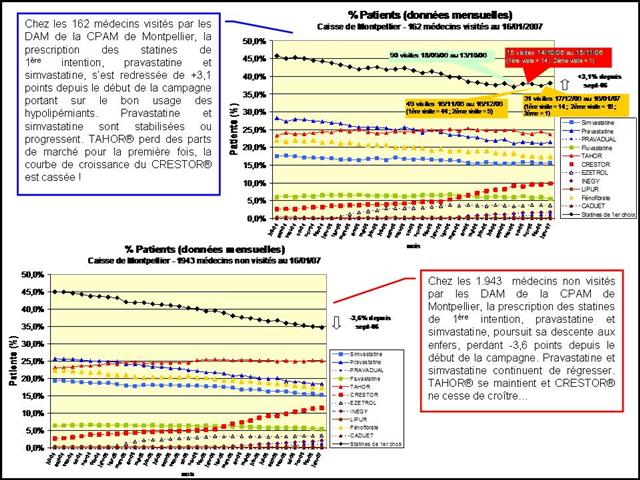
Il est vrai que nous disposions aussi d’outils d’évaluation individuelle des pratiques de prescription hypolipémiante, extrêmement fins. Et que nous avions réussi à combiner la démarche efficace de la visite en face à face, telle qu’elle est pratiquée par l’industrie, avec celles de l’EPP (Evaluation des pratiques professionnelles). Alors que la HAS a défini le 27 décembre 2012 six modalités du DPC, qui devient obligatoire cette année 2013, des médecins de la région Languedoc Roussillon dès 2006 avaient été conquis par une démarche innovante de « développement professionnel continu »… Ci-après, le graphique détaillé de prescription d’un médecin héraultais ayant particulièrement bien répondu lors de la campagne de visites médicalisées des DAM menée notamment par la CPAM de Montpellier. Une expérience en bonne place dans le rapport IGAS 2007 sur l’information des médecins généralistes sur le médicament.
Cliquer sur l’image pour télécharger le diaporama
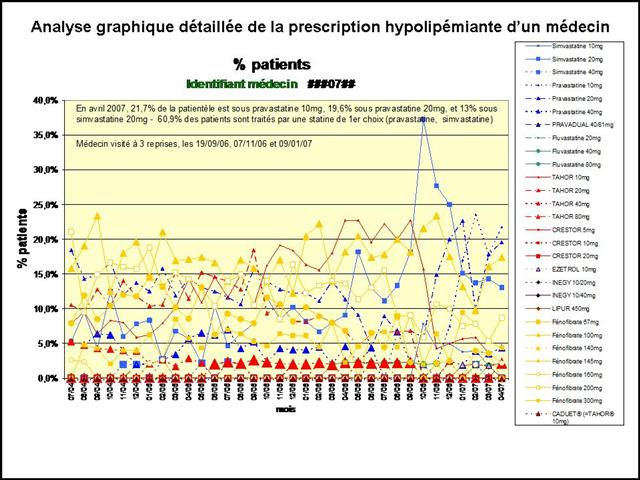
Les différentiels de coûts de traitements mensuels des différentes alternatives de prise en charge médicamenteuse du patient dyslipidémique, montrent que subsistent d’importants gisements d’économies compatibles avec une amélioration de la qualité de la prescription
Cliquer sur l’image pour télécharger le diaporama

Pourtant, une approche thérapeutique non dogmatique serait possible y compris en prévention primaire
Un grand essai thérapeutique, méconnu de la plupart des médecins à qui l’industrie ne l’a jamais présenté, et dédaigné des leaders d’opinion, qu’il embarrasse par ses résultats contredisant à la fois les anti-statines et ceux favorables à l’abaissement maximal du LDL-cholestérol, a cependant validé le bénéfice clinique d’un traitement en prévention primaire par pravastatine au dosage le plus faible (10mg) sur une population parfaitement comparable à la notre par son très bas risque cardiovasculaire.
Cette étude clinique publiée dans le Lancet en septembre 2006, juste après la perte du brevet d’ELISOR® / VASTEN®, ce qui explique pourquoi elle n’ait pas été diffusée aux médecins, se nomme MEGA ;
Loin des polémiques actuelles, j’invite les internautes qui souhaiteraient connaître ce qui motive ma position en matière de prévention primaire par statines chez les Françaises et les Français à lire mon article2 ainsi que les échanges qu’il a suscité avec le comité de lecture, publiés sous la forme d’un entretien3 avec l’auteur (Attention : 4 pages .html à ouvrir pour une lecture complète), sur le blog de l’expertise médicale généraliste indépendante « Voixmedicales.fr ».
2. Un récent rapport de l’IGAS appelle à une validation scientifique par la HAS du contenu de la visite des DAM
Le rapport de l’IGAS « Evaluation de la politique française des médicaments génériques » datant de septembre et rendu public en décembre : http://www.igas.gouv.fr/IMG/pdf/RM2012-115P_-_DEF_sans_sign.pdf
Selon les inspecteurs de l’IGAS : « La prescription dans le répertoire reste largement inférieure aux attentes et la mise en place des contrats d’amélioration des pratiques individuelles (CAPI), prévoyant des engagements des médecins en la matière, n’a pas permis d’obtenir les résultats escomptés. La faible rémunération complémentaire prévue pour les médecins dans le nouveau dispositif de paiement à la performance et l’absence de mesures contraignantes ne faciliteront probablement pas l’atteinte des objectifs définis »
La mission IGAS « souligne également la nécessité de mieux combattre les fausses innovations ("me-too") »
« Pour les médecins, afin d’accroître la prescription dans le répertoire, la mission préconise la mise en place d’un système de bonus-malus dans lequel ceux ayant un taux de prescription dans le répertoire faible seraient pénalisés financièrement »
« Les DAM peuvent être les vecteurs de l’information en direction des médecins et pharmaciens mais le contenu scientifique de celle-ci doit être validé par des autorités incontestées en la matière comme la HAS ou l’ANSM »
3. L’inspection oublie hélas à quel point les recommandations actuelles portant sur le traitement médicamenteux des dyslipidémies sont biaisées, en France, en Europe et aux USA…
Un article « Les dernières recommandations européennes, américaines et françaises sur la prise en charge des dyslipidémies sont farcies d’intérêts et fortement biaisées », publié simultanément sur le site du FORMINDEP, « association pour une formation et une information médicales indépendantes de tout autre intérêt que celui de la santé des personnes », fait le point sur les conflits d’intérêts qui ont entourés l’élaboration des dernières recommandations ou rapports en France (HAS 2010), en Europe (ESC et ESA 2011) et aux États-Unis (ATP III en 2004, ATP IV attendu en 2013) ; Il fait suite aux « Conflits d’intérêts : les mauvaises graisses de la HAS » publié sur le même site en septembre 2010 et qui soulignait le peu de confiance à accorder au rapport 2010 de la HAS sur l’efficacité et l’efficience des statines.
Il est clair que tant que la HAS ne garantira pas sa totale indépendance vis-à-vis des lobbys industriels dans la production de matériels d’information considérés comme vecteurs des bonnes pratiques auprès des professionnels de santé, l’Assurance maladie devra refuser d’être « le petit soldat » d’une autorité qui a perdu deux de ses principes fondateurs : l’indépendance et la rigueur scientifique.
4. Dans la tourmente actuelle qui ébranle la confiance des usagers et des patients en l’une des classes de médicaments les plus prescrites, nous vous proposons quelques lectures complémentaires sur ce sujet…
Cet article a été préparé bien avant l’annonce de la sortie du livre polémique du Pr Philippe EVEN, « La vérité sur le cholestérol », et de l’apparition télévisuelle du Pr Michel de LORGERIL à l’occasion de la réédition prochaine de son best seller « Cholestérol, mensonges et propagande ».
Michel de LORGERIL, invité sur France 5 LE 19 février 2013. Cliquer sur l’image pour visionner la vidéo (entre 5’ à 15’44’’)
Ci-après, vous sont proposées quelques lectures complémentaires :
Un excellent article du Monde Santé4, tout juste un peu trop tendre à notre goût sur l’étude JUPITER, et assez frileux sur la prévention primaire, omettant notamment l’étude MEGA ; le billet de Luc PERINO sur son blog5 ; Un court article sur Medscape France6 ; Les commentaires du Pr Bernard BEGAUD7 ;
[1] Etude observationnelle conduite par la Cnamts à l’origine du retrait du marché de la pioglitazone : http://www.ameli.fr/l-assurance-maladie/statistiques-et-publications/etudes-en-sante-publique/pioglitazone-et-cancer-de-la-vessie.php
[2] « Statines en prévention primaire : entre mythe et certitude, quelle conduite tenir ? ». François PESTY. Voixmedicales.fr - 07/07/2011
[3] « Entretien avec François Pesty : précisions sur l’article ‘’Statine en prévention ? Réalités ou marketing ? ». (Attention, 4 pages à ouvrir pour une lecture complète)
[4] « Statines : ce que dit la science ». Professeurs François GUEYFFIER et Christian Funk-BRENTANO - Le Monde Santé. 19/02/2013
[5] « Cholestérol et autres facteurs de risque ». Dr Luc PERINO. 14/02/2013
[6] « Livres Even et de Lorgeril anti-statines : faut-il en rire ou pleurer ? ». Stéphanie LAVAUD. Medscape France - 19/02/2013
[7] « Il manque une étude de l'effet des statines en France ». Pr Bernard BEGAUD. Books. 19/02/2013
14/12/2012 - « Les DAM, si on les utilise à tort, ils deviendront moins fort ! » - Focus sur l’évolution des pratiques de la prescription antibiotique en France entre 2001 et 2011. Exemple de la visite académique du NPS australien
Nous les guettions comme le « Beaujolais nouveau » et nous sommes vraiment gâtés d’avoir eu deux millésimes à seulement quelques semaines d’intervalle. Merci la Cnamts, notre patience de deux ans vient d’être ainsi récompensée, puisque MEDIC’AM 2010 semble-t-il prêt depuis mai 2012, ne fut en ligne que courant octobre, puis vint MEDIC’AM 2011, en fin de semaine dernière.
Une publication en catimini des fichiers détaillés de remboursements des médicaments, qui malheureusement n’est intervenue qu’après la fin des débats sur le projet de Loi de financement de la sécurité sociale 2013… Consolons-nous, car de débats, il n’en n’eut point ;
« Grâce au vaste programme initié par l’Assurance Maladie en 2002, les Français ont compris que "les antibiotiques c’est pas automatique" et les situations de non prescription sont aujourd’hui mieux acceptées. Les actions menées ont également contribué à faciliter la pratique des médecins en faveur d’une prescription appropriée »
C’est donc par un « auto satisfécit » que M. Frédéric VAN ROEKEGHEM, Directeur général de la CNAMTS, introduisait en mai 2010 un dossier de presse1 intitulé « Antibiotiques : Où en est-on ? »
Nous allons voir à la lumière des données de remboursements MEDIC’AM 2001-2011 à quel point ces affirmations sont éloignées de la réalité ; Puis, nous ferons un petit tour par la visite académique en Australie, une organisation exemplaire et qui produit des résultats, dévoilée lors de la 1èreJournée Internationale de l’Indépendance Médicale, pour nous interroger sur le caractère toujours aussi inopérant de la visite des DAM sur le médicament dans notre pays…
1. Le constat ne change pas, la visite des DAM n’a pas modifié sensiblement les comportements de prescription des antibiotiques
"Antibiotiques pas zautomatic" avez-vous dit ?
Depuis 2004, le volume de prescription n'a pas fléchi, selon notre panier de 19 antibiotiques représentant plus de 95% de la prescription dans les infections respiratoires hautes et basses. Bien au contraire, malgré d'importants budgets publicitaires radiophoniques et télévisuels, il est même reparti à la hausse !
Par rapport à 2004, plus de 10 millions de boites supplémentaires ont été remboursées en 2011, Et l'on ose encore parler de succès pour la (les) campagne(s) de la Cnamts
Cliquer sur l’image ci-dessous pour télécharger le diaporama
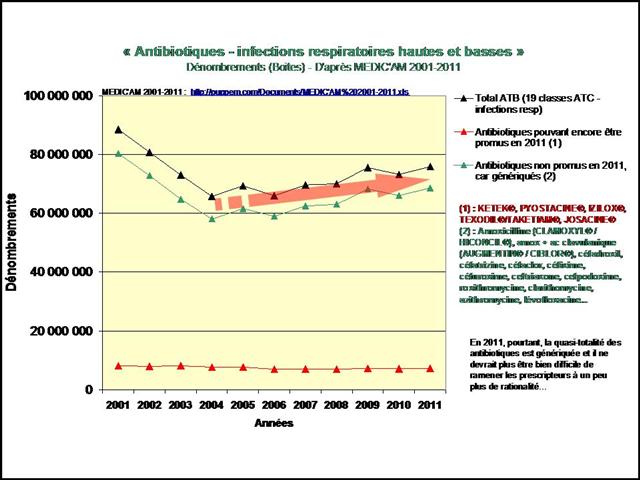
Et si la baisse des prescriptions antibiotiques jusqu’en 2004 n’était pas due à la campagne de publicité de l’assurance maladie, mais plus prosaïquement à une baisse passagère de l’incidence des syndromes grippaux ?
Cliquer sur l’image ci-dessous pour télécharger le diaporama
Estimation du taux d’incidence hebdomadaire de consultations pour syndromes grippaux en médecine générale en France métropolitaine de 1985 à 2011, et seuil épidémique
Source : Graphique p 40 du Bilan annuel 2011 du réseau Sentinelles
"Antibiotiques pas zautomatic" avez-vous dit ?
L'amoxicilline n'a regagné que 4,5 miséreux points de pourcentage en 6 ans. Là où en 2006 la caisse de l'Aude avait fait bondir cet indicateur de 15 points en 6 mois seulement, et où un an plus tard, cinq caisses languedociennes l'avait redressé de 10 points en 7 mois ! (Cf infra) ;
ORELOX®, toujours très coûteux même génériqué, n'a pas fléchi d'un iota, tandis que PYOSTACINE®, encore plus onéreuse continue de grimper en toute impunité...
Cliquer sur l’image ci-dessous pour télécharger le diaporama
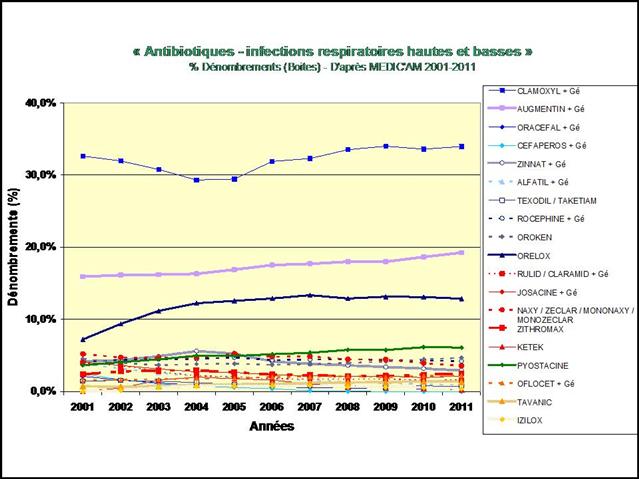
Malgré la désertification de cette aire thérapeutique privée de visiteurs médicaux, ce qui facilitait grandement leur tâche, les DAM n’ont rien obtenu !
Pour mémoire, la performance toujours inégalée de la caisse de l’Aude l’hiver 2005-2006 :
Cliquer sur l’image ci-dessous pour télécharger le diaporama
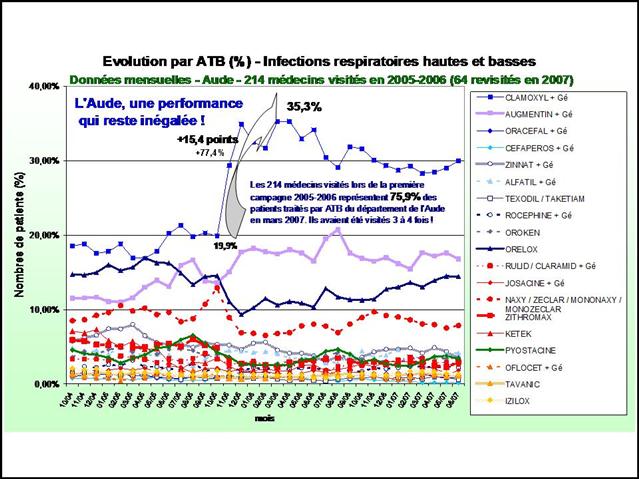
Néanmoins, les dépenses se stabilisent malgré une hausse des volumes :
Cliquer sur l’image ci-dessous pour télécharger le diaporama
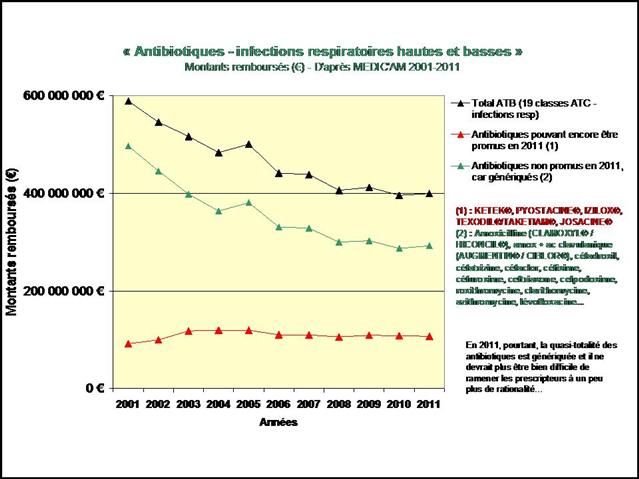
L’explication tient aux baisses de prix et à l’arrivée de nouveaux génériques :
Cliquer sur l’image ci-dessous pour télécharger le diaporama
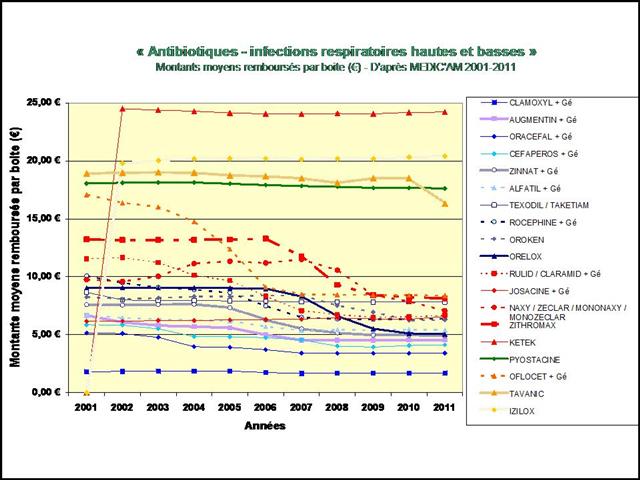
Ainsi qu’à l’effort constant des pharmaciens d’officine qui substituent chaque année davantage de princeps par des génériques. Même le TAVANIC® y est passé en 2011 :
Cliquer sur l’image ci-dessous pour télécharger le diaporama
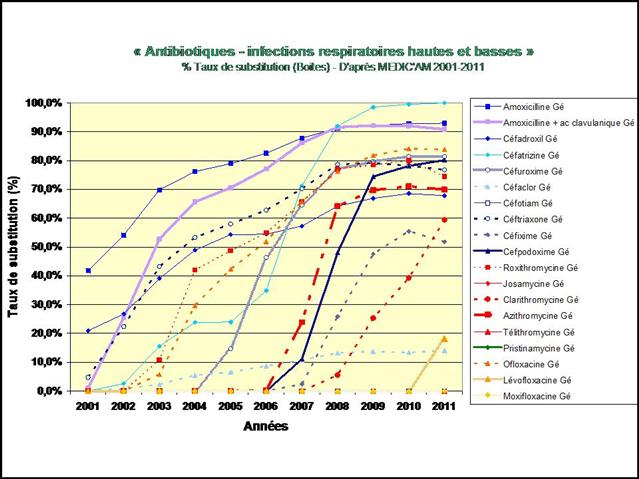
La maîtrise est comptable et non pas médicalisée...
L’absence d’impact des DAM sur la prescription médicale, et plus généralement la maîtrise purement comptable, ont laissé la voie royale à PYOSTACINE®, antibiotique à réserver devenu le plus remboursé en ville par l’assurance maladie :
Cliquer sur l’image ci-dessous pour télécharger le diaporama
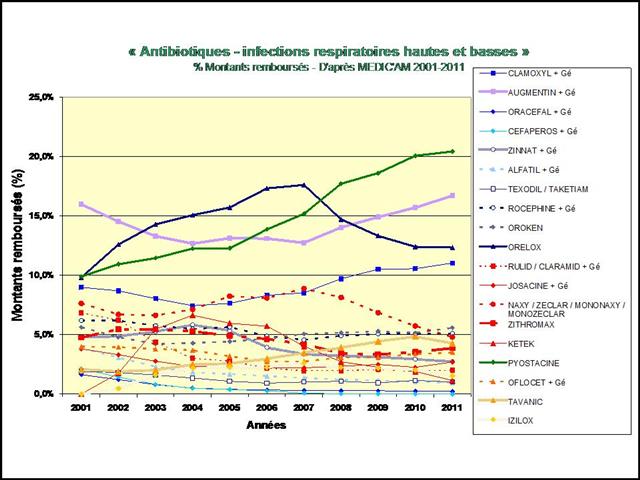
Que l’amoxicilline ne représente que seulement 11% des montants remboursés de notre panier, alors qu’il s’agit de l’antibiotique de référence dans la plupart des infections respiratoires hautes et basses, justifiant d’une antibiothérapie, et tout particulièrement dans les plus redoutées, à savoir l’angine streptococcique et la pneumonie communautaire à pneumocoque, est franchement désolant.
Et les CAPI n’y ont rien changé. En dépit des primes proposées (3.000 € en moyenne), les médecins « Capistes » ont réduit la part des antibiotiques génériqués dans leurs prescriptions ! (Source : Dossier de Presse Cnamts2)
Cliquer sur l’image ci-dessous pour télécharger le diaporama
Et pourtant, les différentiels de coûts de traitements journaliers, témoignent de l’important gisement d’économies encore mobilisables, tout en améliorant la qualité de la prescription antibiotique :
Cliquer sur l’image ci-dessous pour télécharger le diaporama
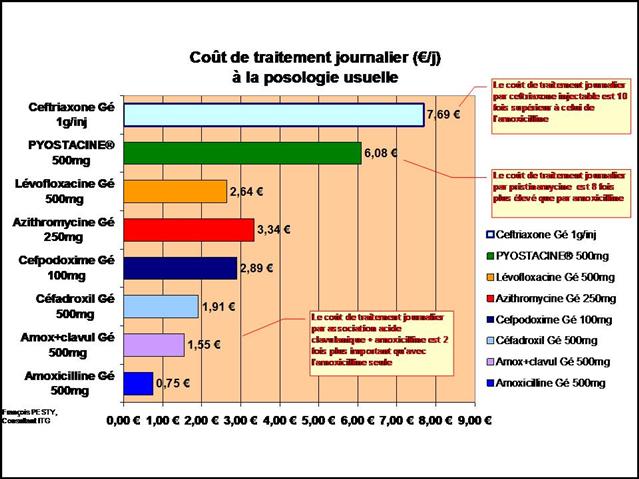
2. L’expérience emblématique de la visite académique du NPS australien, à enseigner dans les écoles françaises où sont formés nos DAM
Le samedi 1er décembre 2012, s’est tenue à Saint-Denis de la Réunion la 1ère Journée internationale de l’indépendance médicale (JI-IM), organisée par l’association de médecins MEDOCEAN, présidée par le Dr Philippe de CHAZOURNE, avec le soutien de l’ARS, et de sa directrice présente, Mme Chantal de SINGLY ; M. le Professeur Jean-Luc HAROUSSEAU, Président de la HAS, avait fait le déplacement, ainsi que MM. les Dr Bruno TOUSSAINT, Rédacteur en Chef de la revue PRESCRIRE, Philippe FOUCRAS, Président de l’association FORMINDEP, qui œuvre pour une formation et une information médicales indépendantes de tout autre intérêt que celui de la santé des personnes, Antoine de BECO, Président de la SFTG, Société de Formation Thérapeutique du Généraliste, co-organisatrice (entre autres choses) du Colloque d’avril 2012 « Surmédicalisation, surdiagnostics et surtraitements, pour ne citer que quelques intervenants.
L’intégralité des interventions et du débat a été enregistrée. La vidéo est accessible ici.
Mme Agnès VITRY, Pharmacienne française vivant depuis 15 ans à Adélaïde en Australie, ancienne lectrice de la revue PRESCRIRE, est intervenue pour présenter le dispositif du NPS « National Prescribing Service », créé en 2000, par le gouvernement australien (Cf. Vidéo 3ème partie)
Madame Agnès VITRY présentant le dispositif de visite académique en Australie - Cliquer pour ouvrir la vidéo

En s’appuyant sur les diapositives de la responsable du NPS, Mme Lynn WEEKS, qu’elle a traduites en français, elle nous apprend que :
- Des visiteurs médicaux indépendants sillonnent toute l’Australie depuis 12 ans,
- Ils abordent 3 à 4 thèmes par an… (probablement déjà un peu trop à mon goût, mais heureusement loin des 15 thèmes portés par nos pauvres « bourricots » de DAM, chez au moins 3 ou 4 catégories différentes de professionnels de santé …)
- Que l’impact de leur visites est soigneusement mesuré ;
- Que pour maintenir ou augmenter la subvention accordée tous les 4 ans par l’état australien, le NPS doit montrer que leur action a produit une amélioration de la qualité de l’utilisation du médicament en Australie,
- Amélioration se traduisant le plus souvent par une diminution des coûts
Mme VITRY poursuit en expliquant comment est réalisée la mesure d’impact de la visite académique du NPS sur les prescriptions médicamenteuses ; Celle-ci s’effectue en comparant les courbes d’évolution entre les médecins visités et les non visités. Ci-dessous, l’illustration graphique portant sur la prescription du clopidogrel présentée par Agnès VITRY lors de la 1ère JI-IM :
Evolution des prescriptions de clopidogrel en Australie chez les médecins visités ou non par le NPS - Cliquer pour ouvrir la vidéo
En région Languedoc-Roussillon, nous avions nous-mêmes mesuré les forts impacts obtenus lors de nos campagnes « pilotes » de visites médicalisées des DAM sur le bon usage des antibiotiques et des statines. Campagnes vite interdites par la direction de la Cnamts pour ne pas nuire aux intérêts financiers des firmes pharmaceutiques ; Ces mesures établissaient indiscutablement l’efficacité du dispositif resté « expérimental » que nous avions mis en place avec les caisses, comme en attestent les graphiques suivants :
Campagne régionale de visites médicalisées des DAM sur les antibiotiques - Hiver 2006-2007 :
Cliquer sur l’image ci-dessous pour télécharger le diaporama
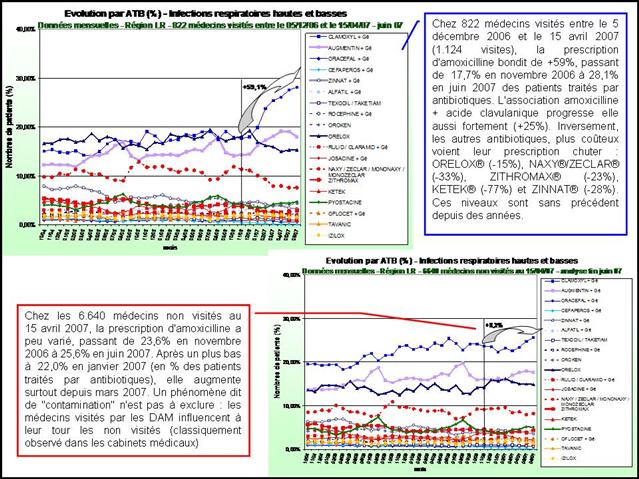
Il est vrai que nous disposions aussi d’outils d’évaluation individuelle des pratiques de prescription antibiotique, extrêmement fins. Et que nous avions réussi à combiner la démarche efficace de la visite en face à face, telle qu’elle est pratiquée par l’industrie, avec celles de l’EPP (Evaluation des pratiques professionnelles). Bref, un exemple de DPC (développement professionnel continu) appliqué à la prescription médicamenteuse des médecins généralistes. Ci-après, le graphique détaillé de prescription d’un médecin audois ayant particulièrement bien répondu lors de la campagne inaugurale menée par la CPAM de Carcassonne l’hiver 2005-2006. Une expérience en bonne place dans le rapport IGAS 2007 sur l’information des médecins généralistes sur le médicament.
Cliquer sur l’image ci-dessous pour télécharger le diaporama
Mais revenons au NPS australien. Juste après la présentation de Mme VITRY, s'en est suivi un échange par Skype interposé, entre Mme Lynn WEEKS, responsable du NPS Medicinewise, en duplex depuis Brisbane, et le Pr HAROUSSEAU
Le Pr HAROUSSEAU, Président de la Haute Autorité de Santé, France, interrogeant Mme WEEKS du NPS

M. HAROUSSEAU « Votre action est un peu différente de celle de la Haute Autorité de Santé en France, mais ressemble peut être à un mélange entre l’Assurance maladie et la HAS. Ma question est d’ordre budgétaire, puisqu’Agnès nous a dit que vous aviez eu un budget pour 4 ans et que vous deviez justifier vos demandes pour la période suivante par vos résultats. Quel est en fait le montant que vous aviez obtenu lors des 4 premières années ? Quel est votre budget finalement ? »
Mme Lynn WEEKS en duplex de Brisbane, Australie

Réponse de Mme Lynn WEEKS « Pour les 4 premières années, le budget était proche de 14 millions de dollars (Australiens) et sur cette période nous devions rapporter 18 millions de dollars d’économies pour l’assurance maladie australienne (PBS), actuellement, notre budget est de 45 millions de dollars par an et nous devons produire 70 millions d’économies annuelles. Ainsi, les économies générées représentent le double de la subvention que nous percevons. »
M. HAROUSSEAU « C’est excellent, et la question complémentaire c’est que, j’ai compris qu’elle finançait des visiteurs médicaux indépendants. Il y en a combien sur tout le territoire australien pour une population de 22 millions d’habitants ? »
Réponse de Mme Lynn WEEKS « Ils sont 120 visiteurs pour 25.000 médecins généralistes. La plupart travaillent en temps partiel, 2-3 jours par semaine »
Un participant « Dans le PowerPoint on voit que les médecins sont assez satisfaits de la visite académique. Quelle est la formation des personnes qui visitent les médecins ? Par ce qu' apparemment les médecins sont très satisfaits, alors que quand on a des visiteurs de l’assurance maladie, souvent les confrères considèrent que ce sont des gens pas formés, qui ne sont pas à même d’interpréter les statistiques qu’ils nous présentent, avec lesquels on ne peut finalement pas vraiment discuter. Qui élabore l’information qui est diffusée ? »
Réponse de Mme Lynn WEEKS (traduite par Mme Agnès VITRY) « La plupart de nos visiteurs sont des pharmaciens, mais aussi des médecins, et des kinésithérapeutes, formation de 3 jours sur la manière de communiquer avec les médecins, et formations de 2 jours spécifiques à chaque domaine thérapeutique sur lesquels ils interviennent. Pour les procédures éditoriales, le NPS commence par faire une revue de la littérature. Puis ensuite, ils organisent des réunions avec les médecins pour savoir quels sont les problèmes qu’ils rencontrent dans leur pratique quotidienne, en relation avec le sujet qui est traité, de façon à pouvoir incorporer ces éléments dans les messages qui seront ensuite développés et transmis par les visiteurs académiques »
3. Commentaires et conclusion
In fine, et au moins en ce qui concerne la visite des Délégués de l’Assurance Maladie sur les antibiotiques (nous analyserons très prochainement leurs résultats obtenus ou non sur les autres domaines thérapeutiques), le dispositif en place depuis 2004, reste désespérément inopérant. Cela pour des raisons maintes fois explicitées ici même, notamment à l’occasion des « Assises du médicament ». Pour la rendre opérante, il conviendrait, répétons-le de :
- Spécialiser les DAM par domaine thérapeutique
- Apporter aux DAM et à leur encadrement une formation très approfondie sur le thème abordé en visite
- Définir des objectifs de visites pertinents avec une argumentation robuste fondée sur les preuves cliniques et l’évaluation comparative des médicaments (Ne pas prendre pour « bible » toutes les productions des agences sanitaires, dont certaines ont été biaisées par une mauvaise gestion des conflits d’intérêts…)
- Doter les DAM (ou autres visiteurs) d’un matériel (promotionnel) de visite de qualité « professionnel »
- Les entraîner avec des « professionnels » de la visite et des médecins ou pharmaciens experts
- Opérer un ciblage efficace des médecins à visiter
- Réaliser des campagnes de visites itératives et inscrites dans la durée
- Doubler la visite d’une approche de type EPP, avec des outils de restitution des pratiques individuelles de prescription détaillés et actualisés, en s’inspirant du modèle de la visite académique
Le rapport sur « La prescription, la consommation et la fiscalité des médicaments » fait en avril 2008 au nom de la MECCS (Mission d’évaluation et de contrôle des comptes de la sécurité sociale de l’Assemblée Nationale) par Madame Catherine LE MORTON, actuelle Présidente de la commission des affaires sociales, adopté à l’unanimité par la même commission, mais vite mis aux oubliettes en 2008, et qui prônait de mettre sous tutelle de la HAS le réseau des DAM, comme d’ailleurs l’avait préconisé l’association de consommateurs « UFC-Que choisir ? », semble hélas, malgré des réminiscences parlementaires qui l’avait « déterrer » l’an passé, avoir été à nouveau placardisé…
Les autorités de santé, le pouvoir politique, feraient bien de s’inspirer des résultats obtenus par le NPS australien, pour rendre enfin opérante la visite des DAM en France sur le médicament !
Quelques ressources documentaires supplémentaires, produites récemment par les institutions, sont proposées ci-après. Néanmoins, en l’absence d’une action efficace d’information conduite en direction des médecins prescripteurs, comme pourrait l’être une visite des DAM rendue opérante, ces éléments d’information, aussi intéressants soient-ils, n’auront qu’une portée extrêmement limitée…
François PESTY
Expert Conseil indépendant - Campagnes « pilotes » de visite médicalisées des DAM sur le médicament
[1] Dossier de presse CNAMTS « Antibiotiques : Où en est-on ? », 05/2010
[2] Dossier de Presse CNAMTS, « Contrat d’Amélioration des Pratiques Individuelles (CAPI) : une dynamique au bénéfice des patients », 19/09/2010
Ressources documentaires complémentaires récentes sur les antibiotiques :
- Dix ans d’évolution des consommations d’antibiotiques en France - Rapport ANSM (anciennement AFSSAPS), 07/2012
- Surveillance de la consommation et de la résistance aux antibiotiques - Numéro thématique - BEH N° 42-43, InVS, 13/11/2012
- Les bactéries résistantes aux antibiotiques - La note d’analyse N° 299, Centre d’analyse stratégique (CAS), 11/2012
- Lettre de démission du Groupe de travail de l’AFSSAPS sur les anti-infectieux, 07/12/2011
- Lettre de réponse du Pr Dominique MARANINCHI aux membres du groupe de travail AFSSAPS sur les anti-infectieux, 07/12/2011
03/10/2012 - Les sartans ne sauvent pas de vies, contrairement aux IEC qui réduisent de 10% la mortalité totale, selon une récente méta-analyse1 réalisée sur 20 études cliniques et près de 160.000 patients…
Des exemples comme celui-ci, où une nouvelle classe de médicaments qualifiée initialement d’innovante, s’avère à l’usage moins performante que celle qui l’a précédée, devraient inciter les autorités d’évaluation (HAS) à créer un nouveau niveau d’ASMR (ou d’ITR) afin de reconnaître la « régression thérapeutique » (progrès négatif), une situation finalement assez fréquente et qui jouie d’une bien complaisante impunité de la part de la force publique…
Comme souvent lorsque les études comparatives font défaut, il devient nécessaire de faire appel aux méta-analyses pour départager les différentes stratégies thérapeutiques.
Bien que publiée « online » le 17 avril 2012, mais dans une revue médicale de second rang (European Heart Journal, la revue de la société européenne de cardiologie), ce travail1 refait surface peu après sa publication dans les pages de la revue (fin août), et, tirons notre chapeau à Pratis TV qui a su braquer dessus le projecteur.
Il faut bien dire que ses résultats sont lourds de conséquences pratiques en matière de prescription courante, et doivent embarrasser plus d’un cardiologue, que dire des leaders d’opinion !
En effet, plusieurs chercheurs néerlandais (ROTTERDAM), français (LILLE et BOBIGNY), et anglais (LONDRES) ont eu la bonne idée de colliger les données de la vingtaine d’essais thérapeutiques publiés ces dix dernières années, ayant évalué sur des critères de mortalité totale et/ou cardiovasculaire les IEC et les sartans, chez près de 160.000 patients.
SCOOP :
Une réduction de plus de 10% de la mortalité totale est observée dans les études avec IEC, alors qu’aucune diminution statistique ne l’est dans les études qui ont inclus un sartan.
Ce résultat semble homogène, puisqu’aucun sartan ne se différentie des autres en termes de mortalité totale ou même de mortalité cardiovasculaire.
Cliquer sur l’image pour télécharger les diapositives
Voilà qui donne raison au Dr Martin STRAUSS, et à ses embarrassants travaux qui avaient jusqu’ici été totalement étouffés et passés sous silence par l’ESC, la société européenne de cardiologie : http://www.puppem.com/Pages/Actu2008s2.html#STRAUSS
Rappelons que peu d’antihypertenseurs peuvent se targuer d’avoir dans leur indication AMM une mention du type « Le traitement au long cours améliore la survie à long terme, réduit le risque de récidive d'infarctus ainsi que le risque de développement d'une insuffisance cardiaque » comme c’est le cas pour le captopril, chef de file des IEC, après infarctus du myocarde. Ce médicament génériqué en 2000, est beaucoup trop ancien pour être encore prescrit par plus d’une poignée de prescripteurs ayant résisté jusqu’ici aux sirènes de l’industrie, trop ancien (et trop efficace) pour avoir été inclus dans les essais thérapeutiques de ces douze dernières années. Il n’en demeure pas moins le « best in class » et le moins coûteux. Et point besoin de méta-analyse pour le savoir, car cette mention, il l’a doit tout simplement à une étude clinique, l’étude SAVE, datant de… septembre 1992, voici tout-justes vingt ans. Dans cette étude il réduisait de 19% la mortalité après infarctus du myocarde. Aucun autre IEC, aucun sartan ne possède cette mention (réduction de la mortalité totale)...
Conclusion de la méta-analyse récente :
Les IEC en première intention, les sartans à réserver aux intolérances sévères aux IEC…

Interview du Pr Jean-Jacques MOURAD, co-auteur de la méta-analyse, sur Pratis TV
Morceaux choisis : « Les résultats ne me surprennent pas, ils peuvent surprendre certains qui ont trop souvent réduit la prévention cardiovasculaire par les traitements antihypertenseurs à la pure baisse de la pression artérielle... Cette information est importante pour ceux qui veulent baser leur prescription sur les preuves ; Nous n'aurons plus de grands essais thérapeutiques incluant la classe des inhibiteurs du système rénine-angiotensine, les IEC ou sartans, cette classe étant aujourd’hui globalement dans le domaine public (SIC génériquée et sans intérêt financier pour l’industrie du médicament)… Les prescripteurs ont en France des préférences pour les sartans (en raison de leur meilleure tolérance), moi je fais le pari que ces malades (les hypertendus) méritent d’avoir en première intention les molécules qui ont eu le plus haut niveau de preuve en prévention primaire comme secondaire, et en particulier par leur capacité à prolonger la vie, et de dédier les molécules qui ont moins de niveau de preuve en cas d’intolérance aux premières. C’est quelque chose qui est dans certains pays parfaitement écrit dans les recommandations. En France nous avons une vraie liberté de prescription en première et en deuxième intention. A nous quand même de rationnaliser notre prescription… La HAS recommandait essentiellement sur des données économiques, de coût, une prescription préférentielle des IEC par rapport aux sartans. Je n’ai jamais été un fan des recommandations purement économiques. Il faut reconnaître néanmoins que nous avons là un vrai argument sanitaire pour cautionner ce type de recommandation »

Eléments de réflexion à partir de cet exemple marquant :
Au moment ou le Pr Jean-Luc HAROUSSEAU, Président de la HAS, suivant ainsi les injonctions des firmes pharmaceutiques, piétine d’impatience pour remplacer au plus vite l’indicateur éprouvé d’évaluation comparative des médicaments, à savoir l’amélioration du service médical rendu (ASMR), par un bien « fumeux » Index Thérapeutique Relatif, le vrai progrès ne serait-il pas de :
- Créer un niveau VI (ou -I), d’ASMR, pour le progrès négatif !
Il faut bien dire que contrairement aux réticences des industriels, l’ASMR est parfaitement compréhensible. Il suffit actuellement de savoir compter jusqu’à 5 pour comprendre quel est l’apport réel d’un nouveau médicament sur l’arsenal déjà existant :
Niveau I = progrès majeur ; Niveau II = progrès important ; Niveau III = progrès modeste ; Niveau IV = progrès mineur ; Niveau V = progrès nul ou absence de progrès
Qui trouvait ça compliqué ? Mis à part les industriels du médicament qui ont horreur de l’évaluation comparative.
N’ayant pas réussi (c’est inhabituel) à publier mes commentaires à la suite de l’interview récente du Pr HAROUSSEAU sur Celtipharm, je me permets de les reproduire ci-dessous. En bleu, les propos tenus par le président de la Haute Autorité :
« …sur des indicateurs intermédiaires, pour quand il n’y aura pas de supériorité sur les indicateurs principaux ».
Eh bien là, je dis NON ! C’est ça justement qui ne va pas dans l’ITR. C’est son aptitude à repêcher des médicaments qui en définitive n’apporte rien, puisque l’on prendra en compte des indicateurs intermédiaires qui n’ont aucun intérêt !
« Les indicateurs intermédiaires compteront moins dans le calcul de l’index thérapeutique relatif. Par ailleurs, on tiendra compte de la tolérance qui viendra pondérer le jugement sur l’efficacité. Par exemple un médicament pourra être d’efficacité identique sur les critères principaux et sur les critères intermédiaires mais il sera mieux toléré. Ou, à l’inverse, un médicament sera plus efficace mais il sera nettement moins bien toléré. Enfin, il y aura une dernière pondération sur le mode d’administration. On peut imaginer qu’un médicament soit aussi efficace, toléré de la même façon mais d’administration nettement plus facile. ».
Ni vu ni connu, je t’embrouille. Nous ne comprenons plus rien.
« C’est un indicateur comparatif séquentiel semi-quantitatif, c’est-à-dire que, pour chaque palier d’évaluation, la CT donnera une hiérarchie de l’effet. Ainsi sur le critère efficacité, critère majeur, ou sur l’indicateur qualité, critère mineur, on aura un ITR défini par 5 niveaux : moins efficace, efficacité identique, efficacité légèrement supérieure, efficacité moyennement supérieure, efficacité nettement supérieure. Cela aboutira à un index comparatif séquentiel semi-quantitatif, puisqu’on ne va pas donner des seuils qui permettent de passer d’un niveau à un autre. On va donner des ordres de grandeur »
Ben, je ne sais pas vous, mais moi je ne comprends toujours pas ce que c’est que ce « schmilblick », dont on espère ne jamais voir la traduction dans un article du prochain PLFSS 2013…
Personnellement, le seul grief que je pourrais faire à l'ASMR, c'est la méconnaissance qu'en a la grande majorité des prescripteurs. Mais, c'est un autre débat...
Mais, reprenons notre exemple portant sur la comparaison des stratégies antihypertensives avec IEC ou sartans, et appliquons leurs un barème tel que celui vanté par le Président de la HAS :
- Critère principal d’efficacité = Mortalité totale : IEC 10 pts / sartans 0 pt
- Critère intermédiaire d’efficacité = baisse de la pression artérielle : IEC 10 pts / sartans 10 pts
- Critère de tolérance = toux gênante : IEC 0 pt / sartans 10 pts
- Critère de praticité = non applicable
Résultat >>> IEC = sartan
Eh bien, non. Pas d’accord du tout…
Il ne suffit pas de faire baisser la pression artérielle pour éviter des décès. Les IEC sont utiles, ils protègent des vies. Les sartans sont des médicaments inutiles…
François PESTY
PS : Je vous laisse imaginer si après avoir rendu « opérante » la visite des délégués de l’assurance maladie sur le médicament, les DAM étaient formés comme il se doit pour présenter aux médecins cette étude (entre autres choses, car il y a de la matière sur le sujet des IEC et sartans, et plus généralement des antihypertenseurs…)
[1] Angiotensin-converting enzyme inhibitors reduce mortality in hypertension: a meta-analysis of randomized clinical trials of renin–angiotensin–aldosterone system inhibitors involving 158 998 patients. Laura C. van Vark et al. European Heart Journal (2012) 33, 2088–2097. Téléchargeable ici
27/07/2012 - Madame la Ministre, vous ne pourrez plus ignorer comme votre prédécesseur, la recommandation 2010-25 du Conseil de l’Hospitalisation, après ces 2 rapports de l’IGAS qui pointent du doigt la mauvaise gestion de la liste des médicaments onéreux !
Faisant suite à la diffusion publique ce mois-ci de deux rapports de l’IGAS (Inspection générale des affaires sociales) abordant la gestion des médicaments onéreux remboursés en sus des prestations d’hospitalisation, et pour « battre le fer pendant qu’il est encore chaud », nous vous proposons de répondre à 3 questions lancinantes :
- Quel est le progrès thérapeutique réellement apporté par les dix molécules anticancéreuses les plus couteuses de la liste en sus en 2010 ?
- Quel est le progrès thérapeutique réellement apporté par les molécules anticancéreuses inscrites sur la liste en sus en 2011 et 2012 ?
- Les radiations de médicaments anticancéreux de la liste en sus ont-elles respecté les principes définis par le Conseil de l’hospitalisation ?
Rappelons que la recommandation 2010-25 du Conseil de l’hospitalisation a été publiée en annexe du rapport 2011 au parlement sur la T2A.
Préambule
Cliquer sur l’image ci-dessous pour télécharger le rapport

> 1er rapport IGAS
Le journal Le Monde, qui se l’était procuré, s’en est le premier fait l’écho dans son édition du 11 juillet, et La Lettre Annuaire Sécu a permis à de nombreux internautes de le télécharger. Le rapport IGAS, « Evaluation du dispositif de financement des médicaments en sus des prestations d’hospitalisation dans les établissements de santé », daté de février 2012, remis au ministre de l’époque Xavier BERTRAND, émanant de deux inspecteurs, médecins, extrêmement chevronnés, les Dr Gilles DUHAMEL et Aquilino MORELLE, n’est pas tendre avec le dispositif ;
Dès le second paragraphe de la synthèse du rapport, l’inspection reprend mot à mot le constat fait ici-même dans un article posté en août 2011 : « dispendieux, opaque, irrationnel et non éthique, profitant plus aux firmes pharmaceutiques qu’aux patients ». La réalité du caractère innovant des anticancéreux de la liste en sus est largement mise en doute, de même que l’utilité de nombreuses chimiothérapies en fin de vie…
Néanmoins, ce rapport brille sur le constat, un peu moins sur ses préconisations. En particulier, prétextant des raisons techniques liées aux modalités actuelles du « codage » de l’activité dans les établissements, il ne recommande pas explicitement une gestion indication par indication des médicaments de la liste. Les inspecteurs semblent avoir oublié que dans le cadre des contrats de bon usage des médicaments, lors de la prescription de ces médicaments onéreux il est déjà demandé aux établissements de tracer l’indication retenue.
Il suffirait donc d’imposer une codification des indications AMM. Certains logiciels ou fichiers d’interopérabilité (La CIOsp de PHAST) supportent déjà ce type de fonctionnalité…
Cliquer sur l’image ci-dessous pour télécharger le rapport

> 2nd rapport IGAS/IGF
Madame la Ministre, Marisol TOURAINE, est allée jusqu’à en faire une page du site Internet de son grand Ministère, à l’occasion de sa publication le 19 juillet. Le rapport conjoint IGAS / IGF (inspection générale des finances), intitulé « Propositions pour la maîtrise de l’ONDAM 2013-2017 » aborde également la question et préconise notamment :
« Une gestion active de la liste en sus, via l’application stricte des règles d’inscription et de radiation. Conformément à la recommandation du 18 novembre 2010 du Conseil de l’hospitalisation, les médicaments à ASMR IV ou V qui bénéficient d’une alternative thérapeutique pris en charge dans les tarifs des GHS, ne seraient plus inscrits sur la liste. En outre, un nouveau médicament d’ASMR IV ou V dont une alternative thérapeutique est déjà inscrite sur la liste en sus, ne pourrait l’être qu’à la condition d’une baisse globale des prix de la classe concernée »
1. Quel est le progrès thérapeutique réellement apporté par les dix molécules anticancéreuses les plus couteuses de la liste en sus en 2010 ?
Le rapport de juillet 2012 « Situation de la chimiothérapie des cancers en 2011 » de l’Institut National du Cancer (INCa), s’appuyant sur le slogan « Faciliter l’accès aux traitements par molécules innovantes » extrait du Plan Cancer 2009-2013 et aux allures de publicité mensongère (Cf. infra), a le mérite de nous communiquer le palmarès 2010 des 10 molécules anticancéreuses de la liste en sus les plus coûteuses pour l’assurance maladie.
En l’absence de diffusion publique par l’ANSM (ex-Afssaps) d’un fichier détaillé et complet des dépenses de médicaments à l’hôpital, cette publication de l’INCa était très attendue pour réactualiser notre tableau d’évaluation du progrès thérapeutique des molécules figurant au palmarès dans leurs principales indications. Résistons à l’envie de se faire des gorges chaudes de la reprise par les inspecteurs de l’IGAS Gilles DUHAMEL et Aquilino MORELLE, dans leur rapport sus-mentionné de l’intégralité des résultats de notre étude publiée ici même en août 2011 et contentons-nous simplement de réactualiser ces données édifiantes (puis de les compléter plus loin par une autre étude non moins édifiante...).
La précédente version avait été réalisée sur la base disponible à l’époque des classements INCa 2008 et 2009.
En 2010, les anticancéreux ont représenté 54% des dépenses de la liste en sus des établissements MCO1 publics2, soient 1,060 Milliard d’euros.
Les dix premières molécules anticancéreuses de la liste en sus totalisaient 980 millions d’euros de dépenses en 2010, soit 92,4% du total. AVASTIN®, HERCEPTIN® et ALIMTA® ont présenté une croissance à 2 chiffres en 2010.
A noter que pour la première fois, l’INCa publie les dépenses des médicaments anticancéreux de la liste en sus dans les établissements privés (à but lucratif). La dépense totale s’est élevée à 493 millions d’euros. Seule deux molécules du top dix 2010 dans le privé, ne figurent pas au palmarès des établissements publics, à savoir le panitumumab, VECTIBIX® et la gemcitabine, GEMZAR®. Les huit autres molécules communes aux deux palmarès représentaient 449 millions d’euros et 91,1% de la dépense totale. Au total, ce sont donc 1,330 Milliard d'euros qui ont été dépensés en 2010 par l'hospitalisation publique et privée pour ces dix plus coûteuses molécules anticancéreuses.
Le tableau ci-après ne concerne que les seuls hôpitaux publics ou participant au service public (ESPIC).
Tableau 1 réactualisé - Evaluation du « progrès thérapeutique » dans les indications principales des 10 premières molécules onéreuses en 2010 et 2009 dans les établissements publics MCO ;
Molécule | Nom de marque | Classement 2010 | % dépenses 2010 | Classement 2009 | % dépenses 2009 | Indications | ASMR | Remarques |
Bévacizumab | AVASTIN® | 1 | 21,1% | 1 | 19,3% | Colorectal | IVa | |
Sein | Vb | Indication retirée aux USA |
Poumon non à petite cellule | Vc | |
Rein | IVd | |
Rituximab | MABTHERA® | 2 | 17,3% | 2 | 16,8% | Lymphomes | Ie,f | |
Polyarthrite rhumatoïde | IIg | |
Leucémie lymphoïde Chronique | IVh, IIIi | |
Trastuzumab | HERCEPTIN® | 3 | 13,8% | 3 | 12,8% | Sein | Ij, IIk, Vl, absencek,m | |
Estomac | IVn | |
Docétaxel | TAXOTERE® | 4 | 11,1% | 4 | 11,5% | Poumon non à petite cellule | IVo | Radié en mars 2012 |
Sein | IIo, p, q | |
Prostate | IIIr | |
Estomac | IVs | |
carcinomes épidermoïdes | IIIt, IIu | |
Pémetrexed | ALIMTA® | 5 | 9,0% | 5 | 8,1% | Mésothéliome pleural malin | IIIv | |
Poumon non à petite cellule | Vv, w, IVx | |
Cétuximab | ERBITUX® | 6 | 7,2% | 6 | 6,7% | Colorectal | Vy, z, IVz | |
Tête et cou (c. épidermoïde) | IIIaa, ab | |
Bortézomib | VELCADE® | 7 | 5,6% | 7 | 5,5% | Myélome multiple | IIac, Vad,
IVae, IIIaf | |
Azacitidine | VIDAZA® | 8 | 3,5% | | | syndrome myélodysplasique | II | |
Irinotécan | CAMPTO® | 9 | 2,0% | 8 | 4,8% | Colorectal | absenceag | Radié en mars 2011 |
Gemcitabine | GEMZAR® | | | 9 | 3,4% | Poumon non à petite cellule | absenceah | Radiée en mars 2011 |
Sein | Vai |
Doxorubicine | CAELYX® | 10 | 1.8% | 10 | 2,0% | Ovaire | Vaj | |
Sein | IIIak | |
Myélome multiple | Val | |
| | Totaux | 92,4% | | 90,9% | | | |
Pour rappel : ASMR V : amélioration nulle ou absence d’amélioration du service médical rendu ; ASMR IV : amélioration mineure ; ASMR III : amélioration modérée ; ASMR II : amélioration importante; ASMR I : amélioration majeure
Remarque importante : La présence d’une ASMR de niveau I (majeure) ou II (importante) dans le tableau ne signifie pas pour autant qu’il n’existe pas d’autres alternatives apportant un bénéfice de même niveau à un moindre coût. Exemple : Tout en accordant le 9 janvier 2002 une ASMR de niveau II au TAXOTERE® en association à la doxorubicine dans le cancer du sein localement avancé ou métastasé, la commission de transparence fait remarquer que « En revanche, en raison de la fréquence des effets indésirables et des arrêts de traitement occasionnés, le TAXOTERE ne constitue pas un réel progrès en terme de tolérance par rapport au TAXOL » (docétaxel) et renvoie à son avis du 10/01/1996.
Le moteur de recherche de la HAS a été utilisé systématiquement pour ces dix molécules afin, le cas échéant, de prendre en compte dans l’analyse d’éventuels nouveaux avis de la commission de la transparence, qui auraient été publiés postérieurement à notre étude de l’an passé.
Principales observations :
- La gemcitabine, GEMZAR®, 9ème en 2009, radiée en mars 2011 (le labo LILLY avait sans doute « levé le pied »), sort du classement.
- L’azacitidine, VIDAZA® fait son entrée en 9ème position.
- Tous les autres ont augmenté leur poids dans le total des dépenses à l’exception du TAXOTÈRE® qui régresse un peu (radié en mars 2012, Sanofi avait probablement déjà réduit ses efforts promotionnels…), CAMPTO® (radié en mars 2011, même remarque) et CAELYX®.
- A l’exception du nouvel entrant au palmarès, l’azacytidine, VIDAZA®, qui s’est vu octroyer une ASMR II (progrès majeur) dans le syndrome myélodysplasique le 29 avril 2009, aucune nouvelle ou modification d’ASMR n’a été publiée par la HAS ; Nous invitons les lecteurs à se reporter aux références et liens hypertextes renvoyant aux avis correspondants de la commission de la transparence mentionnés à la suite du tableau de l’an passé. Cliquer ici pour l'ouvrir dans une autre fenêtre. Le lien vers l’avis sur VIDAZA® a été inséré directement dans le tableau ci-dessus.
Les figures ci-dessous illustrent le niveau de progrès thérapeutique apporté par les molécules du « top 10 » en 2009 et 2010, ainsi qu'en 2008 et 2009.
Au total, et au gré de la sortie du palmarès de l’oxaliplatine, ELOXATINE®, remplacée par l’azacytidine, VIDAZA®, le progrès thérapeutique des onze molécules classées aux dix premières places en 2009 et 2010 des anticancéreux les plus coûteux, progresse à la marge. Le pourcentage des indications principales avec progrès majeur ou important passant de 18,9% à 22,3%.
Notons toutefois, que selon le bilan réalisé par la HAS pour l’année 2011, aucune molécule anticancéreuse ne s’est vue attribuer l’an passé une ASMR de niveau I ou II (Source : Rapport annuel 2011 d'activité de la HAS, publié en juillet 2012).
Nous restons donc sur le même constat : Près de 80% des indications principales des dix molécules les plus onéreuses utilisées dans le cancer et inscrites sur la liste en sus des GHS apportent un progrès thérapeutique nul, mineur, modeste, ou non mesuré, alors que ces molécules mobilisent 90% des ressources financières !
La panne d’innovation est bien réelle. Alors pourquoi encore inscrire de nouvelles molécules sur la liste. C’est à cette question que nous tenterons de répondre à présent.
2. Quel est le progrès thérapeutique réellement apporté par les molécules anticancéreuses inscrites sur la liste en sus en 2011 et 2012 ?
N’importe qui pourrait se livrer à cet exercice. On s’étonne qu’aucune institution ne l’ait déjà réalisé ; Cela décidément ne doit intéresser que quelques rares iconoclastes qui se passionnent pour la maîtrise médicalisée des dépenses de médicaments…
La liste « en sus » actualisée est téléchargeable sur le site de l’ATIH, agence technique de l’information sur l’hospitalisation, ici.
Pour vérifier qu’ils possèdent des indications AMM dans le cancer, il suffit de reprendre un à un les libellés de médicaments (colonne D du fichier Excel) et de les entrer dans l’une des bases de données médicamenteuses agrées par la HAS. Essayons par exemple, la base THÉRIAQUE dont le site web a fait récemment « peau neuve » pour le plus grand plaisir de nos yeux, ici. Cliquer sur « Monographie » puis sur « Indications ».
Pour les médicaments ayant une indication AMM dans le cancer. Télécharger les avis de la commission de la transparence à l’adresse citée plus haut.
Le tableau suivant reprend en chronologie inversée les ASMR décernées en 2011 et 2012 à la date d’aujourd’hui par la commission de la transparence dans les indications principales des molécules anticancéreuses inscrites sur la liste en sus.
Tableau 2 - Evaluation du « progrès thérapeutique » dans les indications principales des molécules anticancéreuses inscrites sur la liste en sus en 2011 et 2012, par chronologie inversée ;
Molécule | Nom de marque | Date d’inscription | Indications | ASMR | Remarques |
Topotécan | Génériques d’HYCAMTIN® | 10/07/2012 | Carcinome de l'ovaire | IIIa (1997) | Premier arrêté d’inscription pris par Mme Marisol TOURAINE |
Cancer poumon petite cellule | Vb, IVc |
Carcinome col utérin | IVd |
Ipilimumab | YERVOY® | 24/04/2012 | Mélanome malin | IVe | Dernier anticancéreux inscrit par M. Xavier BERTRAND
La Revue Prescrire préfère le réserver aux essais cliniques… |
Eribuline | HALAVEN® | 22/03/2012 | Cancer du sein | IVf | |
Ofatumumab | ARZERRA® | 13/03/2012 | Leucémie lymphoïde chronique | Vg | Ce médicament a obtenu une AMM Européenne conditionnelle ! |
Topotécan | POTACTASOL® (=Génériques d’HYCAMTIN®) | 24/01/2012 | Carcinome de l'ovaire | IIIa (1997) | |
Cancer poumon petite cellule | Vb, IVc |
Carcinome col utérin | IVd |
Idarubicine | ZAVEDOS® | 25/11/2011 | Leucémie aigüe myéloblastique | IIIh | |
Topotécan | Génériques d’HYCAMTIN® | Carcinome de l'ovaire | IIIa (1997) | |
Cancer poumon petite cellule | Vb, IVc |
Carcinome col utérin | IVd |
Idarubicine | Génériques de ZAVEDOS® | 21/10/2011 | Leucémie aigüe myéloblastique | IIIh | |
Idarubicine | Génériques de ZAVEDOS® | 18/08/2011 | Leucémie aigüe myéloblastique | IIIh | |
Docétaxel | Génériques de TAXOTÈRE® | Poumon non à petite cellule | IVi | Radiés en mars 2012 |
Sein | IIi, j, k |
Prostate | IIIl |
Estomac | IVm |
carcinomes épidermoïdes | IIIn, IIo |
Topotécan | Génériques d’HYCAMTIN® | 17/08/2011 | Carcinome de l'ovaire | IIIa (1997) | |
Cancer poumon petite cellule | Vb, IVc |
Carcinome col utérin | IVd |
Topotécan | Génériques d’HYCAMTIN® | 22/06/2011 | Carcinome de l'ovaire | IIIa (1997) | |
Cancer poumon petite cellule | Vb, IVc |
Carcinome col utérin | IVd |
Topotécan | Génériques d’HYCAMTIN® | 27/04/2011 | Carcinome de l'ovaire | IIIa (1997) | |
Cancer poumon petite cellule | Vb, IVc |
Carcinome col utérin | IVd |
Idarubicine | Génériques de ZAVEDOS® | Leucémie aigüe myéloblastique | IIIh | |
Idarubicine | Génériques de ZAVEDOS® | 22/04/2011 | Leucémie aigüe myéloblastique | IIIh | |
Docétaxel | Génériques de TAXOTÈRE® | Poumon non à petite cellule | IVi | Radiés en mars 2012 |
Sein | IIi, j, k |
Prostate | IIIl |
Estomac | IVm |
carcinomes épidermoïdes | IIIn, IIo |
Docétaxel | Génériques de TAXOTÈRE® | 19/01/2011 | Poumon non à petite cellule | IVi | Radiés en mars 2012 |
Sein | IIi, j, k |
Prostate | IIIl |
Estomac | IVm |
carcinomes épidermoïdes | IIIn, IIo |
Irinotécan | Génériques de CAMPTO® | 06/01/2011 | Colorectal | absencep | Radiés en mars 2011 |
Bendamustine | LEVACT® | Leucémie lymphoïde chronique | IIIq | |
Lymphome non hodgkinien |
Myélome multiple | Vq |
Trabectédine | YONDELIS® | 05/01/2011 | Cancer de l’ovaire | Vr | |
Sarcome des tissus mous | Vs |
En définitive, les 9 molécules anticancéreuses ayant fait l'objet d'inscriptions sur la liste en sus totalisent 24 indications AMM, aucune ne présente une amélioration majeur (ASMR I), 4 soit 16,7% correspondent à un progrès important (ASMR II), 7 apportent un progrès modeste (ASMR III), soit 29,2%, 7 autres un progrès mineur (ASMR IV) 29,2%, 5 n'apportent aucun progrès (ASMR V) 20,8% et pour une indication le progrès n'a pu être évaluée (absence d'ASMR). Une de ces molécules a été radiée au cours de la période d'étude (Irinitécan, CAMPTO®, 03/2011).
Retenons donc ce fait marquant, 16,7% des indications des molécules anticancéreuses inscrites sur la liste en sus depuis 2011 apportent un progrès important, soit seulement une sur six ! Et aucune n'amène un progrès majeur.
A contrario, plus de la moitié des indications apportent un progrès mineur, nul ou non évalué, ce qui ne devrait pas autoriser l'inscription sur la liste en sus.
Enfin, près de trois indications sur dix ayant fait l'objet d'inscription sur la liste correspondent à un progrès modeste.
Il est urgent de limiter les inscriptions sur une liste de médicaments aussi généreusement remboursée par l'Assurance maladie aux seules vraies innovations thérapeutiques. Le seul moyen d'y parvenir consiste à gérer la liste indication par indication pour chaque médicament.
Cliquer sur l'image pour télécharger les diapos d'évaluation du progrès thérapeutique apporté par les anticancéreux de la liste en sus
3. Les radiations de médicaments anticancéreux de la liste en sus ont-elles respecté les principes définis par le Conseil de l’hospitalisation ?
Les radiations de médicaments de la liste en sus qui ne respectent pas les principes définis par le conseil de l’hospitalisation dans sa recommandation 2010-25, et elles ont toutes été dans ce cas jusqu’à présent, ajoutent à la gabegie une dimension de non éthique tout à fait inadmissible, en créant un fort biais de prescription.
En effet, pour une molécule, la radiation constitue en quelque sorte un dérembousement. Contrairement aux molécules inscrites sur la liste, lesquelles sont remboursées sans sourcilier au centime d’euro près par l’Assurance maladie dès lors qu’elles ont été prescrites dans le cadre d’une indication AMM ou d’un PTT (protocole thérapeutique temporaire, équivalent à une situation pré-AMM), les « bannies » de la liste, devront être financées par les recettes de l’activité des hôpitaux. Ainsi la molécule onéreuse inscrite sur la liste en sus ne coûte rien à l’hôpital, alors que le coût d’achat d’un médicament inclus dans les tarifs « mange » la marge opérationnelle…
Le principe très « sain » adopté le 18 novembre 2010 par le Conseil de l’Hospitalisation, dont le secrétariat est assuré par le Directeur général de l’offre de soins (DGOS) consistait à ne pas créer de situation où certains médicaments seraient sortis de la liste alors que d’autres partageant les mêmes indications y resteraient :
« Il convient dans tous les cas d’examiner la situation des médicaments à même visée thérapeutique afin de préserver une égalité de traitement »
Force est de constater que ce principe n’a jamais été respecté !
Parmi les molécules anticancéreuses radiées et qui offrent encore une alternative tout à fait crédible dans leurs indications principales aux médicaments beaucoup plus onéreux qui sont restés sur la liste, d’où un encouragement à les prescrire, citons :
- Radiations au 1er mars 2010 (Arrêté du 15/02/2010) : Paclitaxel (TAXOL® et génériques), Vinorelbine (NAVELBINE® et génériques), Oxaliplatine (ELOXATINE® et génériques), Fludarabine (FLUDARA® et génériques), Epirubicine (FARMORUBICINE® et génériques),
- Radiations au 1er mars 2011 (Arrêtés du 28/01/2011 et du 18/03/2011) : Gemcitabine (GEMZAR® et génériques), Irinotécan (CAMPTO® et génériques),
- Radiations au 1er mars 2012 (Arrêté du 21/02/2012) : Docétaxel (TAXOTÈRE® et génériques)
Il aurait été bien préférable de radier par la même occasion pour les indications où ils apportent un progrès mineur ou nul, toutes les molécules partageant les mêmes visées thérapeutiques.
Exemple : Pourquoi avoir conserver le pémetrexed, ALIMTA® sur la liste en sus alors que l’on a radié le paclitaxel, et que la première molécule n’apporte aucun progrès et coûte 71 fois plus chère que la seconde ?
Madame la Ministre, s’il vous plait, faites quelque chose…
Bien cordialement
François PESTY
[1] MCO = Médecine, chirurgie, obstétrique
[2] Publics = CHU (Centre Hospitalo-Universitaire) + CH (Centre Hospitalier) + CRLCC (Centre Régional de lutte contre le cancer) + ESPIC (Etablissement de santé privé d’intérêt collectif) = anciens PSPH (participant au service public hospitalier) + hl (Hôpital local)
HYCAMTIN® / Topotécan
[a] Avis de la commission de la transparence – HAS – 05/02/1997 – HYCAMTIN® - Inscription Collectivités dans l’indication « Carcinome métastatique de l'ovaire après échec d'une ou plusieurs lignes de chimiothérapie » : http://www.has-sante.fr/portail/jcms/c_248151/avismedicamentct032608pdf (Compte tenu de son rapport bénéfice/risque HYCAMTIN apporte une amélioration du service médical rendu modeste de niveau III dans le traitement du cancer de l'ovaire.) Nota avis consultable sur THÉRIAQUE, mais pas sur le site de la HAS…
[b] Avis de la commission de la transparence – HAS – 21/06/2006 – HYCAMTIN® - Inscription Collectivités dans l’extension d’indication «cancer du poumon à petites cellules (CPPC) en rechute lorsque la réintroduction de la première ligne de traitement n’est pas appropriée » : http://www.has-sante.fr/portail/jcms/c_248151/avismedicamentct032608pdf (Compte tenu de l’absence de données avec la forme intraveineuse dans le cancer du poumon à petites cellules en rechute lorsque la réintroduction de la première ligne de traitement n’est pas appropriée, HYCAMTIN® n’apporte pas d’amélioration du service médical rendu (niveau V) dans la prise en charge actuelle.)
[c] Avis de la commission de la transparence – HAS – 18/03/2008 – HYCAMTIN® - Inscription sécurité sociale et collectivités dans l’indication «les gélules d’Hycamtin sont indiquées en monothérapie pour le traitement des patients adultes atteints d’un cancer du poumon à petites cellules (CPPC) en rechute, chez lesquels la réintroduction de la première ligne de traitement n’est pas appropriée » : http://www.has-sante.fr/portail/jcms/c_697292/hycamtin-ct-5514 (Hycamtin gélule apporte une ASMR mineure (niveau IV) par rapport au traitement palliatif seul)
[d] Avis de la commission de la transparence – HAS – 09/05/2007 – HYCAMTIN® - Inscription Collectivités dans l’extension d’indication « Topotécan en association au cisplatine est indiqué chez les patientes présentant un carcinome du col de l’utérus en rechute après radiothérapie ou chez les patientes présentant un stade IV-B de la maladie » : http://www.has-sante.fr/portail/jcms/c_538693/hycamtin-ct-4386 (HYCAMTIN® associé au cisplatine apporte une ASMR mineure (niveau IV) en termes d’efficacité par rapport au cisplatine seul dans le cadre du traitement des patientes présentant un carcinome du col de l’utérus en rechute après radiothérapie ou en stade métastatique (stade IV-B).)
YERVOY® / Ipilimumab
[e] Avis de la commission de la transparence – HAS – 14/12/2011 – YERVOY® - Inscription Collectivités dans l’indication «« YERVOY® est indiqué dans le traitement du mélanome avancé (non résécable ou métastatique) chez les patient adultes ayant déjà reçu un traitement » : http://www.has-sante.fr/portail/jcms/c_1190009/yervoy-14122011-avis-ct-11462(En l’absence d’alternative validée par une AMM [le vérumafenib, en ATU de cohorte depuis mai 2011, a été approuvé par la FDA en octobre 2011 et a obtenu l’avis positif du CHMP le 15 décembre 2011] , l’ipilimumab (YERVOY®) apporte une amélioration du service médical rendu mineure (ASMR IV) dans la stratégie thérapeutique)
HALAVEN® / Eribuline
[f] Avis de la commission de la transparence – HAS – 20/07/2011 – HALAVEN® - Inscription Collectivités dans l’indication « HALAVEN® est indiqué en monothérapie dans le traitement des patients atteints d’un cancer du sein localement avancé ou métastatique, dont la maladie a progressé après au moins deux protocoles de chimiothérapie pour le traitement du stade avancé (voir rubrique 5.1 du RCP). Le traitement antérieur doit avoir comporté une anthracycline et un taxane sauf chez les patients ne pouvant pas recevoir ces traitements. » : http://www.has-sante.fr/portail/jcms/c_1099359/halaven-ct10752 (HALAVEN® apporte une amélioration du service médical rendu mineure (niveau IV) dans la prise en charge des patientes atteintes d’un cancer du sein au stade métastatique ou localement avancé et dont la maladie a progressé après un traitement antérieur ayant comporté une anthracycline et un taxane sauf chez les patients ne pouvant pas recevoir ces traitements)
ARZERRA® / Ofatumumab
[g] Avis de la commission de la transparence – HAS – 06/10/2010 – ARZERRA® - Inscription Collectivités dans l’indication « Arzerra® est indiqué dans le traitement de la leucémie lymphoïde chronique (LLC) chez les patients réfractaires à la fludarabine et à l’alemtuzumab. » : http://www.has-sante.fr/portail/jcms/c_994402/arzerra-ct-8366 (Au vu des données cliniques limitées reposant sur : - des résultats d’efficacité issus d’un sous-groupe (n=59) d’une étude de phase II non comparative, - une comparaison historique avec les résultats d’une enquête rétrospective, il n’est pas possible de juger de l’apport thérapeutique de ce médicament. En conséquence, la Commission de la transparence considère que la spécialité ARZERRA® n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la prise en charge de la leucémie lymphoïde chronique chez les patients réfractaires à la fludarabine et à l’alemtuzumab à titre provisoire, dans l’attente de données complémentaires).
ZAVEDOS® / Idarubicine
[h] Avis de la commission de la transparence – HAS – 06/10/2010 – ARZERRA® - Inscription Collectivités (sortie de la réserve hospitalière) dans l’indication « Leucémie aiguë myéloblastique, non hyperleucocytaire, identifiable dans la classification FAB, LAM3 exceptée, chez le sujet âgé de plus de 60 ans, dans les circonstances suivantes : - chimiothérapie par voie intraveineuse et/ou hospitalisation prolongée contre-indiquées, - risques liés à une aplasie prolongée estimés supérieurs aux bénéfices potentiels. » : http://www.has-sante.fr/portail/jcms/c_248103/zavedos-ct-1866 (ZAVEDOS apporte une amélioration du service médical rendu modérée (niveau III) dans la prise en charge thérapeutique de la LAM du sujet de plus de 60 ans ne pouvant recevoir une chimiothérapie intensive).
TAXOTERE® / Docétaxel
[i] Avis de la commission de la transparence – HAS – 21/07/2004 – TAXOTÈRE® - Extension dans 2 indications « TAXOTÈRE (docétaxel) en association à la capécitabine est indiqué dans le traitement du cancer du sein localement avancé ou métastatique après échec d’une chimiothérapie cytotoxique, ayant comporté une anthracycline. » et « TAXOTÈRE (docétaxel) en association au cisplatine, est indiqué dans le traitement du cancer bronchique non à petites cellules non résécable, localement avancé ou métastatique, chez les patients n’ayant pas reçu de chimiothérapie antérieure dans cette indication » : http://www.has-sante.fr/portail/jcms/c_245190/avismedicamentct031612pdf (amélioration mineure dans le cancer du poumon localement avancé métastatique associé au cisplatine par rapport à l’association cisplatine et vinorelbine – survie globale médiane augmentée d’un mois, 11,3 versus 10,1 mois ; les nouvelles données ne sont pas de nature à modifier l’amélioration importante déjà accordée dans le cancer du sein – augmentation de 90 jours de la survie médiane avec l’association docétaxel + capécitabine par rapport à une monothérapie de docétaxel)
[j] Avis de la commission de la transparence – HAS – 09/01/2002 – TAXOTÈRE® - Extension dans « En association à la doxorubicine, dans le cancer du sein localement avancé ou métastatique chez les patientes n’ayant pas reçu de chimiothérapie cytotoxique antérieure dans cette affection » : http://www.has-sante.fr/portail/jcms/c_243105/avismedicamentct020899pdf (Pas d’ASMR accordée en 1ère intention par manque de données de comparaison avec les autres protocoles de chimiothérapie possible à base d’anthracycline ; amélioration importante confirmée en 2ème intention – mais pas de progrès par rapport au TAXOL (paclitaxel) en terme de tolérance)
[k] Avis de la commission de la transparence – HAS – 15/02/2006 – TAXOTÈRE® - Extension dans 2 indications « TAXOTÈRE (docétaxel) en association à la doxorubicine et au cyclophosphamide est indiqué dans le traitement adjuvant du cancer du sein opérable, chez des patients présentant un envahissement ganglionnaire. » et« TAXOTÈRE (docétaxel) en association au trastuzumab est indiqué dans le traitement du cancer du sein métastatique avec sur-expression tumorale de HER2, chez les patients non prétraités par chimiothérapie. » : http://www.has-sante.fr/portail/jcms/c_247923/taxotere-ct-1808 (en adjuvant dans le cancer du sein, amélioration importante – Le taux de survie globale estimé à 5 ans est de 87% pour TAXOTÈRE associé à la doxorubicine et au cyclophosphamide versus 81% pour l’association doxorubicine, cyclophosphamide et fluorouracile ; Confirmation de l’amélioration importante accordée précédemment le 20/07/2005 à l’association TAXOTÈRE et HERCEPTIN sur le TAXOTÈRE seul (cf. plus haut))
[l] Avis de la commission de la transparence – HAS – 06/07/2005 – TAXOTÈRE® - Extension d’indication « TAXOTÈRE (docétaxel) en association à la prednisone ou à la prednisolone est indiqué dans le traitement du cancer de la prostate métastatique hormono-résistant. » : http://www.has-sante.fr/portail/jcms/c_246105/avismedicamentct031922pdf (amélioration modérée - médiane de survie prolongée de 2 mois : 18,9 versus 16,5 mois, diminution plus fréquente de la douleur et du taux de PSA)
[m] Avis de la commission de la transparence – HAS – 29/11/2006 – TAXOTÈRE® - Extension d’indication « TAXOTÈRE en association avec le cisplatine et le 5 fluoro-uracile, est indiqué dans le traitement de l’adénocarcinome gastrique métastatique, y compris l’adénocarcinome de la jonction œsogastrique, chez des patients non prétraités par chimiothérapie pour leur maladie métastatique » : http://www.has-sante.fr/portail/jcms/c_588643/taxotere-ct-3197 (amélioration mineure par rapport à l’association cisplatine 5-fluorouracile seule – Prolongement de la médiane de survie de 19 jours : 9,2 mois vers 8,6 mois)
[n] Avis de la commission de la transparence – HAS – 18/04/2007– TAXOTÈRE® - Extension d’indication «« TAXOTÈRE (docétaxel) en association au cisplatine et au 5-fluorouracile est indiqué dans le traitement d’induction des carcinomes épidermoïdes, localement avancés et inopérables, des voies aéro-digestives supérieures. » : http://www.has-sante.fr/portail/jcms/c_523438/ct-4136 (amélioration modérée par rapport à l’association cisplatine 5-fluorouraclie seule – Médiane de survie augmentée de 4 mois : 18,6 versus 14,5 mois)
[o] Avis de la commission de la transparence – HAS – 19/03/2008– TAXOTÈRE® - Extension d’indication « TAXOTÈRE (docétaxel) en association au cisplatine et au 5-fluorouracile est indiqué dans le traitement d’induction des carcinomes épidermoïdes localement avancés des voies aéro-digestives supérieures. » : http://www.has-sante.fr/portail/jcms/c_657756/taxotere-ct-5360 (amélioration importante par rapport à l’association cisplatine et 5-fluorouracile seule - gain de survie globale de 40,5 mois : 70,6 mois versus 30,1 mois)
CAMPTO® / Irinotécan
[p] Pas d’avis de la commission de la transparence pour CAMPTO® - La première étude mentionnée au RCP de l’AMM en association au 5-fluorouracile et à l’acide folinique en 1ère ligne dans le cancer colorectal métastatique avec survie globale augmentée de 2,8 mois : 16,8 mois versus 14,0 mois par rapport à l’association 5-FU AF seule ; D’où le protocole« FOLFIRI » (pour acide folinique – 5-fluorouracile et irinotécan) standard dans le traitement du cancer colorectal métastatique…
LEVACT® / Bendamustine
[q] Avis de la commission de la transparence – HAS – 06/10/2010 – LEVACT® - Inscription Collectivités dans les indications « - Traitement de première ligne de la leucémie lymphoïde chronique (stade Binet B ou C) des patients chez qui une polychimiothérapie comportant de la fludarabine n’est pas appropriée. - Traitement en monothérapie du lymphome non hodgkinien indolent en progression, pendant ou dans les 6 mois, chez des patients ayant reçu un traitement par rituximab seul ou en association. - Traitement de première ligne du myélome multiple (stade II en progression ou stade III de la classification de Durie et Salmon) en association avec la prednisone chez des patients de plus de 65 ans qui ne sont pas éligibles pour la greffe autologue de cellules souches et qui présentent une neuropathie au moment du diagnostic excluant l’utilisation de traitement comportant du thalidomide ou du bortezomib.» : http://www.has-sante.fr/portail/jcms/c_994379/levact-ct-8297 (A. Leucémie lymphoïde chronique LEVACT apporte une amélioration du service médical rendu modérée (ASMR III) par rapport au chlorambucil en termes d’efficacité dans le traitement des patients ayant une leucémie lymphoïde chronique lorsqu’une polychimiothérapie comportant de la fludarabine n’est pas appropriée. B. Lymphome non hodgkinien En dépit des limites méthodologiques des études non comparatives, mais considérant l’effet et la tolérance observés par rapport à la prise en charge actuelle, la Commission de la Transparence attribue à LEVACT une amélioration du service médical rendu modérée (ASMR III) dans la stratégie thérapeutique du lymphome non hodgkinien indolent en progression après un traitement par rituximab. C. Myélome multiple Compte tenu de la faible qualité de la démonstration (étude arrêtée prématurément, choix non pertinent du critère principal et absence de comparaison directe aux traitements de référence), la Commission considère que LEVACT en association avec la prednisone n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la prise en charge thérapeutique habituelle du myélome multiple en première ligne. Néanmoins, du fait de son absence de neurotoxicité, la Commission considère que cette spécialité représente un moyen thérapeutique supplémentaire utile chez des patients de plus de 65 ans qui ne sont pas éligibles à une greffe autologue et à un traitement comportant du thalidomide ou du bortezomib.)
YONDELIS® / Trabectédine
[r] Avis de la commission de la transparence – HAS – 16/06/2010 – YONDELIS® - Extension d’indication « en association à la doxorubicine liposomale pégylée (DLP) en traitement du cancer des ovaires récidivant sensible au platine » : http://www.has-sante.fr/portail/jcms/c_966510/yondelis-ct-7917 (Compte tenu des résultats issus d’une analyse de sous groupe ayant montré un gain absolu de 2 mois de survie sans progression en faveur de l’association YONDELIS + doxorubicine liposomale pégylée versus doxorubicine liposomale pégylée seule, sans amélioration de survie globale et au prix d’une augmentation de la toxicité hématologique et hépatique, la commission considère que cette association n’apporte pas d’amélioration du service médical rendu (niveau V) dans la stratégie thérapeutique. YONDELIS + doxorubicine liposomale pégylée constitue un moyen thérapeutique supplémentaire utile dans la prise en charge du cancer des ovaires récidivant sensible au platine)
[s] Avis de la commission de la transparence – HAS – 02/04/2008 – YONDELIS® - Inscription Collectivités dans l’indication « Yondelis est indiqué chez les patients atteints de sarcome des tissus mous évolué, après échec de traitements à base d’anthracyclines ou d’ifosfamide, ou chez les patients ne pouvant pas recevoir ces médicaments. Les données d’efficacité ont principalement été obtenues chez des patients atteints de liposarcome et de léiomyosarcome. » : http://www.has-sante.fr/portail/jcms/c_657281/yondelis-ct-5252 (En l’absence de donnée d’étude versus « soins de support » ou de comparaison formalisée avec une cohorte historique, il n’est pas possible de juger de l’apport thérapeutique de ce médicament. En conséquence, la Commission de la Transparence considère qu’en l’état actuel des connaissances, la spécialité Yondelis n’apporte pas d’amélioration du service médical rendu (niveau V) dans la prise en charge des patients atteints d’un liposarcome ou d’un léiomyosarcome, en échec à un traitement à base d’anthracyclines ou d’ifosfamide)
06/07/2012 - Pourquoi les dépenses de médicaments ne baissent-elles pas en France malgré la crise, les génériques et la panne d’innovation pharmaceutique ?
Nous pourrions rajouter aussi, malgré les déremboursements, les retraits de marché et les baisses de prix…
Jetons un œil tout d’abord sur les dernières statistiques publiées par l’OCDE le 28 juin 2012.
En premier lieu, observons que l’ensemble des pays de l’OCDE est en « stagflation1 » en 2010 sur la dépense totale de santé
Cliquer sur l’image pour ouvrir le diaporama
Les dépenses pharmaceutiques ont cru de +0.5% en France en 2010, alors qu’au même moment, elles chutaient de -4.4% sur l’ensemble des pays de l’OCDE (avec, il est vrai de fortes disparités). Soit un différentiel de 5% !
Cliquer sur l’image pour ouvrir le diaporama
(Nos remerciements à Mme Valérie PARIS, OCDE, pour nous avoir communiqué les données détaillées de dépenses pharmaceutiques, par ailleurs accessibles sur la base de données de l’OCDE : Cliquer sur « Données par thèmes », puis sur « Santé », puis sur « Dépenses de santé et financement »)
Dans ce contexte, il était bien difficile pour la Cour des Comptes de ne pas donner un (petit) tour de vis en début de semaine, même si Didier MIGAUD, son Premier Président appartient à la famille politique qui vient d’accéder à tous les pouvoirs dans notre pays :
« Le rééquilibrage des comptes de la sécurité social est prioritaire ». C’est en ces termes graves que la Cour concluait son communiqué de presse du lundi 2 juillet 2012, accompagnant la livraison de son rapport « La situation et les perspectives des finances publiques en 2012 » que lui avait commandé le nouveau gouvernement.
La Cour prévoit une progression de l’Ondam limitée à 2,5% pour 2012, à condition de freiner l’évolution tendancielle des dépenses, laquelle a été estimée à 4% par le Haut Conseil pour l’Avenir de l’Assurance Maladie, et de renforcer la vigilance sur les établissements hospitaliers très endettés par les programmes d’investissement récents (26,5 milliards d’euros). Source = synthèse du rapport.
Ce jeudi 5 juillet, pour clore au moins provisoirement le débat, la Ministère en charge de la Santé « coupe la poire en deux » et annonce la décision du gouvernement de fixer en définitive l’ONDAM pour 2013 à 2,7% (4,6 milliards d’euros de dépenses supplémentaires, tout de même), arguant de son « engagement fort en faveur d’une politique de santé publique faisant de l’accès aux soins pour tous, et de l’innovation, ses priorités »…
Dont acte, mais s’agissant de « l’innovation », il faudra bien en vérifier la réalité… (Cf. infra pour les médicaments)
Revenons à la question initiale - titre de notre article :
« Pourquoi les dépenses de médicaments ne baissent-elles pas en France »
S’agissant du médicament, nous devons observer :
- Que les pertes de brevets depuis plusieurs années ont été très nombreuses et ont touché quantités de « blockbusters2 » ;
- Qu’au-delà de l’arrivée massive de génériques, les baisses de prix vigoureuses et continuelles, orchestrées par le CEPS3, ont laminé les dépenses à l’intérieur du répertoire4.
- Que l’innovation pharmaceutique est en panne : peu d’entités nouvelles, absence d’amélioration du service médical rendu (ASMR) pour la plupart des nouvelles présentations de médicaments mises sur le marché
- Que de nombreux médicaments ont été déremboursés, d’autres purement et simplement retirés du marché,
- Que les franchises médicales5 et plus généralement les restes à charge qui retardent ou bloquent l’accès aux soins des plus démunis dans un contexte de crise économique, ont également réduit la dépense sociabilisée…
Et qu’au total, à bien y réfléchir, et compte-tenu de contexte, on s’attendrait plutôt à constater une chute brutale des dépenses de médicaments. Or, tel n’est pas le cas.
Alors, comment répondre à cette question lancinante ?
Bien entendu, il n’y a pas de réponse unique. Mais, quand même, globalement :
Ne serait-ce pas à cause d'une trop grande proximité entre nos politiques et le lobby pharmaceutique, que la croissance du gâteau industriel serait assurée, ainsi que les retombées collatérales pour les heureux bénéficiaires des largesses de « Big Pharma » ?
Nos politiques (au sens large de ceux qui construisent ou prennent les décisions) ont toujours priorisé les intérêts du complexe « médico-industriel » à ceux des patients et des assurés. De sorte qu’ils favorisent la santé financière des firmes pharmaceutiques, au détriment de la pertinence et de l’efficience des soins médicamenteux prodigués aux françaises et français. Ce qui de surcroît, obère le pouvoir d’achat de nos concitoyens…
Sept belles illustrations, comme les jours de la semaine, nous sont apportées par une actualité particulièrement fournie :
1. Trois milliards de dollars, amende record pour les laboratoires GSK
Accusés d’avoir promu 10 médicaments dans des indications non approuvées, les laboratoires GSK ont obtenu le plus gros règlement à l’amiable de l’histoire pour un industriel de la santé en déboursant la coquette somme de 3 milliards de dollars. Ces dépenses avaient été largement provisionnées par la firme…

Photo Le Monde®
2. L’académie de médecine brouille à nouveau les cartes sur les génériques
Très hypocritement, dans un communiqué de presse datant du 30 juin et abondamment repris dans la presse de cette semaine, soit 4 mois après avoir rendu public son sulfureux rapport sur « La place des génériques dans la prescription

3. Le Président de la HAS voudrait-il « torpiller » l’évaluation comparative des médicaments en France, qu’il ne s’y prendrait pas autrement
Le Pr HARROUSSEAU a annoncé le 26 juin 2012 devant un parterre de cadres de l’industrie pharmaceutique conquis d’avance, que la HAS allait substituer au SMR et à l’ASMR, deux indicateurs décernés aux nouveaux médicaments par la commission de la transparence, un nouvel indicateur unique, dénommé « ITR », pour « Index thérapeutique relatif ». La vidéo n’était malheureusement pas encore en ligne sur le site de l’ACIP (association des cadres de l’industrie pharmaceutique) au moment d’écrire cet article6. Néanmoins, l’intervention est reprise dans la presse spécialisée (Par exemple dans Impact Santé Pharmacien du 3 juillet, en accès probablement limité aux abonnés).
En fait, le Pr. HARROUSSEAU jugerait le système actuel (SMR et ASMR) « un peu compliqué » et considère l’ITR « plus simple, lisible et reproductible ». Selon lui, la HAS aurait initié ce travail avec plusieurs pays européens. De plus, cet index ferait l’objet d’une concertation avec la direction de la sécurité sociale (DSS) et les industriels du médicament (LEEM)…

Le Pr. J-L HARROUSSEAU, Président de la HAS
En creusant un peu, nous tombons sur « EUnetHTA », pour « European network for Health Technology Assessment », le réseau européen pour l’évaluation des technologies en santé. Nous y retrouvons dans la liste des membres de ce réseau, d’autres institutions réputées comme l’IQVIG allemand et le NICE anglais. Un premier document de travail datant de juillet 2011 est téléchargeable : ici, et nous apprenons qu’un consultation publique est organisée entre les 29 juin et le 10 septembre 2012, sur un projet de guide méthodologique portant sur l’évaluation de l’efficacité relative des médicaments : là. Un premier lot de 5 documents mis en consultation comprend :
- Un projet de guide relatif au choix des comparateurs les plus appropriés,
- Un projet de guide relatif aux critères composites d’efficacité,
- Un projet de guide relatif aux critères intermédiaires de jugement,
- Un projet de guide relatif à la validité des niveaux de preuves,
- Un formulaire de réponse à la consultation publique.
Un deuxième lot de document serait mis en consultation publique du 27 août au 30 octobre 2012. Il devrait contenir les projets de guides de recommandations suivants :
- Critères cliniques de jugement (Personnellement, ce sont ceux qui m’intéressent le plus !),
- Qualité de vie liée à la santé (A prendre en compte aussi, bien entendu : A quoi cela peut-il bien servir de gagner quelques semaines de survie pour un malade atteint d’un cancer terminal, si c’est pour souffrir davantage d’effet secondaires graves ?),
- Critères de tolérance (même remarque),
- « Validité interne » (?)
- Comparaisons directes et indirectes.
Les commentaires et remarques sont effectivement à adresser à deux employées de la HAS
Les recommandations définitives seraient publiées sur le site EUnetHTA en fin d’année.
Alors, excusez-moi, mais voilà un « enfumage » caractérisé. Cela vous parait-il plus simple ?
Je comprends mieux les réticences à peine voilées du Pr. Gilles BOUVENOT, Président de la commission de la transparence (CT) lors d’un récent colloque et dont les propos furent rapportés dans la presse : « Je plaide pour que la CT puisse faire entendre sa voix et dire, sans qu’on le lui impose, quel est le meilleur comparateur » (Source : Impact Santé Pharmacien du 7 juin 2012).

Le Pr. G. BOUVENOT, Président de la CT
En d’autres termes, il faut sauver le soldat BOUVENOT et sa commission de l’évaluation comparative des médicaments, probablement l’instance la plus indépendante à statuer courageusement sur les spécialités pharmaceutiques, parfois contre vents et marées, et qui fait un travail remarquable le plus souvent.
Contrairement à ce qu’affirme le Président de la HAS, les avis de la commission et ses ASMR ne sont ni compliqués, ni peu lisibles. Il suffit de compter jusqu’à cinq :
ASMR I : Progrès thérapeutique majeur
ASMR II : Progrès important
ASMR III : Progrès modeste
ASMR IV : Progrès mineur
ASMR V : Progrès nul
Non, leur seul défaut c’est la méconnaissance qu’en ont les médecins en ville comme à l’hôpital, faute d’une diffusion digne de ce nom. En effet, ils ne figurent pas dans le dictionnaire VIDAL papier. Pour les consulter dans les bases de données médicamenteuses, il est nécessaire de cliquer sur un lien. Les visiteurs médicaux n’en parlent jamais spontanément et ils ne sont pas non plus exploités par les logiciels d’aide à la prescription.
Si l’ASMR venait à disparaître, alors je proposerais de rebaptiser la commission de la transparence, en commission de la « tolérance » (s’entend pour le caractère faussement innovant de la majorité des nouvelles spécialités pharmaceutiques, ou de leurs nouvelles indications).
4. Le LIR (Laboratoires internationaux de recherche) et la chaire santé d’Essec Business School tentent de redorer le blason des labos, en (auto)proclamant que les français seraient rentrés dans le rang en matière de consommation de médicaments
L’Association des firmes pharmaceutiques étrangères bien implantées sur notre territoire, en partenariat avec la grande école de commerce, publie une étude européenne comparant la consommation médicamenteuse à l’intérieur de huit classes parmi les plus fréquemment prescrites (antibiotiques, anxiolytiques, antidépresseurs, anti-ulcéreux, hypolipémiants, anti-hypertenseurs, anti-diabétiques et antiasthmatiques). A noter que suite à une erreur (signalée) de lien hypertexte, la synthèse de l’étude est téléchargeable, mais pas le rapport complet…
Au demeurant, cette étude a parfaitement été relayée dans la presse grand public, et surtout le communiqué de presse du LIR qui voudrait nous faire croire que « La politique du juste usage du médicament soutenue par les Laboratoires Internationaux de Recherche porte ses fruits : la France s’est normalisée en matière de consommation de médicaments ». Bref, un très joli coup médiatique (Notamment dans les journaux grands publics Ouest France et Le Monde)
Déjà, relevons dans le texte de la synthèse de l’étude qui ne semble pas avoir été relue avec toute l’attention qu’elle aurait mérité, une sacrée « bourde ». En effet comment est-il possible d’affirmer « Une nette régression dans cinq classes sur huit » au vu du tableau ci-dessous ?
Cliquer sur l’image pour télécharger la synthèse de l'étude LIR/ESSEC
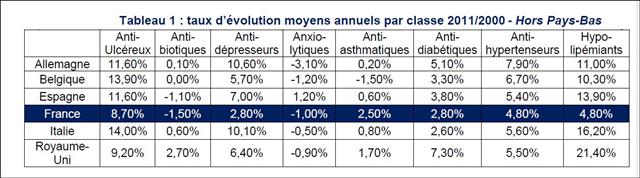
Cela est totalement mensonger ! Il n’y a que deux classes qui régressent avec des taux d’évolution négatifs. Si nous avions à faire, non pas à une étude dont le but inavoué est d’alimenter la propagande des firmes sur leur éthique retrouvée afin de redresser leur image ternie par les affaires, mais d’une publicité sur un médicament, ils auraient immanquablement été sanctionnés par la « Commission du contrôle de la publicité et de la diffusion de recommandations sur le bon usage des médicaments ».
Ensuite, la consommation est évaluée dans cette étude à partir de la notion de DDD (Daily Defined Dose), c'est-à-dire en « doses définies journalières ». Un concept développé par l’OMS de manière à comparer les volumes sur la base des posologies les plus usitées et non pas des conditionnements de ventes qui peuvent être très variables d’un pays à l’autre, ce qui fausserait les comparaisons.
Ce concept a néanmoins ses propres limites. Dans le cas des hypolipémiants, estimer les volumes de prescription à partir de la DDD peut conduire à des contre-vérités. Par exemple, la DDD de la pravastatine (ELISOR® ou VASTEN®) est de 30 mg. Entre le comprimé à 20 mg et celui à 40 mg. Cela a du sens pour les populations anglo-saxones ou nordiques dont le risque cardio-vasculaire est très élevé et chez lesquelles les études ont été réalisées essentiellement à la dose de 40 mg. Mais, pour la population française, qui partage avec la Corée et le Japon la première place au mode du risque cardiovasculaire le plus bas, l'étude MEGA (Lancet, sept 2006) valide la posologie à 10 mg par jour de pravastatine en prévention primaire…
Ce que tend à montrer cette étude, et nous ne devons pas nous en réjouir, c’est que les autres pays européens nous ont en partie rejoint dans la « surprescription ». Ce qui n’est pas mesuré dans ce travail, et qui reste incontestable, c’est la propension des médecins français à prescrire plus vite et plus massivement qu’ailleurs la dernière molécule à peine arrivée sur le marché. Une molécule à coup sur moins bien évaluée tant sur son efficacité clinique que sur ses effets secondaires et toujours plus coûteuse…
5. La FHF, en collaboration avec l’institut de sondage TNS, oublie d’inclure dans son questionnaire aux médecins les principaux motifs de non pertinence des actes
La Fédération Hospitalière de France, qui défend les intérêts des hôpitaux publics, a commandé une enquête auprès de TNS sur un sujet qui lui est cher, au sens propre comme au figuré, la pertinence des actes. Comme ce n’est pas précisé dans le document publié, nous avons supposé que les prescriptions médicamenteuses étaient incluses dans le périmètre de ce sondage effectué auprès de 800 médecins hospitaliers et libéraux (spécialistes et généralistes).
Si les médecins font des actes non pertinents, figurez-vous que ce n’est pas de leur faute. Ce sont les patients qui sont demandeurs… Nous aurions presque pu prendre pour argent comptant ce principal enseignement de l’enquête si nous n’avions pas regardé d’un peu plus près les autres réponses proposées
Cliquer sur l’image pour télécharger les résultats de l’enquête FHF/TNS
Manifestement, un biais dans l’étude surgit comme le nez au milieu de la figure.
Il manque tout simplement l’information des médecins, quasiment abandonnée par les pouvoirs publics aux seuls industriels de la santé (Laboratoires pharmaceutiques et industriels du dispositif médical, des équipements médicaux, de l’imagerie, du diagnostic biologique…), et tous les conflits d’intérêts qui lui sont associés.
Surprescriptions, surdiagnostics, surtraitements, surpromesses… riment avec surconsommation. A ne pas manquer dans ce registre, les actes du colloque « Surmédicalisation, surdiagnostics et surtraitement » organisé à la faculté de médecine de Bobigny les 27 et 28 avril derniers, sur le site de la SFTG (Société de Formation à la Thérapeutique du Généraliste) et sur le blog Pharmacritique.
6. La France, pays le plus dépensier d’Europe en anticancéreux onéreux
Dans son rapport « Situation de la chimiothérapie des cancers en 2011 » qu’il vient de livrer le 3 juillet, l’INCa rapporte pour les principaux pays européens quelles étaient les dépenses en 2009 par habitant d’anticancéreux de la liste en sus des GHS (les plus coûteux, remboursés rubis sur l’ongle par l’assurance maladie, en dépit du maigre progrès, lorsqu’il existe, qu’ils apportent pour la plupart…). La France est de loin première. En 2010, en France, ces médicaments ont totalisé plus d’un milliard et demi d’euros pour l’hospitalisation publique (1,060 Md€) et privée (493 M€)…
Cliquer sur l’image pour télécharger le dernier rapport de l’INCa

Notre tableau édifiant de l’an passé qui permettait d'évaluer selon les critères de la commission de la transparence le niveau de progrès thérapeutique des anticancéreux onéreux appartenant à la liste remboursée en sus des GHS dans leurs principales indications, est hélas toujours d’actualité (à retrouver : ici).
Madame la Ministre, si vous nous entendez, il est toujours aussi urgent de faire enfin appliquer les règles d’inscription ou de non inscription, et de radiation de la liste en sus, telles que définies par le Conseil de l’Hospitalisation en octobre 2010, et qui n’ont jamais jusqu’ici été mises en œuvre… (Tout du moins par le ministre précédent) ; Cela pourrait représenter plusieurs centaines de millions d’économie sans perte de chance pour les patients !
(Un sujet à retrouver : ici).
Nota : Le Dr. Aquilino MORELLE, Médecin, Science Po, puis ENArque, avant de devenir la « plume » d’un certain François HOLLANDE pendant sa campagne, puis son Conseiller politique particulier, était inspecteur de l’IGAS (Affaire Médiator®, notamment l’an passé). En tout début d’année, il conduisait justement une enquête sur les médicaments onéreux de la liste en sus. Il est certain qu’il doit bien connaître le sujet…
7. La HAS évalue en 2011 à 98,7% les nouveaux médicaments ou indications apportant un progrès nul ou mineur !
Comme pour corroborer ce qui a été souligné plus haut, à savoir la panne d'innovation thérapeutique, la HAS publiait ce vendredi 6 juillet 2012 son rapport annuel d’activité pour l’année 2011.
Sur 232 spécialités pharmaceutiques présentées pour une nouvelle inscription ou pour une extension d’indication en 2011, la commission de la transparence n’a accordé qu’une seule ASMR de niveau I (progrès majeur), soit 0,4% des dossiers, aucune de niveau II (progrès important) et seulement deux ASMR de niveau III (progrès modeste), soit 0,9% des dossiers expertisés…
Cliquer sur l’image ci-dessous pour télécharger 2 diapos
Pour conclure cette saga hebdomadaire, le nouveau gouvernement serait bien inspiré de rompre avec la spirale continuellement inflationniste des dépenses de médicaments dans notre pays, déconnectée du progrès thérapeutique, en actionnant les leviers suivants :
- Rendre opérante la visite des délégués de l’assurance maladie sur le médicament,
- Valoriser l’évaluation comparative des médicaments dans les bases de données et les logiciels médicaux,
- Inciter les hôpitaux publics et privés à l’efficience de la prescription,
- Appliquer les principes définis par le Conseil de l’hospitalisation pour la gestion de la liste en sus.
Les marges financières mobilisables sont considérables
Bien cordialement
François PESTY
[1] Stagflation : « Situation d'une économie qui souffre simultanément d’une croissance économique faible ou nulle et d'une forte inflation (c’est-à-dire une croissance rapide des prix). Cette situation est souvent accompagnée d'un taux de chômage élevé (Source : Wikipedia)
[2] Blockbuster : À l’image des grandes productions cinématographiques, il s’agit des médicaments que le succès commercial propulse au dessus du milliard de dollar de chiffre d’affaire annuel planétaire…
[3] CEPS : Comité économique des produits de santé ; Il tente de négocier le prix des médicaments avec les firmes. Le CEPS est actuellement présidé par Gilles JOHANNET
[4] Répertoire des génériques : Ensemble des médicaments, noms de marque (appelés encore « princeps ») et copies. Il est tenu à jour par l’AFSSAPS, euh pardon, l’ANSM (on a du mal à s’habituer au nouveau nom de l’agence du médicament). Détail croustillant, comme chacun pourra le noter, la liste en question n’est pas à jour. Elle date du 9 mai. Depuis, les décisions (de son Directeur) des 11 mai, 7 et 27 juin, ont élargi substantiellement le périmètre du répertoire. Comprenez, ce serait trop de travail que de leur demander de l’actualiser à chaque fois…
[5] Contribution de 50 cts d’euros par boite de médicament que les usagers doivent régler de leur poche
[6] La vidéo de l'intervention du Pr Jean-Luc HARROUSSEAU, Président de la HAS, le 26 juin 2012 devant les Amphis de la Santé a été mise en ligne sur le site de l'ESSEC le 17 juillet 2012
29/06/2012 - La nouvelle équipe au pouvoir serait impardonnable si l’essentiel des 92 recommandations du rapport « LEMORTON » ne trouvait enfin sa traduction dans la future Loi de financement de la sécurité sociale pour 2013 !
Réjouissons-nous et ne tarissons pas d’éloges sur Mme Catherine LEMORTON, notre consœur Pharmacien, qui vient d’être élue à la Présidence de la Commission des Affaires Sociales de l’Assemblée Nationale.
Un poste clef pour faire adopter de nouveaux textes législatifs, puisque c’est au sein de cette commission que seront désignés les rapporteurs des prochains PLFSS (Projet de Loi de Financement de la Sécurité Sociale).
Lors de la dernière discussion à l’automne 2011 de la LFSS 2012, souvenons-nous que de par les institutions, la nouvelle majorité PS au Sénat n’avait rien pu faire face aux députés majoritairement UMP de la commission mixte paritaire (En cas de désaccord entre les deux chambres, c’est toujours l’Assemblée nationale qui a le dernier mot).
Auparavant, avait également eu lieu d’âpres échanges au sein des 3 missions parlementaires « post MEDIATOR® » (deux à l’Assemblée Nationale, et une au Sénat), et également lors de la discussion de la Loi BERTRAND (Loi du 29 décembre 2011 relative au renforcement de la sécurité sanitaire du médicament et des produits de santé).
[Voir notamment les discussions instructives lors de l'examen par la Commission des Affaires Sociales de l'Assemblée Nationale du rapport de la Mission Jean-Pierre DOOR : Cliquer ici, puis choisir la vidéo du 22 juin 2011 (commission des affaires sociales), puis cliquer dans le déroulé à droite sur « Mme Catherine LEMORTON, puis sur M. Jean-Louis TOURAINE, Pr de Médecine et député réélu en 2012, dont les propos sont également très intéressé et qui parle des délégués de l'assurance maladie (DAM)…]
Un coup d’œil rapide aux archives de l’Assemblée Nationale1, nous enseigne que si la Présidence de la commission des affaires sociales de la Vème République a souvent été tenues par des médecins, il faut remonter à près d’un demi-siècle pour trouver un autre Pharmacien :
- Pr Jean-Michel DUBERNARD, Droite, Chirurgien, de juin 2002 à juin 2007 ;
- Dr Henry BERGER, Droite, Médecin, d’octobre 1972 à mai 1981 (sur 3 législatures) ;
- Dr Jean LEGALL, Droite, Médecin, d’avril 1965 à avril 1967 ;
- Dr Paul GUILLON, Droite, Médecin, de novembre 1962 à février 1965 (décès en fonction) ;
- Marius DURBET, Droite, Pharmacien, d’octobre 1959 à avril 1967 (sur 2 législatures) ;
A noter que Claude BARTOLONE, le nouveau Président de l’Assemblée Nationale, a aussi été Président de la Commission des Affaires sociales, de juin 1997 à avril 1998, et qu’il est ancien Cadre de l’industrie pharmaceutique.
Alors pourquoi, cette élection doit-elle être considérée comme une bénédiction pour la maîtrise médicalisée des dépenses de médicaments ?
Tout simplement, par ce que Mme LEMORTON a été rapporteure pour la MECSS2 de l’excellentissime rapport d’information sur « La prescription, la consommation et la fiscalité des médicaments ».
Cliquer sur l'image pour télécharger le rapport "LEMORTON"

Nous nous sommes fait en son temps largement l’écho de ce travail brillant, qui faisait siennes de nombreuses propositions de bon sens émanant de l’IGAS et de la Cour des Comptes, et formalisait 92 préconisations (Lire ici). Le rapport fut adopté à l’unanimité, précisément par la Commission des Affaires Sociales de l’Assemblée Nationale, le 30 avril 2008. Le Vice-président de la MECSS de l’époque, le Dr Pierre MORANGE, médecin, UMP (réélu en 2012), avait conclu à l’époque en affirmant « haut et fort » que :
« La MECSS aura à cœur, dans le cadre de la discussion du projet de loi de financement de la sécurité sociale pour 2009, de veiller à la traduction, par voie législative ou réglementaire, de ses préconisations afin que celles-ci soient appliquées effectivement dans le système de soins »
Prenons pêle-mêle quelques-unes des mesures phares :
- Doter la HAS de la capacité de diffuser de l’information sur les médicaments aux médecins en face à face : création d’un corps de « délégués de santé », spécialement formés et certifiés par la HAS, notamment pour promouvoir le bon usage des médicaments ; ce corps, constitué à partir des délégués de l’assurance maladie, serait copiloté par la HAS et la CNAMTS et géré administrativement par la CNAMTS
- Contrôler, évaluer et encadrer la prescription hors AMM,
- Amplifier les efforts de maîtrise médicalisée et les étendre à de nouvelles classes de médicaments,
- Développer, en coordination entre la HAS et l’assurance maladie, les outils permettant aux médecins d’évaluer leur pratique ainsi que les communications personnalisées de l’assurance maladie sous la forme de courriers, de contacts téléphoniques ou d’entretiens confraternels,
- Rendre obligatoire les essais cliniques contre comparateurs avant l’appréciation de l’amélioration du service médical rendu (ASMR) par la Commission de la transparence,
- Établir un classement des médicaments par niveau d’ASMR,
- Demander à la HAS d’étudier les moyens de réduire la surprescription, développer le bon usage et les alternatives à la prescription médicamenteuse,
- Demander à la HAS d’évaluer l’impact de ses recommandations et de mettre en place des indicateurs et tableaux de bord pour mesurer l’évolution des comportements de prescription,
- Mettre en place, dans le meilleur délai, une base publique, exhaustive et gratuite d’information sur les médicaments,
- Achever la mise en place des dispositifs de formation médicale continue (FMC) et d’évaluation des pratiques professionnelles (EPP),
- Renforcer les capacités de la HAS en matière d’analyse et d’évaluation des stratégies promotionnelles de l’industrie pharmaceutique et des prescriptions : création d’un observatoire de la prescription adossé à un réseau de médecins,
- Rendre obligatoire la certification d’aide à la prescription (LAP), mettre en oeuvre rapidement la procédure de certification des logiciels en médecine de ville afin que tous les logiciels proposés sur le marché soient certifiés à la fin de l’année 2009,
- Étudier la possibilité d’adjoindre aux LAP une fonction d’aide à la décision thérapeutique.
Même si en relisant ces préconisations, nous pouvons regretter qu’elles aient été libellées dans des termes par trop généraux et n’aient pas été suffisamment concrètes, il n’en demeure pas moins qu’elles ouvrent le champ à de multiples actions totalement réalisables et à fort impact tant sur la qualité des soins que sur l’efficience des dépenses associées.
Mais, quelle ne fut pas notre énorme désillusion, lorsque nous avons assisté à la « mise au placard » pure et simple par le gouvernement FILLON et la majorité parlementaire de ces mesures préconisées lors de la discussion de la LFSS 2009… (Lire « Mais où sont donc passées les 92 propositions de la MECCS sur le médicament », ici sur l’information des médecins sur le médicament, et là sur les logiciels d’aide à la prescription et les bases de données médicamenteuses)
Alors, où en sommes nous rendus aujourd’hui ?
Il est bien évident que la poursuite par l’ancienne équipe au pouvoir de sa stratégie de neutralisation de tout ce qui aurait pu nuire aux intérêts des firmes pharmaceutiques, à conduit à dégrader encore plus la situation.
Le constat fait récemment par la Mutualité Française sur l’échec de la politique des médicaments génériques, à l’occasion de la sortie annuelle de son « mémento médicaments » (voir également ses commentaires détaillés), est très éclairant à ce sujet :
La part des économies potentielles a cru plus rapidement que celle des économies réalisées
Le graphique ci-dessous propose une projection à 5 ans si rien n’est fait.
Il témoigne du succès de l’industrie pharmaceutique à mettre en échec les génériques, en détournant la prescription des anciennes molécules vers de fausses innovations (plus coûteuses)...
Cliquer sur l’image pour agrandir le graphique
En clair, nous avons la preuve indirecte du caractère toujours inopérant en 2011 de la visite des délégués de l’assurance maladie (DAM) sur le médicament.
Mais comment pouvait-il en être autrement. Je renvoie les internautes à nos réflexions pendant les assises du médicament :
Notons, le détail est croustillant, que la Mutualité a du acheter les services de la société IMS Health pour obtenir les données 2011. Même elle, n’a pas accès aux données détaillées de la Cnamts…
Bien difficile en fait d’évaluer quelle est la performance réelle des DAM (cela mériterait assurément une mission d’information parlementaire ou de l’IGAS), puisque la Caisse Nationale distille ses données avec un retard de plus en plus considérable. En mai (2012), les données MEDIC’AM 2010 ont été mises en ligne en catimini et sans le moindre commentaire (Le dernier dossier de presse date du 20 septembre 2010, et avait été suivi d’une dernière analyse « fouillée » publiée par la Cnamts en décembre 20103, 4 et portait sur les données à fin 2009…). Le fichier Excel est téléchargeable ici. A croire qu’elle redoute terriblement que des analystes zélés et récidivistes n’éclairent une fois de plus l’opinion sur le rideau de fumée que constitue le dispositif actuel…
[Pour mémoire : MEDIC’AM 2001-2009 (Analyse des données de remboursement par le régime général) : Les antibiotiques ; Les antiulcéreux et antiacides ; Antihypertenseurs : IEC, sartan et autre inhibiteur de la rénine ; Statines et hypolipémiants ; MEDIC’AM 2001-2008 : Antiagrégants plaquettaires ; Antibiotiques ; Antidiabétiques oraux ; IEC et sartans ; IPP ; Ostéoporose post-ménopausique ; Psychotropes ; Statines et hypolipémiants ; MEDIC’AM 2007 : La réforme 2004 de l’Assurance maladie aura-t-elle réussi à modifier la prescription du médicament dans le champ conventionnel ? ; Le NHS bien plus malin que la Cnamts ! ]
Alors oui, nous attendons que les choses changent enfin et que nos politiques agissent davantage dans l’intérêt des patients, des assurés sociaux et des professionnels de santé.
Nous avons vraiment hâte de voir le rééquilibrage tant espéré de la formation et l'information des médecins sur le médicament, en ville comme à l'hôpital. Celles-ci ont été laissées aux mains des seules firmes.
Il est capital que l’Etat assume ses responsabilités en la matière. Le financement par l’argent public de ces actions de formation et d’information indépendante est une nécessité absolue pour accroitre l’efficience et la pertinence des prescriptions.
« Le changement, c’est maintenant », entendait-on voici encore quelques semaines.
Alors « Chiche » ?
Bien cordialement
François PESTY
[1] : Avant juillet 2009 (Elle s’appelait « Commission des affaires culturelles, familiales et sociales ») : http://www.assemblee-nationale.fr/commissions/cafc-presidents.asp ; Depuis juillet 2009 : http://www.assemblee-nationale.fr/commissions/cafsoc-presidents.asp
[2] : Mission d’évaluation et de contrôle des lois de financement de la sécurité sociale
[3] : Dossier de presse de la Cnamts « Médicaments : une croissance modérée des dépenses en 2009, dans la tendance de ces dernières années » - 20/09/2010
[4] : Point de repère N°34 - « Médicaments remboursables délivrés en officine : principales évolutions en 2009 » - Décembre 2010.
22/03/2012 - La Cnamts peut-elle encore parler de « maîtrise médicalisée » à propos de ses prétendues économies sur le médicament en 2011 et des nouveaux objectifs fixés aux médecins libéraux et aux hospitaliers pour 2012 ?
Une certaine presse « économique » se fait l’écho (le jeu de mot est facile) d’un grand millésime pour 2011 concernant la soit-disante « maîtrise médicalisée » en nous assenant le chiffre faramineusement sorti du chapeau de 333 millions d’euros d’économies sur les médicaments, au lieu des 261 prévus. Un titre un rien racoleur : « L’assurance-maladie a économisé plus qu’attendu en 2011 ». Excusez du peu…
De concert, le leader incontesté de la presse médicale essentiellement financée par la publicité sur le médicament s’exclamait la veille au soir : « Maîtrise médicalisée : 612 millions d’euros d’économies en 2011, mieux que prévu ! ». Ce qui ressemble davantage à un habillage de bilan bien opportuniste en période électorale, qu’à une information vérifiée et validée…
Signe des temps, la Caisse Nationale utilise les mêmes médias que les firmes pharmaceutiques pour ses campagnes de communication.
Cliquer sur l’image ci-dessous pour ouvrir l’article des Echos du 22/03/2012 Cliquer sur l’image ci-dessous pour télécharger l’article du Quotidien du Médecin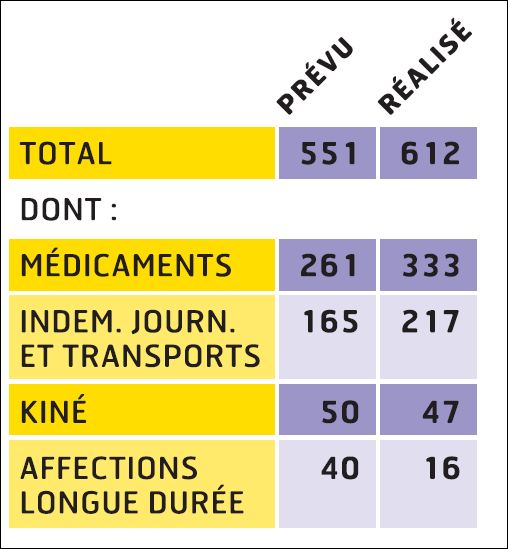 du 21/03/2012
du 21/03/2012
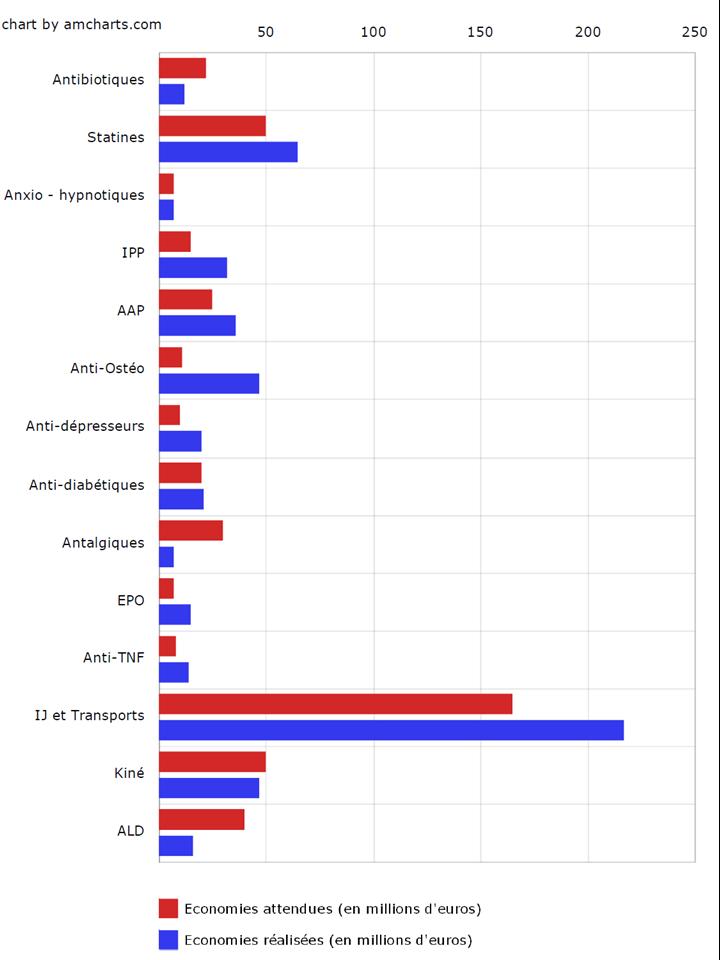
Simultanément, les objectifs pour 2012 du P4P à la française, le paiement à la performance pour les médecins libéraux, ont été publié ce jour au JO. Ils sont officialisés en annexes de l’arrêté du 5 mars portant approbation de l’avenant N°3 à la convention signée le 26 juillet 2011 entre les syndicats médicaux représentatifs et l’assurance maladie.
Dans la même édition du journal officiel, est annoncée l’inscription d’une nouvelle spécialité pharmaceutique sur la liste des médicaments onéreux, remboursés en sus des prestations d’hospitalisation (en clair, cela signifie que l’assurance maladie rembourse rubis sur l’ongle), mais pas en sus de nos cotisations sociales.
HALAVEN® 0,44 mg/ml injectable flacon de 2 ml, la bien-nommée (« Ah la veine ! »), telle est l’heureuse élue, choyée par le ministre. Une nouvelle molécule commercialisée par un laboratoire japonais et qui a reçu une AMM dans le cancer du sein localement avancé ou métastasé en 3ème ligne (c'est-à-dire lorsque deux autres lignes de chimiothérapie ont échoué). La commission de la transparence de la Haute Autorité de Santé (HAS) avait pourtant étudié le dossier en juillet 2011 et signifié dans son avis éponyme que le progrès thérapeutique apporté par cette nouvelle option de traitement était mineur (Pour celles et ceux qui n’aurait pas de temps à consacrer à la lecture des 10 pages de l'avis, rendez-vous à la page 9, au « 4.2 Amélioration du service médicale rendu »). Spécifions que cela fera deux ans à la fin de l’année que le Conseil de l’hospitalisation s’est prononcé pour ne pas inscrire sur la liste les médicaments dont le progrès thérapeutique est nul ou mineur. L'arrêté ne manque pas d'air en citant « Vu la recommandation du conseil de l’hospitalisation N° 2010-25 en date du 18 novembre 2010 relative à la liste des spécialités pharmaceutiques facturées en sus des prestations d’hospitalisation », car c’est précisément cette recommandation que le ministre ne suit pas depuis donc… novembre 2010. Voir à ce sujet notre article du 08/11/2011 : « Gérer « indication par indication » les médicaments de la liste en sus, une solution « dans les tuyaux », médicalement justifiée, éthique et responsable pour trouver les 700 millions d’euros d’économies manquantes afin d’abaisser l’ONDAM 2012 à 2,5% »…
A noter que vous pourrez trouver la recommandation 2010-25 du Conseil de l’hospitalisation qui fixe ce que devraient être les nouveaux critères pour inscrire, ne pas inscrire et radier les produits de la liste, largement commentée page 19, et placée dans son intégralité en annexe 1, page 45-50, dans le rapport 2011 au parlement de la T2A. Preuve s'il en était besoin, que ce ne sont pas les technostructures ministérielles, mais bien le ministre qui pour des raisons politiques laisse perdurer ce système non éthique et dispendieux. Il se dit qu'une mission IGAS plancherait actuellement sur la question...
A propos des médicaments de la liste en sus, une circulaire DSS/DGOS du mois de décembre 2011 nous apprenait la minceur de la régulation en ce domaine : 284 établissements ciblés (conforme à l’objectif fixé à 10% des hôpitaux), 136 contrôlés, 28 plans d’actions conclus dans seulement 8 régions (sur 26) et, ce n’est pas mentionné dans le texte mais dans un tableau,… 0 € d’indu récupéré !
Le taux d’évolution national à ne pas dépasser en 2012 pour les dépenses de médicaments onéreux dans nos hôpitaux a été fixé à 2% dans un arrêté ministériel publié la semaine dernière (Merci à Gérard BIETH et sa lettre annuaire sécu, pour leur minutieuse veille réglementaire). Mais ce taux n’a aucun sens, puisque les radiations incomplètes, faites en violation du principe d’équité de traitement entre les molécules de la liste et celles qui en sortent, prôné par le Conseil de l’hospitalisation, créent de facto un biais de prescription en faveur des molécules les plus coûteuses, faussement innovantes, laissées sur la liste et qui partagent pourtant les mêmes indications que les anciennes moins onéreuses, mais extirpées et reconduites dans l’aire de la tarification à l’activité… Le taux faible d’évolution et qui certes s’infléchit année après années, masque en réalité une profonde recomposition de la liste avec de forte progression pour de nombreuses fausses innovations qui minent encore plus notre système solidaire.
Ce système pernicieux provoque ainsi mécaniquement un glissement de la prescription (effet structure à l’intérieur même de la liste) au fur et à mesure que les brevets tombent (les molécules onéreuses, y compris et surtout dans le cancer, finissent aussi par être génériquées), qui se surajoute aux moyens promotionnels considérables des firmes pharmaceutiques. Lesquels n’ont pas été bridés, contrairement à ce qu'avait annoncé initialement le ministre, par la Loi BERTRAND de renforcement de la sécurité sanitaire du médicament et des produits de santé.
Vous avez dit « maîtrise médicalisée » ?
Revenons un instant sur les objectifs 2012, dits d’efficience en matière de prescription médicamenteuse, cette fois-ci en médecine ambulatoire. Qu’il s’agisse des antibiotiques, des inhibiteurs de la pompe à protons, des statines, des antihypertenseurs, des antidépresseurs, dans chaque classe thérapeutique, les indicateurs de performance sont presque tous formulés de la manière suivante :
« Nombre de boite prescrites dans le répertoire des génériques sur le nombre total de boites prescrites pour l’ensemble de la classe thérapeutique considérée ».
Croyez-vous, comme l’assurance maladie nous y invite, que prescrire dans le répertoire des génériques conduise immanquablement au comportement le plus efficient ?
Eh bien non !
Pour plus de détail, se reporter à l’article du 26/08/2011 « La nouvelle convention médicale récompensera aussi bien les médecins les plus efficients que ceux qui ont la main lourde sur l’ordonnance… »
Quant aux prétendus bons résultats de la Cnamts. Ils sont en l’état absolument invérifiables.
La caisse nationale peut bomber le torse, mais alors qu’elle le faisait par le passé, elle s’est bien gardé de rendre public son fichier détaillé des remboursements de médicaments (MEDIC'AM) depuis près de deux ans !
Les dernières données concernent l'année 2009 : http://www.ameli.fr/l-assurance-maladie/statistiques-et-publications/donnees-statistiques/medicament/medic-am-2004-2009.php
L’institution instrumentalisée par l’Etat depuis que son directeur général possède autant de pouvoir et qu’il est nommé en conseil des ministres, mélange tout à propos de la maîtrise médicalisée : les baisses de prix, les génériques, la visite des DAM…
Comme nous l’avons mesuré ici même régulièrement, du temps où la Cnamts diffusait son fichier détaillé des remboursements de médicaments, ce sont surtout les baisses de prix et l’arrivée de copies sur le marché après la perte des brevets des médicaments de marque qui transpirent dans les économies autoproclamées par l’assurance maladie obligatoire. Cela relève en réalité d’une maîtrise purement comptable.
La maîtrise médicalisée supposerait que les comportements de prescription changent. Il n’en est rien jusqu’à preuve du contraire.
Schématiquement, la maîtrise médicalisée, la vraie, est intelligente, participative, responsabilisante. Elle requière une démarche exigeante, car nécessitant beaucoup de pédagogie et d’accompagnement auprès des professionnels dce santé, médecins en tête, pour modifier leurs habitudes. Les effets qu'elle produit sont tangibles, durables et impactent financièrement. La maîtrise comptable est brutale, unilatérale, déresponsabilisante, facile à mettre en œuvre. Les modifications qu'elle amène sont éphémères car très souvent contournées.
Maîtrise « médicalisée », le mot est vraiment galvaudé, banalisé par la Cnamts.
Mensonges et propagande ! Le dispositif des DAM, un millier de délégués de l'assurance maladie, est selon toutes vraisemblances toujours aussi peu opérant, pour le bien être des firmes pharmaceutiques et des politiques cupides qui en tirent un bénéfice notable.
Il serait certainement salutaire pour la démocratie sanitaire qu’une certaine presse arrête de boire le petit lait et de servir la soupe aux politiques !
Mais que l’on ne fasse pas non plus le reproche à l’Institut PUPPEM de ne faire que critiquer. N’avait-il pas proposé des objectifs bien plus ambitieux en matière de maîtrise médicalisée sur le médicament en élaborant une nouvelle feuille de route 2012-2014 pour la visites des DAM sur le médicament, ainsi qu'un changement radical de la gestion des médicaments remboursés en sus des prestations d'hospitalisation.
Puisse-t-il être entendu par le prochain locataire de l’Elysée ou par ses futurs proches collaborateurs…
François PESTY
17/03/2012 - Microsoft menace de destruction tous les sites web créés avec son offre gratuite OSLB (Office Live Small Business), qui n’auraient pas migré au 30 avril 2012 vers sa nouvelle offre payante Office 365 !
J'ai créé voici plusieurs années mes deux sites web dédiés à des thématiques de santé, PUPPEM, puis OPTIMIZ, avec Microsoft Office Live Small Business (OSLB), une offre précédemment gratuite. Ces deux sites dans la construction desquels j’ai investi un temps considérable pour enrichir leur contenu, sont comme tous les sites créés avec OSLB menacés au 30 avril 2012 (c’est demain…) de démolition par Microsoft !
Celui-ci a fixé un ultimatum aux utilisateurs de cette solution pour migrer leurs sites web sur la nouvelle solution, cette fois payante, Office 365. Le 1er mai, dans l’indifférence générale d’un « entre deux tours d’élection présidentielle » en France, les sites ne seront plus accessibles au public !
Les utilisateurs ont la possibilité de tester gratuitement pendant 6 mois la nouvelle offre payante de Microsoft.
Celle-ci s’avère moins performante que l’ancienne gratuite…
Pire, la procédure de transfert des sites décrite dans un guide (accessible à l’adresse : http://g.microsoftonline.com/0rmcm00fr-FR/5223) est une véritable usine à gaz ;
Il s’agit de coller - copier chaque page de son site. Et en plus cela bogue, il est nécessaire de tout repaginer…
En ce qui me concerne, ce sont des semaines de travaux inutiles que Microsoft veut m’imposer, pour simplement recréer ce que j’ai déjà construit (et en moins bien).
De surcroit, Microsoft ne propose plus de support technique accessible au téléphone pour son ancienne offre OLSB, et uniquement un support technique en anglais au téléphone !
Les anciens forums de discussion semblent avoir été neutralisés…
- Avez-vous entendu parler de cette situation proprement scandaleuse ?
- La presse spécialisée en a-t-elle déjà parlé ?
- Qui pourrait relayer l’information ?
- Microsoft a-t-il le droit de procéder de la sorte en France ?
- Peut-il impunément détruire les sites web créés par ses utilisateurs ?
- Quels sont les recours possibles ?
N’hésitez-pas à diffuser largement cette information.
Bien cordialement
François PESTY
Remarques :
La page d’accueil de l’ancienne offre gratuite Microsoft Office Live Small Business répond aux abonnés absent, ou plutôt renvoie à la nouvelle offre Office 365 : http://www.microsoft.com/office/olsb/OLSB_Home_FR-CA.htm
Son service d’assistance en ligne ne répond plus : http://mymfe.microsoft.com/Office__Live__Small__Business/feedback.aspx?formID=182&locale=fr-fr
Seul forum à fonctionner, celui contrôlé par Microsoft : http://ask.officelive.com/smallbusiness/
Le forum pour la communauté francophone : http://officelivecommunity.com/frhomepag.aspx renvoie inexorablement à une url qui ne fonctionne pas : http://boards.live.com/OLFRboards/board.aspx?BoardID=871
Les forums de discussion non contrôlés par Microsoft semblent avoir été neutralisés :
- Celui-ci est en reconstruction : http://zarleu.web.officelive.com/default.aspx
Ken Symicek, le génial webmaster du site : http://small-business.web.officelive.com/default.aspx qui propose (proposait) des trucs pour améliorer OSLB, a créé le site suivant : http://www.builditon365.com/Pages/default.aspx pour nous informer de ses progrès dans le transfert de ses sites OLSB vers O365 ;
Il prévient dors et déjà que O365 offre un service inférieur à OLSB ; Nous sommes bien du même avis…
François PESTY
23/02/2012 - Appel à participation et à contributions pour le Colloque « Surmédicalisation, surdiagnostics et surtraitements » des vendredi 27 et samedi 28 avril 2012, à Bobigny.
Cela pourrait presque prêter à sourire, si l’on regarde par exemple le clip ci-dessous qui circule régulièrement sur la toile.
Cliquer sur l’image pour télécharger la vidéo « GROLAND.CON » qui aborde les surtraitements médicamenteux
Cependant, les affaires à répétition VIOXX®, AVANDIA®, …, MEDIATOR® et autres MULTAQ®, VASTAREL®, médicaments anti-alzheimer… sont là pour nous interpeller :
La surmédicalisation n’est-elle pas devenue l’un de nos problèmes sociétaux les plus sérieux ?
Au nom du groupe Princeps, j’ai grand plaisir à vous convier au colloque « Surmédicalisation, surdiagnostics et surtraitements », que nous organisons avec le Département de Médecine Générale de la Faculté de Médecine de Bobigny et la Société de Formation Thérapeutique du Généraliste (SFTG), les vendredi 27 et samedi 28 avril 2012.
Je vous propose de télécharger en cliquant les liens ci-après, la plaquette du Colloque qui contient les informations nécessaires à votre inscription, ainsi que le programme des six ateliers proposés.
Jean-Claude SALOMON, Michel THOMAS, Omar BRIXI, Alain SIARY, Michel DORE, Elena PASCA et moi-même comptons sur votre participation nombreuse et sur vos contributions.
N’hésitez-pas à me contacter pour toute information complémentaire.
Avec mes remerciements
Bien cordialement
François PESTY