Cliquer sur l'image pour ouvrir la diapositive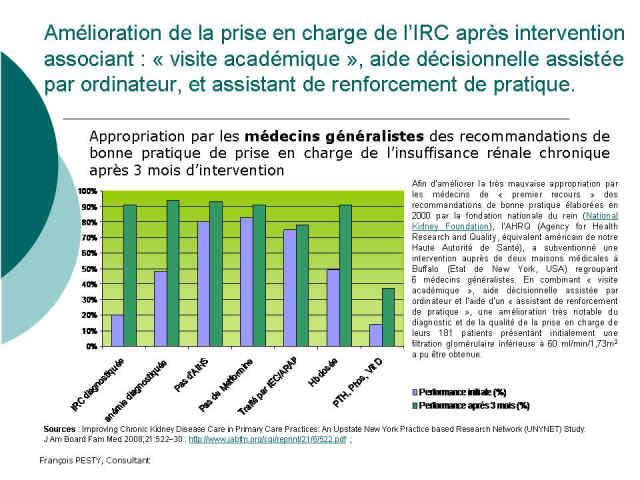
Joyeuses fêtes !
François PESTY
(*) Un titre plus approprié aurait pu être : « L’homme politique en France, enfant gâté des industries du médicament » ; A noter qu’au cours de cette même table ronde, il est également apparu que le CEPS, compte tenu des propos de son président, Noël RENAUDIN, pourrait avantageusement être rebaptisé « Comité de soutien économique aux industries des produits de santé »...
28/11/2008 - Le New York Times épingle entre autres Pfizer, qui pour protéger les ventes de son antihypertenseur Amlor®, n'a pas hésité à payer 200.000 dollars un conférencier en 2003 ; Aux USA cela se sait ; En France, le gouvernement préfère l'opacité et a reculé la semaine dernière en ordonnant l'abandon de l’article sur la transparence de l’information médicale !
Dans un article historique publié dans le New York Times daté du vendredi 28 novembre 2008, Andrew POLLACK épingle la stratégie d’information délibérément trompeuse des firmes pharmaceutiques sur le médicament – Notamment, un conférencier américain a touché de Pfizer 200.000 dollars en 2003 pour protéger les ventes d’Amlor®, et préserver ainsi les bénéfices de la firme ;
L’article relate la chronique d'un lobbying pharmaceutique acharné qui a réussi à anéantir l’impact pourtant très positif sur les dépenses d’antihypertenseurs, que n’aurait pas manqué d’avoir eu l’étude ALLHAT, si corruption, désinformation, mensonge par omission et manque d’éthique n’avaient pas été là ;
ALLHAT, une étude clinique organisée par le gouvernement fédéral des États-Unis d’Amérique, et publiée en 2002 dans le JAMA, avait en effet démontré la supériorité chez une majorité de patients hypertendus américains des diurétiques thiazidiques (chlorthalidone, ou hydrochlorothiazide notamment) sur les autres antihypertenseurs, notamment inhibiteurs calciques, et inhibiteurs de l’enzyme de conversion (IEC); Les diurétiques donnent les meilleurs résultats en terme de prévention des risques cardiovasculaires et cérébrovasculaires, et sont beaucoup moins chers !
Les conclusions d’ALLHAT ont été reprises dans les recommandations américaines, anglaises et australiennes, notamment, et d’une façon moins claire (seul le coût plus bas des diurétiques est mentionné, sans leur donner une préférence) dans les recommandations françaises et européennes (dont les experts ont manifestement été beaucoup plus influencés par l’industrie du médicament que par ALLHAT...) ;
ALLHAT, une étude que les DAMs devraient bien connaître et savoir présenter aux médecins pour « planter le décors » à l’occasion de leurs campagnes de visites médicalisées portants sur les antihypertenseurs IEC & sartans...
Cliquer sur l’image ci-dessous pour télécharger la diapositive

A la lecture de cet article du New York Times, nous prenons pleinement conscience des pratiques honteuses des laboratoires, avec la complicité de certains professionnels de santé, et de la vulnérabilité des médecins face à la désinformation qu’ils reçoivent sur le médicament de la part de l’industrie pharmaceutique ;
Dans le même temps on ne peut que se réjouir que de tels agissements condamnables puissent être identifiés et diffusés au grand public chez l’Oncle Sam ;
Alors chez nous, lorsque l’on voit ce qu’est advenu la semaine dernière de « l’article 33 bis A » du projet de Loi de financement de la sécurité sociale pour 2009, article que les parlementaires de la commission mixte paritaire (CMP) sur ordre du gouvernement ont fait purement et simplement disparaître, c’est un sentiment de colère et d’indignation qui nous envahis !
Zoom arrière sur ce qui peut s'apparenter à une comédie burlesque, jouée par quelques parlementaires et Madame la Ministre. Tout avait pourtant si bien commencé lors de la séance d'examen par le Sénat du PLFSS 2009 le 19 novembre, avec l'adoption surprise par les sénateurs, et contre l'avis du gouvernement, de l'amendement N° 430 déposé par un groupe de sénateurs conduit par M. François AUTAIN.
Mais résumons les principaux arguments des uns et des autres lors des 2 débats qui ont abouti au rejet pur et simple de l’article 33 bis A [mes commentaires entre crochets] :
Nous passerons rapidement sur l’avis défavorable, non argumenté, du sénateur UMP Alain VASSELLE, rapporteur pour la Commission des affaires sociales au Sénat ;
Madame la Ministre Roselyne BACHELOT-NARQUIN, a jugé pour sa part que « si ces conventions étaient rendues publiques, se poseraient évidemment des problèmes graves d’atteinte à la vie privée » ; [On se demande bien lesquels ; Est-ce par exemple du domaine de la vie privée que de recevoir, pour un leader d’opinion hospitalo-universitaire plusieurs dizaines de milliers d’euros en honoraires versés par un laboratoire pharmaceutique en échange de bons et loyaux services ?]
D’après Yves M. BUR, l’article 33 bis A, n’a pas d’incidence financière, c’est donc un « cavalier social » [dans le jargon de nos parlementaires, il s’agit d’un amendement sans incidence économique sur le budget de la sécu, et qui de par la Loi, ne peut être adopté dans le cadre de la Loi de financement de la sécu] ;
[Comme si les leaders d’opinion rémunérés par l’industrie avaient l’habitude de recommander en public les médicaments les plus anciens et les moins coûteux !]
Mme MONCHAMPS : « il ne faut pas donner l’impression de faire peser une suspicion sur les membres des professions médicales et de conduire un procès d’intention à leur égard »
Nous le voyons bien, tout ceci n’est que fausses barbes, pour protéger les intérêts de quelques individus... plutôt que de défendre l’intérêt général...
Cliquer sur l’image ci-dessous pour ouvrir un diaporama avec l’intégralité des débats sur feu l’Art. 33 bis A

Le FORMINDEP, une association qui milite depuis des années « pour une formation et une information médicales indépendantes et au service des seuls professionnels de santé et des patients », avait pourtant mobilisé et communiqué pour défendre l’article.
Il s’agissait, comme dans bien d’autres démocraties dignes de ce nom, simplement de rendre transparentes et accessibles au public les informations tenues jusque là secrètes par les instances régionale et nationales de l’ordre des médecins, concernant les « conventions » passées par les entreprises qui fabriquent ou commercialisent des produits et les médecins ;
Il nous faudra attendre encore quelque temps pour savoir si la France connait des pratiques du même acabit... Mais, n’en doutons pas !
François PESTY
Télécharger l’étude ALLHAT : JAMA_ALLHAT_study_12-2002.pdf
Télécharger la traduction en Français de l'article de Andrew POLLACK dans le New York Times, sur le site de l’association FORMINDEP
09/11/2008 – Non, le CRESTOR®, rosuvastatine, ne sort pas de la cuisse de JUPITER ! Surtout, surtout, ne nous emballons pas après la publication des résultats de cette étude : La pravastatine, en prévention primaire, et la simvastatine en prévention secondaire, demeurent sans nul doute le « premier choix » ! Arrêt sur image :
La Nouvelle Orléans, en direct du congrès de l’AHA, la « grand messe » des cardiologues du monde entier amenés par centaines (milliers) par les firmes pharmaceutiques... AstraZeneca se faisait déjà des gorges chaudes alors que les résultats de l’étude JUPITER n’avaient même pas encore été dévoilés* par le Dr Paul RIDKER, et publiés simultanément dans l’édition online du célébrissime New England Journal of Medicine (pour l’édition papier, il faudra attendre le 20 novembre) ...
Ci-dessous, la diapositive de présentation de Dr RIDKER (traduite fidèlement je l’espère) proposée sur le site de Cardiosource : http://www.cardiosource.com/img/JUPITER_01.ppt
Cliquer sur l’image pour ouvrir la diapositive PowerPoint
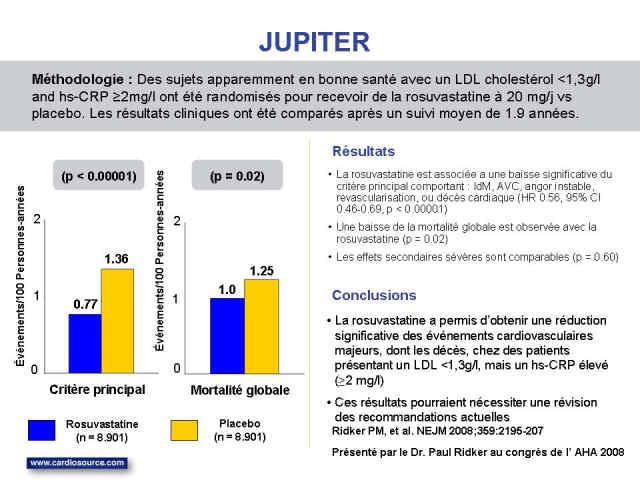
Mais au juste, que nous apprend donc JUPITER ?
Près de 18.000 sujets des deux sexes, triés sur le volet à partir d'un pool de 80.000 patients, apparemment en bonne santé, avec un LDL-cholestérol inférieur à 1,3 g/l, mais présentant une « protéine C-Réactive » élevée, marqueur de l’inflammation, supérieure à 2mg/l, ont été randomisés pour recevoir soit de la rosuvastatine à 20mg, soit le placebo ; A noter tout de même dans les deux groupes, 41% de « syndromes métaboliques », 16% de fumeurs, 16% de patients traités par l’aspirine, et 11% de sujet ayant un parent du premier degré mort prématurément par cardiopathie ischémique ;
L’étude prévue initialement pour une durée de suivi de 4 ans avait été arrêtée prématurément après seulement 1,9 années de suivi moyen, en raison d’une différence significative entre les deux groupes sur le critère principal comprenant : infarctus du myocarde, accidents vasculaire cérébral, angor instable, procédure de revascularisation, ou décès d’origine cardiaque ;
Les résultats sont certes intéressants, mais sont loin d’être faramineux. Comment pourrait-il en être autrement après même pas deux ans de suivi ! Pour le critère principal, le taux d’événements est de 0,77% par an sous rosuvastatine et de 1,36% dans le groupe placebo (p=0,0001), la mortalité toutes causes confondues de 1,0% et 1,25% respectivement (p=0,02) ; Résultat forcément modeste exprimé en terme de réduction du risque absolu... Egalement faut-il noter une ombre au tableau, la rosuvastatine est associée à davantage de nouveaux cas de diabètes survenus au cours de l'étude.
Ce que ne nous apprend pas JUPITER :
Rappelons en premier lieu que les deux premières études publiées avec cette « superstatine » n’étaient pas brillantes (elles ne portaient pas le nom d’un astre ...), puisque dans CORONA et GISI-HF, chez près de 10.000 insuffisants cardiaques, CRESTOR® ne faisait pas mieux que le placebo !
JUPITER, troisième essai d’intervention thérapeutique publié avec la rosuvastatine, est encore une étude versus placebo, et plusieurs statines ont déjà démontré un bénéfice clinique sur ces mêmes « endpoints » ; Tout particulièrement, les meilleurs niveaux de preuves ont été apportés par deux statines, la pravastatine en prévention primaire (WOSCOPS, MEGA), la simvastatine en prévention primaire (4S, HPS) ;
Rappelons ici les excellents résultats obtenus avec la pravastatine à la dose de 10mg en prévention primaire chez des sujets que l’on pourrait également qualifier d’en « apparente bonne santé », avec un LDL-cholestérol normal (1,6 g/l), et appartenant à une population à bas risque cardiovasculaire comme la population française (Ce qui n'est pas le cas dans JUPITER, où ce sont essentiellement des populations à haut risque CV qui ont été étudiées : USA, Écosse, Danemark, Pays Bas...). Avec, ou disons plutôt malgré, une baisse très modique de 15% seulement du LDL-cholestérol (alors que dans JUPITER la rosuvastatine à 20mg fait littéralement s’effondrer ce paramètre lipidique de 50%), la réduction à 5 ans des infarctus du myocarde est de 48%, la mortalité toute causes confondues est diminuée de 32%, les AVC de 35% ...
Les génériques de la pravastatine à 10mg coûtent 2,8 fois moins chers que CRESTOR 5 mg, 4,2 fois moins que le CRESTOR 10mg et 6,3 fois moins que CRESTOR 20mg !
Il est urgent donc de disposer d’une étude comparative de prévention primaire entre rosuvastatine et pravastatine...
Rappelons aussi que dans les grands essais d'intervention avec pravastatine ou simvastatine les résultats commencent à être significatifs dès la deuxième année, donc ne soyons pas impressionnés par l'arrêt prématuré de JUPITER après 1,9 années ;
Rappelons aussi à ceux qui martèlent le message "lower is better" que le bénéfice clinique des statines rapporté jusqu'à présent est indépendant de l'abaissement du LDL-cholestérol. Là aussi, JUPITER ne nous apprend rien de nouveau.
Pour la prévention secondaire, il faut bien noter que c’est toujours le « désert de GOBI » avec la rosuvastatine : deux études négatives chez 10.000 insuffisants cardiaque (CORONA et GISI-HF) ;
Nous aurions donc souhaité une étude comparative, par exemple versus la pravastatine, puisque c’est le champion de la prévention primaire !
JUPITER ne nous apprend donc rien sur la place de la rosuvastatine dans l’arsenal thérapeutique des 5 statines actuellement commercialisées dans notre pays !
En second lieu, et comme le souligne fort à propos Mark HLATKY, Professeur de médecine à la Stanford University School of Medicine, l’essai JUPITER, de par sa conception, n’apporte que des informations indirectes et très limitées sur l’intérêt de doser la CRP en pratique clinique.
A noter une étude rétrospective en sous groupe de l’étude CORONA, présentée sous forme de communication pendant ce même congrès 2008 de l’AHA, qui semblerait retrouver un bénéfice de la rosuvastatine chez les seuls patients qui avaient une CRP élevée...
Ce que nous savions déjà avant JUPITER :
Le Dr Paul RIDKER travaille depuis longtemps sur la piste intéressante de la CRP (protéine C-réactive), ce qui montre qu'il a de la suite dans les idées :
- En 1999, reprenant les résultats obtenus avec la pravastatine dans l’étude CARE (étude de prévention secondaire), il montre que la CRP est nettement abaissée sous pravastatine par rapport au placebo, et cela indépendamment de son effet sur le LDL-cholestérol (Circulation) ;
- En 2002, Paul RIDKER et son équipe de recherche, publient dans le NEJM les résultats d’une étude menée chez près de 28.000 femmes apparemment en bonne santé, avec un suivi de 8 ans et qui démontre que la CRP est un meilleur marqueur prédictif des événements cardiovasculaires que le LDL-cholestérol ;
- En 2004, Paul RIDKER publie dans le JAMA les résultats d’une étude prospective PRINCE, démontrant que l’effet de la pravastatine sur la baisse de la CRP est indépendant de celui sur le LDL-cholestérol ;
Après 2004, la pravastatine (ELISOR® et VASTEN®) est en voie de générication (synonyme de "finis les crédits pour la recherche"), et fort logiquement le Dr Paul RIDKER doit se tourner vers un autre laboratoire que BRISTOL-MYERS SQUIBB, prêt à l'aider financièrement pour poursuivre ses travaux... C'est gagné avec AstraZeneca !
D’autres auteurs ont bien montré que parmi les marqueurs de l’inflammation, la CRP est probablement le meilleur pour prédire les maladies coronariennes, par exemple le travail de PAI, PISCHON et al. publié dans le NEJM en décembre 2004
Conclusion : Avec JUPITER, la rosuvastatine redresse la barre (dans CORONA et GISI-HF, les deux premiers essais publiés, elle ne faisait pas mieux que le placebo) ; Mais avant de préférer cette statine, mieux vaudrait disposer d’études comparatives attestant de son éventuelle supériorité sur les deux championnes que restent la pravastatine (prévention primaire) et la simvastatine (prévention secondaire) ; JUPITER ne tranche pas la question de l’intérêt d’intégrer « en routine » le dosage de la CRP dans l’identification des patients susceptibles de bénéficier d’un traitement par statine ;
(*) Des médecins français avaient déjà été visités par des délégués d’AstraZeneca la semaine précédent le congrès de l’AHA et la publication dans le NEJM... Mais que fait l’Afssaps ? Et dommage que l’observatoire de la Revue Prescrire n’existe plus ...)
Télécharger l’étude JUPITER : NEJM_JUPITER_study_20-11-2008.pdf
Télécharger l’éditorial de Mark HLATKY dans le même numéro du NEJM : NEJM_JUPITER_Editorial_Mark_Hlatky_20-11-2008.pdf
Télécharger la note de l’éditeur (NEJM) : NEJM_JUPITER_trial_from_the_editor_09-11-2008.pdf
Télécharger le travail de Paul RIDKER publié dans Circulation en 1999 (pravastatine et taux de CRP dans l’étude CARE) : Circulation_Ridker_Long_term_effect_of_pravastatin_on_CRP_levels_07-1999.pdf
Télécharger la démonstration par Paul RIDKER de la supériorité de la CRP comme marqueur prédictif des événements CV par rapport au LDL-cholestérol (NEJM en 2002) : NEJM_Ridker_comparison_of_CRP_and_LDL_Chol_in_prediction_of_first_CV_event_11-2002.pdf
Télécharger l’étude prospective PRINCE, pravastatine et CRP, de P. RIDKER dans le JAMA en 2004 : JAMA_PRINCE_study_pravastatin_CRP_evaluation_07-2004.pdf
Télécharger l’abstract dans Circulation de l’analyse post hoc de l’étude CORONA par sous groupes en fonction du taux de CRP : Circulation_Abstract 2370_AHA_CORONA_Endpoints_and_CRP_levels_11-2008.pdf
Télécharger le travail de PAI, PISCHON et al. dans le NEJM de 2004 : NEJM_Pai_Inflammatory_markers_and_risk_of_CHD_12-2004.pdf
Télécharger l'article de Jean-Michel BADER dans Le Figaro : Le_Figaro_JM_BADER_CRESTOR_10-11-2008.pdf
Le lien vers l'article de Pharmacritique : http://pharmacritique.20minutes-blogs.fr/tag/crestor
Que penser de JUPITER ? Mensonges et propagande encore ? BAROUD D’HONNEUR AVANT BANQUEROUTE ? Sur le blog de Michel de LORGERIL, Cardiologue et chercheur au CNRS : http://www.ticetc.info/delorgeril/index.php/2008/12/09/19-que-penser-de-jupiter-mensonges-et-propagande-encore-baroud-dhonneur-avant-banqueroute
28/10/2008 - Examen du PLFSS 2009. Mais où sont donc passées les 92 propositions du rapport de la MECCS sur le médicament ?
Aujourd'hui commence l’examen du PLFSS 2009 dans l’hémicycle. Parole de parlementaires, promis, juré, les 92 propositions du rapport de la MECCS devaient toutes y figurer ! En cherchant bien, seules 3 propositions ont fait l’objet d’amendements, avec une issue incertaine...
Rappelez-vous, le 30 avril 2008, la Commission des affaires sociales de l’Assemblée Nationale adoptait à l’unanimité le rapport d’information élaboré par la MECSS (Mission d’évaluation et de contrôle des Lois de financement de la sécurité sociale) portant sur « la prescription, la consommation et la fiscalité du médicament » ; Ce rapport avait occupé nos députés pendant six mois en 2007 et 2008 ; 75 personnalités avaient été écoutées avec attention lors de 30 séances d’audition ; un rapport volumineux (503 pages) était assorti de 92 préconisations consensuelles...
Et Pierre MORANGE, médecin généraliste de métier et vice-président de la MECSS de clôturer les débat en s’exclamant : « La MECSS aura à cœur, dans le cadre de la discussion du projet de loi de financement de la sécurité sociale pour 2009, de veiller à la traduction, par voie législative ou réglementaire, de ses préconisations afin que celles-ci soient appliquées effectivement dans le système de soins ».
Nous en étions tous restés « pantois ».
Perdues de vue, que sont devenues ces 92 propositions ?
Eh bien, votre serviteur s’investit d’une nouvelle mission : La mission d’évaluation et de contrôle des travaux de la MECSS ;
De quoi c’est il s’agit ?
Pointer parmi les 92 propositions des députés de la MECSS sur le médicament, celles qui ont trouvé une traduction dans le PLFSS 2009 ou qui sont proposées sous forme d’amendements déposés.
Ne tournons pas autour du pot. Le bilan est plus que mince :
- Aucune proposition de la MECSS n’a été intégrée au PLFSS 2009 ;
- Seules 3 propositions ont fait l’objet d’amendements, avec une issue incertaine ;
Les questions qui se posent : Nos députés ont-ils, de leur propre chef, abandonné ces propositions pourtant adoptées unanimement, par discipline, la politique du médicament s’élaborant de l’autre coté de la Seine, au Palais ?
Ou bien est-ce encore une illustration du courage politique qui ne rapprochera pas nos élus de leurs concitoyens ?
Le tableau ci-après reprend les 92 propositions de la MECSS ; en bleu turquoise les 24 propositions qui avaient ma préférence et quelques commentaires tout personnels ;
Cliquer sur l’image pour ouvrir le fichier, puis "Aperçu avant impression" ou "Imprimer"
Mais alors, que nous réserve à la place le PLFSS 2009 et les amendements des députés des commissions des affaires sociales et des finances ?
Eh bien par exemple, Monsieur Yves BUR, l’un des rapporteurs, n’a rien trouvé de mieux pour défendre encore et toujours le princeps et les grandes firmes pharmaceutiques, que de proposer de nouvelles baisses des prix pour les médicaments génériques. Cette fois-ci, l’homme a de la ressource, au travers d’un appel d’offre que l’Etat organiserait pour ne sélectionner que 3 fabricants de génériques (Lire l’amendement N°93) et l’article des Echos la semaine dernière ;
M. BUR ce n’est pas de cette manière que vous redonnerez le goût aux médecins de prescrire ces médicaments qui tombent un peu plus dans l’oubli...
Ci-dessous les articles et amendements concernant le médicament en ville ; Pour le médicament à l’hôpital et les dispositions concernant les systèmes d’information de produits de santé, voir également le billet du jour à la page « actualités » du site dédié à l’optimisation de l’informatisation du circuit du médicament : http://optimiz-sih-circ-med.fr/Actu.aspx
Plutôt que les textes très abscons, car rédigés en jargon juridique, vous trouverez les « exposés des motifs » des articles du PLFSS 2009 et les « exposés sommaires » des amendements, qui sont beaucoup plus explicites :
Article 14 « I. – La loi de financement de la sécurité sociale pour 1999 a institué une contribution à la charge des entreprises exploitant des médicaments remboursables (article L. 138-10 et suivants du code de la sécurité sociale), représentant leur participation à la régulation des dépenses de l’assurance maladie. Les entreprises sont exonérées de ce dispositif quand elles signent une convention avec le Comité économique des produits de santé. Elles doivent alors accepter certaines baisses de prix et payer des remises quantitatives qui sont globalement égales au montant théorique de la clause de sauvegarde. Des compensations sont opérées entre certaines baisses de prix et le montant des remises dues. Les conventions prévoient des exemptions de remises par agrégats pharmaco-thérapeutiques par exemple pour les médicaments pédiatriques ou pour les médicaments s’étant vu reconnaître une amélioration du service médical rendu) à l’occasion de leur inscription au remboursement. L’assiette de la contribution est toujours collective. Elle consiste en la part du chiffre d’affaires des médicaments remboursables en ville de l’ensemble des entreprises du secteur qui dépasse un certain seuil déterminé en appliquant le taux de croissance cible, taux K, au chiffre d’affaires de l’année précédente. Sont exonérés les médicaments orphelins. En 2005, l’assiette a été élargie au chiffre d’affaires des médicaments rétrocédables. La contribution concerne le chiffre d’affaires des médicaments remboursés en ville ou rétrocédables par les établissements hospitaliers. Il est proposé d’étendre le périmètre de la régulation hospitalière, à partir de 2010, à tous les produits utilisés à l'hôpital (hors GHS), ce qui implique une extension aux médicaments de la liste en sus. Les dépenses associées aux médicaments de cette liste sont en effet en forte croissance. Il est également proposé au 2° du I de pérenniser le taux de contribution de la taxe sur le chiffre d’affaires à 1 %. Cette mesure se justifie d’une part par un besoin de recettes supplémentaires et d’autre part par une prolongation de la responsabilisation de l’industrie pharmaceutique dans un contexte d’augmentation des chiffres d’affaires de médicaments. Les dates de versement de la contribution sur les dépenses de promotion des médicaments et de celle assise sur les dépenses de promotion des dispositifs médicaux de l’année N-1, fixées au 1er décembre de l’année N, sont tardives. Les produits de ces taxes sont destinés à contribuer au financement de la CNAMTS (Caisse nationale d’assurance maladie des travailleurs salariés) et de la HAS (Haute Autorité de santé : 10 % du rendement total de la contribution sur la promotion des médicaments en vertu de l’article L. 161-45 du CSS). Perçues trop tardivement, elles pèsent sur la trésorerie de ces deux établissements publics, et ne permettent pas une bonne visibilité pour la construction des budgets. Il est donc proposé de fixer les versements des contributions dues au titre de l’année précédente pour moitié au 1er juin et pour moitié au 1er décembre de l’année suivante. Enfin, le taux K était fixé à 1 % pour la période 2005 à 2007 et 1,4 % pour l’année 2008. La mesure consiste à fixer ce taux K à 1,4 % pour l’année 2009. Les contributions des entreprises concernées viendront en déduction des dépenses remboursées de médicaments et non plus en recettes pour l’assurance maladie ».
Amendement N°119 et N°120, présenté par M. Lionel TARDY, (UMP) – Augmenter l’assiette de la taxe sur la publicité pharmaceutique (en incluant la presse médicale spécialisée) et augmentant le taux de taxation ;
Amendements N°60, présenté par M. Yves BUR (UMP), rapporteur au nom de la commission des affaires culturelles, familiales et sociales pour les recettes et l'équilibre général : « ARTICLE 14 - Rédiger ainsi l’alinéa 10 : « 4° Le taux de la contribution mentionnée à l’article L. 245-6 du code de la sécurité sociale due au titre du chiffre d’affaires réalisé au cours de l’année 2009 est fixé, à titre exceptionnel, à 1 %. » ; Cet amendement n’apporte rien puisque l’article 14 du PLFSS 2009 prévoit déjà une taxation à hauteur de 1% de chiffre d’affaire (Si ce n’est que sur le plan sémantique il redonne à ce taux son caractère « exceptionnel » alors que la PLFSS proposait de pérenniser cette valeur de 1%) ;
Amendement N°93, présenté par M. Jean-Pierre DOOR (UMP), rapporteur au nom de la commission des affaires culturelles, familiales et sociales pour l'assurance maladie et les accidents du travail et M. Yves BUR – Mettre en place des appels d’offres pour faire baisser le prix des génériques (IPP, IEC et statines) ;
Amendement N°96, présenté par M. Jean-Pierre DOOR (UMP), rapporteur au nom de la commission des affaires culturelles, familiales et sociales pour l'assurance maladie et les accidents du travail, M. Yves BUR (UMP), et Mme Catherine LEMORTON (PS) : « Le présent amendement vise à élargir le répertoire des groupes génériques et donc les possibilités de substitution, génératrices d’économies pour l’assurance maladie, à des spécialités orales à libération modifiée et à des spécialités qui répondent à la définition du médicament générique et qui, bien que n’ayant pas démontré de bioéquivalence avec la spécialité de référence, sont supposées offrir des caractéristiques identiques du point de vue de la sécurité et de l’efficacité ».
Télécharger le PLFSS 2009 dans sa version du 15/10/2008 : PLFSS2009_v15-10-2008.pdf
Télécharger les amendements enregistrés sur le bureau de l’Assemblée Nationale au 23/10/2008 : Amendements_PLFSS2009_23-10-2008.pdf
Télécharger le rapport de la MECSS sur le médicament – Mme Catherine LEMORTON, Rapporteure - 30/04/2008 : AN_C-Le_Morton_Rapport_info_médicament_30-04-2008.pdf
Télécharger le compte rendu de l’examen par la Commission des affaires sociales du rapport d’information de Mme Catherine LEMORTON, portant sur le médicament : AN_CR_Commission_aff_sociales_rapport_MECSS_Médicament_30-04-2008.pdf
Télécharger l’article des Echos avec les amendements du député Yves BUR : LesEchos_Yves_BUR_et_les_generiques_23-10-2008.pdf
22/10/2008 – Le Ministre Eric WOERTH s’étonne des lenteurs de la Haute Autorité de Santé ; Dites-lui bien que si le gouvernement souhaite véritablement aller plus vite en matière de juste prescription des antihypertenseurs, des anticholestérols et des IPP, c’est faisable et nul besoin d’attendre après la HAS pour cela !
Quant à l’Autorité (vraiment indépendante ?) qui vient effectivement de rendre sa toute première « copie » médico-économique, portant sur le choix entre les antihypertenseurs IEC et sartans, elle mérite l’appréciation : « Pas mal, mais peut mieux faire ! » ;
La Loi de financement de la sécurité sociale pour 2008, votée à l’automne dernier et promulguée dans la foulée le 21 décembre 2007, a habilité la Haute Autorité de Santé (HAS) à émettre de avis ou recommandations médico-économiques (Article 41, page 16) ; Neuf mois plus tard, elle accouche aux forceps d’un premier texte ;
Que faut-il en penser ?
Du côté « verre à moitié plein », la HAS recommande les IEC en première intention, et les sartans uniquement chez les patients intolérants aux IEC.
Coté « verre à moitié vide », nous aurions souhaité que l’institution fasse le tri du « bon grain et de l’ivraie » entre les différents IEC !
La HAS a-t-elle déjà oublié l’avis publié le 23 janvier 2008 par sa Commission de la transparence sur le COVERSYL®, l’un des antihypertenseurs les plus coûteux et les plus prescrits du moment, motivé par la nouvelle indication AMM obtenue auprès de la bien plus accommodante Afssaps par les laboratoires SERVIER suite à la publication des résultats de l’étude EUROPA :
« Au vu des données disponibles et en l’absence d’études comparatives versus les autres IEC, l’impact supplémentaire sur la morbimortalité et la qualité de vie de COVERSYL® par rapport aux autres IEC n’est pas quantifiable. La transposabilité des résultats des essais à la pratique clinique n’est pas assurée »...« La commission de la Transparence considère que COVERSYL apporte une amélioration du service médical rendu mineure (ASMR IV) en termes d’efficacité dans la prise en charge des patients coronariens stables, ayant un antécédent d’infarctus du myocarde et/ou de revascularisation, sans dysfonction ventriculaire, tels qu’évalués dans l’étude EUROPA ».
A noter que le ramipril (TRIATEC® aujourd’hui génériqué), est également très cher par rapport aux anciens IEC, les mieux documentés sur le plan des bénéfices cliniques (captopril, énalapril). Notons que si l’étude HOPE apporte un peu plus qu’EUROPA dans la mesure où la mortalité totale et cardiovasculaire sortent avec un bénéfice significatif, c’est en comparaison au placebo ; Et faute d’étude comparative, nous ne connaissons pas davantage l’intérêt du ramipril sur les autres IEC qu’avec le périndopril ;
Verre à moitié plein, également : le fait que la HAS escamote totalement les travaux d’une équipe de chercheurs emmenée par Martin STRAUSS et qui mettent en évidence un risque supérieur d’infarctus du myocarde avec les sartans !
Ce cardiologue de Toronto, Canada, et deux autres confrères anglais, ont analysé scrupuleusement l’ensemble des études sartans versus placebo. Leurs travaux mettent en évidence une augmentation paradoxale du risque d’infarctus du myocarde avec les sartans. Dans 9 des 11 études cliniques les plus importantes comparant un sartan au placebo, davantage d’infarctus du myocarde sont observés avec les sartans ; La différence est significative dans deux essais : VALUE et CHARM-alternative ; L’étude VALUE a comparé chez 15.000 patients à haut risque CV le valsartan à l'amlodipine, avec un suivi de 4,2 ans : 19% d'infarctus fatals ou non en plus avec le valsartan (p=0,02) ; L'étude CHARM-alternative, enregistre 36% d'infarctus du myocarde en plus dans le groupe candesartan en dépit d'une réduction de la pression artérielle.Les auteurs avancent des explications biologiques ou pharmacodynamiques pour expliquer ce paradoxe des ARAII.
Cliquer sur l'image ci-dessous pour ouvrir la diapositive
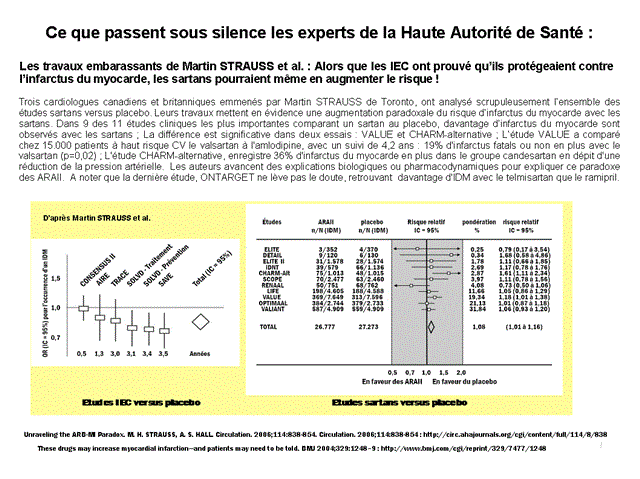
Et l’étude ONTARGET, citée par la HAS, ne dissipe aucunement le trouble suscité par ces travaux bien embarrassants, puisque davantage d’infarctus du myocarde sont également observés dans le groupe telmisartan par rapport au comparateur ramipril (sans différence significative néanmoins, mais l’essai n’avait pas été conçu pour répondre à cette question) ;
Verre à moitié vide, la HAS ne cite pas les résultats déconcertants de l’étude TRANSCEND (vraiment rien de transcendantal pourtant) publiée ce mois-ci dans l’édition papier du Lancet (mais dès la fin août dans la version « online »), qui montre que chez les malades intolérants aux IEC, le telmisartan ne fait pas mieux que le placebo ! Et puisque c’est la seule étude conduite à notre connaissance chez ce type de patients dont la HAS nous précise qu’il s’agit de la « population cible » pour les sartans, la question de leur place réelle dans la stratégie thérapeutique devient brulante !
Dans un premier temps, le Ministre Eric WOERTH avait salué la sortie de l’avis de la HAS, en déclarant au Quotidien du Médecin : « Je note qu'un premier référentiel a été publié sur les IEC-sartans, cela va dans la bonne direction. La liberté de prescription doit être mieux guidée ».
Hier, devant Les Echos, il s’est montré plus impatient...
Le ministre devrait accorder ses violons avec ceux de ses collègues au gouvernement, ma consoeur Roselyne BACHELOT et son prédécesseur Xavier BERTRAND, qui, eux, ne semblent pas vouloir d’une maîtrise médicalisée efficiente ;
Qu’il interroge également Monsieur Frédéric VAN ROEKEGHEM, Directeur de l’UNCAM, qui a donné des consignes très claires à ses directeurs de caisses pour ne rien faire qui puisse contrarier les industriels du médicament...
En attendant que cesse la langue de bois, toujours maniée avec dextérité dans la langue de Molière, et que les hommes politiques soient également tenus de déclarer leurs éventuels liens d’intérêt qui les unissent aux entreprises qui commercialisent ou fabriquent des produits de santé (Comme doivent déjà s’y conformer les professionnels de santé, selon le récent article L4113-13 du Code de la Santé Publique : http://www.legifrance.gouv.fr/affichCodeArticle.do?idArticle=LEGIARTI000006688689&cidTexte=LEGITEXT000006072665&dateTexte=20080614&fastPos=1&fastReqId=270241154&oldAction=rechCodeArticle)
Bien cordialement
François PESTY
Télécharger la fiche de bon usage des IEC et sartans, HAS 10/2008 : HAS_fiche_bon_usage_iec_sartans_011008.pdf
Télécharger l’avis de la commission de la transparence du 23/01/2008 portant sur le COVERSYL®, périndopril, motivé par la nouvelle indication AMM obtenue sur la base de l’étude EUROPA : Avis_CT_COVERSYL_8mg_23-01-2008.pdf
Télécharger l’étude EUROPA (COVERSYL®, périndopril versus placebo) : Lancet_EUROPA_Perindopril_01-09-2003.pdf
Télécharger l’analyse publiée par Martin STRAUSS et al. dans Circulation, une revue spécialisée en cardiologie, et qui objective une augmentation du risque d’infarctus du myocarde avec les sartans, alors que les IEC ont démontré qu’ils le faisaient baisser nettement : Circulation_Strauss_Sartans_MI_risk-2006.pdf
Télécharger l’étude ONTARGET (Telmisartan versus ramipril) : NEJM_ONTARGET_study_Telmisartan_ramipril_or_both_10-04-2008.pdf
Télécharger l’étude TRANSCEND (Telmisartan versus placebo chez les patients intolérants aux IEC) : Lancet_TRANSCEND_study_09-2008.pdf
Télécharger l’interview de M. Eric WOERTH, Ministre du budget, au Quotidien du Médecin (13/10/2008) : Quotimed_E_WOERTH_interview_13-10-2008.pdf
Télécharger l’article des Echos (21/10/2008) « Pour Woerth, la Haute Autorité de santé travaille trop lentement » : LesEchos_Pour_E_WOERTH_La_HAS_travaille_trop_lentement_21-10-2008.pdf
Télécharger l’interview accordée au journal Les Echos par Laurent DEGOS, président de la HAS (21/10/2008) « Notre rôle n’est pas de rationner les soins » : LesEchos_L_DEGOS_Notre_role_n'est_pas_de_rationner_les_soins_21-10-2008.pdf
Télécharger la Loi de financement de la sécurité sociale pour 2008 : http://www.legifrance.gouv.fr/jopdf/common/jo_pdf.jsp?numJO=0&dateJO=20071221&numTexte=1&pageDebut=20603&pageFin=20639
11/09/2008 - Après l’avalanche récente de mauvaises nouvelles pour les « fausses innovations ruineuses (pour la sécu) » de l’industrie pharmaceutique, la Cnamts daignera-t-elle enfin lancer ses DAM dans les cabinets médicaux pour que les médecins puissent enfin avoir accès à une information non biaisée sur le médicament ?
Ces deux dernières semaines ont été extrêmement riches en actualités médicales quelque peu « bouleversantes » pour les fausses innovations coûteuses qui menacent l’équilibre de notre système solidaire de santé.
C’est tout particulièrement le cas en cardiologie ; En effet, à l’occasion du récent congrès de la société européenne de cardiologie couplé à celui de la société européenne d’hypertension, nous avons eu droit à une avalanche de publications dans les plus prestigieuses revues internationales (Lancet et New England Journal of Medicine), qui démontrent une fois de plus à quel point il devient urgent de mettre en place une formation / information des médecins sur le médicament qui soit complète, objective et indépendante de l’industrie ;
Pour illustrer le propos, prenons quatre exemples d’études publiées ces derniers jours dans les deux domaines thérapeutiques les plus onéreux de la médecine ambulatoire ;
- Pour les hypolipémiants :
L’étude SEAS (http://content.nejm.org/cgi/content/full/NEJMoa0804602) est un second échec consécutif pour l’ézétimibe associé à la simvastatine (à 40mg), commercialisé en France sous le nom d’INÉGY® (+179% en 2007, d'après la Cnamts, en nombre de patients traités), après celui de ENHANCE (étude publiée en mars dans la même revue après un « forcing » des parlementaires américains sur les labos MSD et Schering Plough, qui ne comprenaient pas que les résultats de cette étude terminée depuis déjà deux ans n’avaient toujours pas été publiés) ; Non seulement, SEAS, malgré une baisse de 61% du LDL-cholestérol dans le groupe traité, n’a pas permis après un suivi moyen de 52 mois chez les 1.873 patients inclusprésentant une sténose aortique asymptomatique, de démontrer le moindre bénéfice clinique par rapport au placebo sur le critère principal (lequel comprenait les décès d’origine cardiovasculaire, les remplacements de valve aortique, les infarctus du myocarde, hospitalisation pour angor instable, insuffisance cardiaque, angioplastie coronaire ou encore les accidents vasculaires cérébraux non hémorragiques), mais en plus, davantage de cancers ont été observés avec le médicament par rapport au groupe de contrôle ayant reçu le placebo (HR 1,67 ; p=0,05) ; Et à en croire les éditorialistes du NEJM (http://content.nejm.org/cgi/content/full/NEJMe0807200v1 et aussi : http://content.nejm.org/cgi/reprint/NEJMe0807372.pdf?resourcetype=HWCIT), ce n’est pas la publication des résultats intermédiaires de deux études en cours, présentés dans le même numéro de la revue (http://content.nejm.org/cgi/content/short/NEJMsa0806603v1), qui soit de nature à lever la suspicion maintenant portée par la communauté scientifique sur ce médicament (Les auteurs soulignent que les phytostérols, dont l’ézétimibe bloque l’absorption intestinale comme il le fait pour le cholestérol, pourraient jouer un rôle protecteur contre les cancers, ce qui donne un substrat scientifique aux observations inquiétantes de SEAS) ;
L’étude GISSI-HF, constitue aussi un second revers important pour la rosuvastatine, CRESTOR® (+57% en 2007, d'après la Cnamts, + 129% pour le seul CRESTOR® 5mg), après l’étude CORONA (Résultats décevants, novembre 2007). Chez 4.574 patients insuffisants cardiaques suivis pendant 3,9 années en moyenne, malgré une baisse de 32% du LDL-cholestérol, la rosuvastatine 10 mg ne fait pas mieux que le placebo sur le critère composite principal qui additionnait les décès et les réhospitalisations pour cause cardiaque(http://www.thelancet.com/journals/lancet/article/PIIS0140673608612404/abstract?isEOP=true) ;
- Pour les antihypertenseurs de la classe des sartans :
L’étude PRoFESS (http://content.nejm.org/cgi/content/full/NEJMoa0804593), constitue aussi une déconvenue cinglante pour le Telmisartan (MICARDIS®/PRITOR®, +15,3% en 2007 d'après la Cnamts), après la « note passable » qu’il avait obtenu en mars dernier avec la publication de l’étude ONTARGET (où il s’était montré non inférieur, mais pas supérieur, au ramipril, TRIATEC®) ; Ce sartan, que d’aucun présentaient comme le « best in class » (le meilleur sur le plan thérapeutique) à défaut d’être le « first in class » (le meilleur sur le plan de ses ventes, place occupée par le TAREG® de Novartis), en raison d’une demi-vie plus longue que ses nombreux rivaux de la même classe et qui lui procurerait en théorie un meilleur contrôle de la tension artérielle sur l’ensemble du nycthémère (Voir la brochure publicitaire sur le site que le laboratoire consacre à ce médicament : http://www.micardis.com/Images/Downloads/Micardis_Product_Monograph.pdf) ; Dans cet essai, l’un des plus importants en nombre de patients recruté (plus de 20.000 patients), le telmisartan a été évalué à la dose de 80mg par jour contre placebo dans les 2,5 années qui suivaient une premier accident vasculaire cérébral ; Malgré un meilleur contrôle de la tension artérielle par rapport au groupe de contrôle (plus basse de 3,8/2,0 mmHg), la prévention d’un second AVC, ou de tout autre événement cardiovasculaire majeur n’est pas améliorée par le médicament, pas plus que la survenue d’un diabète chez ces patients ;
L’étude TRANSCEND, enfin, fait reparler du telmisartan dans le Lancet, où il enchaîne un deuxième « flop » particulièrement instructif ! Il s’agit justement du deuxième bras de l’étude ONTARGET, dans lequel ont été inclus tous les patients intolérants aux IEC (ONTARGET/TRANSCEND prévoyait une période initiale pendant laquelle on donnait le ramipril, IEC comparateur que le telmisartan avait choisi de défier dans l’étude ONTARGET, et tous les patients intolérants (Il leur était demandé par exemple s’ils avaient toussé... Et qui n'a pas toussé dans les derniers quinze jours ?), soit environ 20%, étaient « recalés » pour ONTARGET et invités à rejoindre l’essai TRANSCEND ; Donc, nous avons réunis dans cette étude « la fine fleur » des intolérants aux IEC, ceux-là mêmes pour lesquels les sartans auraient toute leur place, d’après notamment les avis de la commission de la transparence, ou certaines recommandations de bonne pratique (IEC en première intention, sartans en cas d'intolérance aux IEC) ; Ainsi, 5.926 patients présentant une maladie cardiovasculaire, un diabète ou des atteintes d’organes, ont été randomisés pour recevoir 80 mg de telmisartan ou le placebo, et suivis pendant 56 mois ; Le critère composite principal de l’étude combinait les décès cardiovasculaires, infarctus du myocarde, accidents vasculaires cérébraux, et une hospitalisation pour insuffisance cardiaque ; Bien que l’antihypertenseur aient permis d’abaisser la pression artérielle moyenne de 4,0/2,2 mmHg par rapport au groupe témoin, aucune différence significative n’est obtenue sur le critère principal. Seule une modeste amélioration d’un critère secondaire a été observée. Comme par hasard, les droits d’auteurs n’ont pas été versés à la revue par les laboratoires Boehringer Ingelheim (ou par GSK, le « co-marketer » de la molécule), et seul l’abstract n’est pas payant : http://www.thelancet.com/journals/lancet/article/PIIS0140673608612428/abstract?isEOP=true#fn1
Ne croyez-vous pas que l’accès des médecins, par un canal « audible » de communication, à ce type informations, puisse leur donner une vue plus juste du service médical réellement rendu par ces fausses innovations coûteuses, que l’idée qu’ils s’en font au travers des informations biaisées qu’ils reçoivent des laboratoires ?
IL Y A VRAIMENT DU GRAIN A MOUDRE POUR QUI VOUDRAIT APPORTER AU MÉDECINS UNE INFORMATION PLUS COMPLÈTE ET NON BIAISÉE SUR LE MÉDICAMENT
Mais, ce faisant, il semble que la Cnamts ne daigne toujours pas autoriser et former son bon millier de DAM à aborder les études cliniques lors de leurs entretiens en face à face au cabinet du médecin...
Les professionnels de santé attendent qu’on leur apporte des informations avec un contenu à valeur ajoutée pour leur pratique, pas qu’on leur dicte leur conduite sans pédagogie !
Mesdames et messieurs les politiques, à l’Elysée, au gouvernement, à l’Assemblée Nationale et au Sénat, vous qui vous afférez (ou affairez ?...) sur le PLFSS 2009, pensez s’il vous plait aux bons moyens de délivrer enfin aux médecins libéraux et hospitaliers, généralistes et spécialistes, une information de meilleure qualité sur le médicament (complète, indépendante, documentée, publiée, expliquée...) ; Et peut être alors, que le bouclage des budgets de la sécu chaque année serait-il moins douloureux !
Bien cordialement
François PESTY
PS : Mon petit doigt m’indique que le département de l’Aude (et sa caisse) détiennent toujours, trois ans après le début de notre campagne « expérimentale » de visites médicalisée des DAM sur les antibiotiques, le coût moyen standardisé d’antibiothérapie le plus bas de France ! Et ce, en dépit des nombreuses campagnes effectuées depuis sur cette thématique, sous le commandement de la Cnamts...
01/08/2008 – Le projet de Loi visant à généraliser la « visite académique » sur tout le territoire nord américain pour « neutraliser » les effets néfastes du marketing pharmaceutique sur la prescription du médicament a été déposé hier à la Chambre des représentants et au Sénat. Une excellente « news » passée totalement sous silence en France !

Nous en avions parlé ici même (cette page, le 11/03/2008). C'est chose faite ! Le Congrès américain, composé de la Chambre des représentants et du Sénat, va être amener prochainement à se prononcer sur un projet de Loi fondateur, instaurant la « visite académique » sur tout le sol étatsunien. En effet, celui-ci a été déposé hier au niveau des deux chambres par un groupe de parlementaires démocrates.
Essayons-nous à en traduire le début :
« Cette Loi modifie le Code de Santé Publique afin d’obtenir des subventions et contrats de formation et de visites médicalisées auprès des professionnels de santé portant sur le médicament de prescription.
Il s’agit de créer un programme autorisant le subventionnement ou l’établissement de contrats dont l’objet est l’élaboration de programmes de formation et de matériel éducationnel sur les preuves existantes portant sur l’efficacité, la tolérance et les coûts comparés des médicaments de prescription, d’automédication et des interventions non médicamenteuses... Pour le développement et la mise en œuvre de programme dont le but est d’entraîner d’une façon appropriée et de déployer des professionnels de santé pour former les médecins et autres prescripteurs de médicaments sur la tolérance, l’efficacité, et les coûts comparés des médicaments de prescription, d’automédication et des stratégies d’intervention non médicamenteuses pour le traitement de certaines indications thérapeutiques.
... Pour être autorisé à recevoir une subvention ou à signer un contrat, le contractant devra être une organisation gouvernementale ou à but non lucratif, capable de démontrer une expertise clinique, incluant : une école médicale, une académie de médecine, une école de pharmacie, une société de pharmaciens, un institut de recherche, ou toute autre organisation que le « Secrétaire de Santé Publique* » jugera appropriée. Qu’il ne reçoive aucune aide de la part des fabricants de médicaments utilisés dans les indications visées, ou de toute autre organisation financée par l’industrie, pendant la période débutant un an avant la soumission du dossier de candidature et se terminant un an après attribution de la subvention ou l’obtention du contrat...
Voici quelques titres dans les médias américains :
Sur le blog santé du Wall Street Journal « Le gouvernement fédéral pourrait subventionner un programme destiné à contrer la visite médicale sur le médicament » : http://blogs.wsj.com/health/2008/07/31/feds-may-fund-program-to-counter-drug-rep-sales-pitches/ (A lire également les commentaires laissés par les internautes, dont le mien posté le "August 3, 2008 at 2:23 pm"...) ;
Sur « Medical news Today » : Les membres du Sénat et de la Chambre des représentants introduisent une Loi pour délivrer aux médecins une information non biaisée sur le médicament » : http://www.medicalnewstoday.com/articles/116894.php
Sur le site de l’un des nombreux sponsors de la Loi « prescriptionproject.org » : « Le Congrès introduit une Loi sur la visite académique et souligne la nécessité d’une information non biaisée sur les médicaments » : http://www.prescriptionproject.org/newscenter?id=0068
Sur le blog « pharmalot » : « Introduction de la Loi sur la visite académique au Congrès » : http://www.pharmalot.com/2008/07/academic-detailing-bill-is-introduced-in-congress/
Sur « Medical Marketing & Media » : http://www.mmm-online.com/Academic-detailing-bill-introduced/article/113239/
Il sera bien entendu intéressant de suivre les débats. On croise les doigts pour que ce texte soit adopté outre atlantique...
Néanmoins, ne rêvons pas trop, comme l’indique très cyniquement le site pro Big Pharma « Medical Marketing & Media » (voir plus haut le lien), « Le Congrès ayant ajourné ses travaux pour cause de vacances en août et les élections (présidentielles) approchant, la Loi a peu de chance de voir le jour de sitôt ! » ; A noter également sur le même média, les propos relevés de M. John Kamp, porte parole de l’association des directeurs de la communication de l’industrie pharmaceutique, qui déclare que cette Loi « violerait l’article I de la constitution américaine ». Ce « pauvre chou » s’estimerait ainsi privé de la liberté d’expression, puisque les labos ne peuvent parler que de ce qu'autorise la FDA (l’agence du médicament), alors que tout serait permis à la « visite académique » ; Il ose même dire que le gouvernement aurait là un conflit d’intérêt !
François PESTY
(*) : Un haut fonctionnaire de l’administration américaine, alter ego probable de notre Directeur Général de la Santé.
Télécharger le projet de Loi (trouvé sur le site du Wall Street Journal) intitulé « pour une formation et une visite médicale indépendante sur le médicament » (‘‘Independent Drug Education and Outreach Act of 2008’’ encore qualifié de ‘‘Academic Detailing Bill’’ par le Wall Street Journal : /Documents/WSJ080730_AcademicDetailingBill.pdf
21/07/2008 - Alors que les USA se prépareraient à lancer une « visite académique » sur tout leur territoire, en envoyant des infirmières et des pharmaciens à la rencontre des médecins pour leur apporter une information non biaisée sur le médicament et contrer ainsi la mauvaise influence qu’exercent sur eux les firmes pharmaceutiques (Cf. plus haut), la France, elle, persiste toujours dans la voie du « rideau de fumée » de la Charte de qualité de la visite médicale.
Malgré que nous n’ayons toujours pas la moindre mesure d’impact de la Charte de la visite médicale plusieurs années après sa mise en place en médecine de ville, le CEPS et le LEEM viennent d’en élargir le champ d’application à l’activité des forces de ventes hospitalières.
Télécharger l’avenant N°2 à la Charte en suivant le lien : /Documents/CEPS_LEEM_Avenant_N°2_Charte_VM-hôpital_07-2008.pdf
Télécharger Le communiqué de presse du LEEM « Les Entreprises du Médicament signent avec le Comité Economique des Produits de Santé l’extension de la charte de la visite médicale au secteur hospitalier », en date du 24/07/2008 : /Documents/LEEM_communiqué_de_presse_avenant_charte_VM_hôpital.pdf
Il suffit de lire le premier paragraphe pour comprendre qu’il ne peut s’agir que de « pieuses intentions » :
« La visite médicale a pour objet principal d’assurer la promotion des médicaments auprès du corps médical et de contribuer au développement des entreprises du médicament. Elle doit à cette occasion favoriser la qualité du traitement médical dans le souci d’éviter le mésusage du médicament, de ne pas occasionner des dépenses inutiles et de participer à l’information des médecins de ville et des médecins et pharmaciens hospitaliers ».
Sérieusement, voyez-vous les VM d’Astra Zeneca énoncer l’ASMR et l’avis de la commission de la transparence du CRESTOR® : « Dans les hypercholestérolémies pures et mixtes, CRESTOR® n'apporte pas d'amélioration du service médical rendu (ASMR V) par rapport aux autres statines... Pour la majorité des patients présentant une hypercholestérolémie, les besoins thérapeutiques sont théoriquement couverts par l'utilisation des autres statines ayant démontré un bénéfice clinique. Dans ces conditions, la Commission de la Transparence considère CRESTOR® comme un traitement de deuxième intention. », ou mieux encore, les imaginez-vous présenter les résultats de la seule étude clinique publiée à ce jour avec la rosuvastatine, qui à la dose de 10mg par jour ne fait pas mieux que le placebo (étude CORONA, N Engl J Med 2007;357). Et ceux de SCHERING PLOUGH et de MSD qui assurent la promotion d'INEGY®, vont-ils spontanément aborder au cabinet du médecin les piteux résultats des études ENHANCE et SEAS ? Au contraire, nous apprenions cette semaine que CRESTOR® avait vu ses ventes croître de +27% !
En effet, qui peut croire un seul instant à la sincérité des entreprises du médicament pour « éviter des dépenses inutiles », synonymes pour elle d’un profit maximisé et d’une satisfaction garantie de l’actionnariat, comme de meilleures primes sur résultat de leurs « vendeurs »...
Le CEPS, et l’Etat qui est derrière*, sont-ils à ce point naïfs ? Bien sur que non. L’hypocrisie est à son comble, car cela arrange tout le monde :
- Les politiques continueront à bénéficier de la gratitude du lobby pharmaceutique, et ils en ont bien besoin pour toucher leurs électeurs...
- L’industrie pourra faire prospérer son business en toute tranquillité, puisque les médecins continueront à ne recevoir que des visiteurs médicaux super-entraînés, vectorisant les stratégies marketing peaufinées par leurs états majors (La visite des DAM restant à son niveau actuel d’amateurisme, sans impact tangible sur les comportements de prescription) ;
Les comités paritaires de suivi qui avaient été désignés, devaient nous rendre compte de l’impact sur le bon usage du médicament de la charte et de la certification sur la base du référentiel élaboré sans délai par la Haute Autorité de Santé. Aujourd’hui, la quasi totalité des labos a dû se mettre en conformité avec la Loi et a fait certifier ses réseaux de visite médicale en ville, mais nous ne savons toujours pas qu’elle en aura été l’impact.
La HAS devrait poursuivre à la rentrée, avec l’élaboration d’un référentiel de certification de la visite adaptée à la démarche en établissement de santé. Mais, à quoi peut bien servir tout cela ?
Pour rappel, « la charte humoristique de la bonne visite médicale », que j’avais proposée au moment de la discussion à l’Assemblée Nationale du PLFSS 2004 qui instaurait cette charte hypocrite, et qui est malheureusement toujours d’actualité :
Charte « humoristique » de la bonne visite médicale
1. J’inciterai mes médecins au strict respect des indications prévues par l’AMM. Et, tant pis si je ne touche plus aucune prime !
2. Surtout, je veillerai à ce qu’ils se conforment uniquement aux populations cibles définies par l’avis de la commission de la transparence. Et cela, même si je dois renoncer à être à nouveau la lauréate du « challenge » organisé par le labo et récompensé par 2 semaines de vacances à Rio de Janeiro ! .
3. Je prends l’engagement de visiter selon la même fréquence tout médecin de mon secteur, quel que soit son potentiel de prescription. En accord avec ma hiérarchie, je laisserai donc à la maison les outils performants de ciblage de mes médecins (ordinateur de poche, logiciels, croisement de fichiers...).
4. Je n’hésiterai pas à avouer spontanément le coût très supérieur de mon médicament par rapport à ses équivalents thérapeutiques.
5. J’énoncerai systématiquement l’ASMR de mon produit, même mineure (niveau IV) par rapport à un comparateur plus conventionnel !
6. Je fais totalement confiance à mes directions marketing et médicales, pour me fournir toute étude clinique importante, même défavorable à mes produits.
7. J’aborderai sans détour et avant même d’y avoir été invitée, les effets secondaires et interactions.
8. Si un générique de mon médicament existe déjà, je le mentionnerai sans hésiter une seule seconde !
9. Je recommanderai fortement à mes médecins, d’utiliser en première intention les médicaments conseillés par les RBP, même s’ils ne sont plus promus par le(s) labo(s) (ex : princeps génériqués).
10. Je rappellerai à chaque fois la durée de traitement à ne pas dépasser. Surtout dans le cas des psychotropes que je présente.
11. Je serai capable de dire à mon médecin qu’il n’emploie pas mon médicament chez ses patients à la bonne posologie, au risque de le fâcher !
12. Assurément, ma direction changera le mode de calcul de mes objectifs et primes. Ma performance ne sera plus jugée sur des volumes de ventes ou la progression d’une part de marché, mais sur la proportion des prescriptions conformes à l’AMM, aux RMO, RBP, avis de la transparence…
13. Je préfère passer plus de temps sur un sujet d’intérêt général, comme l’observance ou les génériques, même si cela profitera davantage aux autres labos !
14. Par souci d’objectivité, je présenterai aussi les articles de la revue Prescrire, très critiques à l’égard de mon produit !
15. Je ne proposerai à mes médecins pas plus d’une invitation au restaurant par an, même pour mes meilleurs prescripteurs et mes plus forts potentiels.
16. Je ne ferai plus mon petit numéro de charme. Ainsi, j’éviterai soigneusement toute jupe un peu courte, talons hauts ou décolletés vertigineux, et j’opterai désormais pour le pantalon et un gilet non moulant.
17. Tout manquement à cette charte sera lourdement sanctionné par un triplement de mes primes !
François PESTY
(*) : M. Noël RENAUDIN, Président du CEPS reçoit sa lettre annuelle de cadrage signée de plusieurs ministres, pas moins de 4 me semble-t-il.
10/07/2008 - Alors que Roselyne BACHELOT-NARQUIN et Eric WOERTH veulent 1 milliards d’euro en plus dans le plan d’économie de la Cnamts, le HCAAM souhaite qu´une étude soit menée pour déterminer dans l´ensemble de la pharmacopée, la part des produits qui pourraient être prescrits au sein du répertoire, sans perte de chance pour le malade.
Comme si on ne les connaissait pas… Relisez PUPPEM Messieurs Dames ! Et rendons enfin opérante la visite des DAM sur le médicament …
On se demande véritablement à quoi peut bien servir ce « HAUT CONSEIL », observateur avisé, mais ramassis consensuel des lobbys de tous poils, dont l’avis purement consultatif n’a été suivi d’aucune action par la Cnamts. Laquelle reste totalement instrumentalisée par l’exécutif… L’hypocrisie est à son comble, car je ne vois pas où le HCAAM peut bien trouver la maîtrise médicalisée et les changements de comportement dans l’évolution récente : En dehors du plan médicament 2006, le summum d’une maîtrise purement comptable avec son cortège de baisses de prix, de déremboursements et l’arrivée fort opportune de nouveaux génériques, sitôt contournés par la prescription des médecins qui n’ont jamais été laissé autant sous influence des firmes pharmaceutiques que depuis que la Cnamts fait semblant de piloter le dispositif des DAM !
Qui plus est, ce rapport entérine (p19), comme s’il s’agissait de parole d’évangile, le chiffre de 259 millions d’euros de prétendues économies revendiqué par la Cnamts au tître de ses actions de maîtrise médicalisée (Ce serait son meilleur cru depuis 2005, qui est prêt à croire ça ?). Un peu d’esprit critique SVP ! Mais, que fait la Cour des Comptes ? Heureusement qu’il y a ces graphiques qui prouvent exactement le contraire (voir plus bas), et qui confirment ce que démontrait une étude inédite, réalisée à partir des chiffres MEDIC’AM 2007 (un fichier qui semble depuis avoir disparu du site ameli.fr, bravo la transparence de la Cnamts !), et publiée ici même (Voir l’actualité du 23/05/2008) ;
Par ailleurs, cette note du HCAAM n’accorde pas plus d’importance au dispositif des DAM que le Directeur de la Cnamts (Voir l’actualité précédente)… C’est dire le niveau de « renoncement » auquel en sont arrivés les membres du HCAAM…
Ce rapport est néanmoins instructif à deux égards :
Il illustre avec élégance ce qu’il conviendrait d’appeler le « détournement » de la prescription médicale hors du répertoire orchestré par l’industrie du médicament, voir ci-dessous 3 graphiques extraits du rapport, montrant les glissements de prescription d’antihypertenseurs, de statines et d’inhibiteurs de la pompe à protons ;
Il ne craint pas de révéler aussi en partie le contenu de la lettre ministérielle d’orientation adressée le 6 octobre 2006 à M. Noël RENAUDIN, président du CEPS (Comité économique des produits de santé) : « Nous restons attachés à un soutien aux médicaments apportant un véritable progrès thérapeutique et donc à une rémunération de ce progrès thérapeutique qui exclut toute politique de « jumbo class »». Ecrivait le ministre de l'époque. Voilà donc le document secret auquel faisait probablement allusion M. Bertrand FRAGONARD, président du HCAAM, lorsqu’il s’est « laché » devant les députés de la commission des affaires sociales (Voir plus bas l’actualité du 19/10/2007) ;
Ci-dessous les graphiques qui se passent de tout commentaires… Les gisements d’économie sont connus et les moyens de les réaliser aussi !
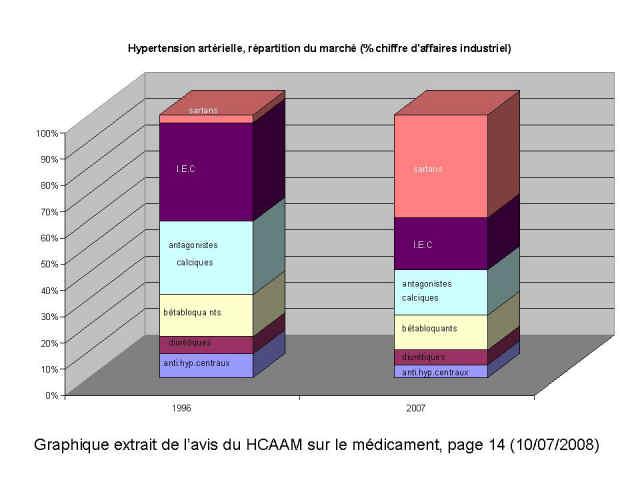
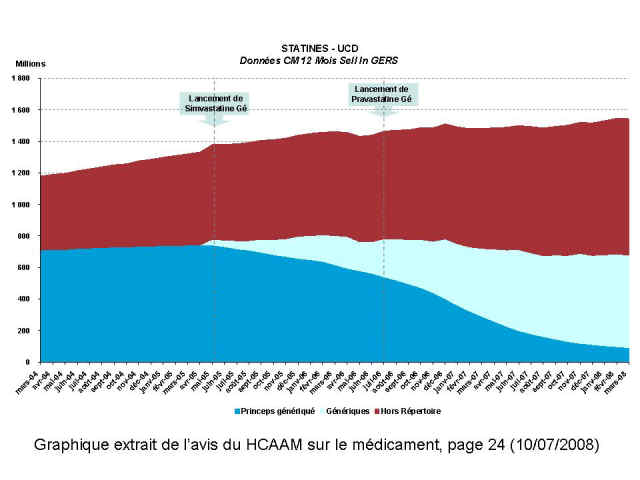
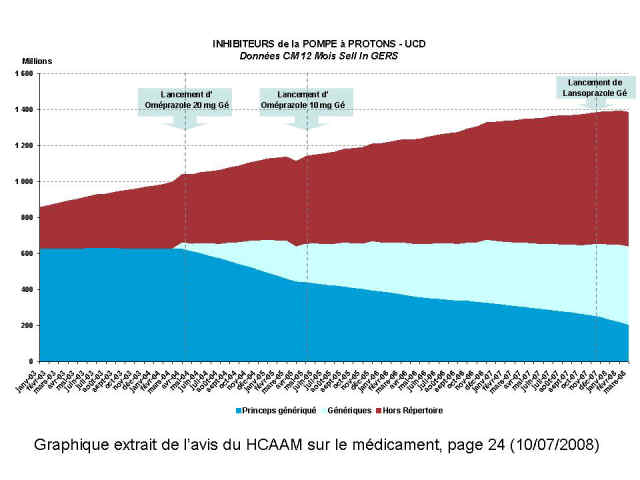
Pardon pour ce coup de colère, mais trop, c’est trop…
Enfin, en cette période estivale, proposons quelques lectures enrichissantes puisées dans la presse récente afin que nos décideurs « ouvrent les yeux » et prennent enfin les décisions courageuses avant qu’il ne soit trop tard, pour sauver notre système solidaire :
« Médicaments trop chers », excellent article fort bien documenté d’Anne JEANBLANC, Le Point, 03/07/2008, et qui pose les bonnes questions : /Documents/LE_POINT_médicaments_trop_chers_03-07-2008.pdf
« Nos quatre pistes pour réduire le trou de la Sécu », par Sabine SYFUSS-ARNAUD, dans Challenges, 03/07/2008, où l’on reparle de l’expérience de la caisse de l’Aude… : /Documents/CHALLENGES_Trou_sécu_Sabine_ARNAUD_03-07-2008.pdf
« Comment les labos creusent le trou de la sécu », non moins excellent dossier réalisé par Didier BERNEAU, Magasine VIVA, juin 2008 (6 Mo) : /Documents/Viva_presse_Le_trou_de_la_sécu_06-2008.pdf ou sur le web : http://www.viva.presse.fr/spip.php?page=dossier&id_mot=351
Télécharger le nouvel avis sur le médicament du HCAAM (source, le site egora.fr : http://www.egora.fr/commun/script/winbreve.asp?newsid=47469) : /Documents/HCAAM_medicament_10-07-2008.doc
François PESTY